Презентація на тему «Валентність» (варіант 1)

Валентність

Валентність - це властивість атомів хімічного елемента з'єднуватися з певним числом атомів того самого або інших хімічних елементів.

Щоб схарактеризувати валентність з кількісного боку, за одиницю взяли валентність атома Гідрогену.
Якщо це так, то атом Хлору в НСl також одновалентний, оскільки він утримує тільки один атом Гідрогену.
Атом Оксигену в Н2О — двовалентний, оскільки утримує два атоми Гідрогену.
Відповідно атом Нітрогену в NH3 — тривалентний, а атом Карбону в СН4 — чотиривалентний.
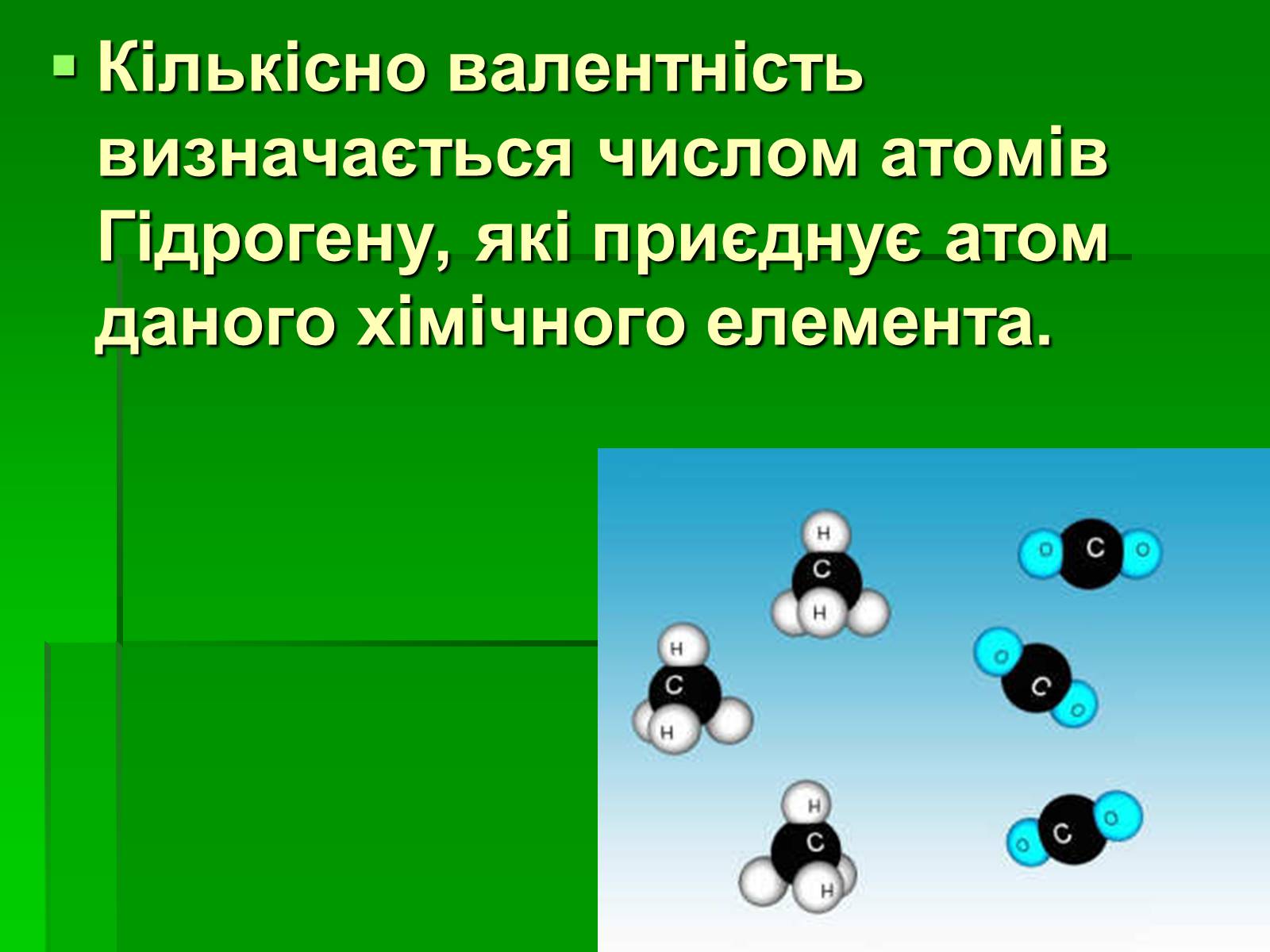
Кількісно валентність визначається числом атомів Гідрогену, які приєднує атом даного хімічного елемента.

Валентність залежить від числа валентних електронів.
Валентні електрони розташовуються на зовнішньому шарі в елементів головних підгруп і зовнішньому й d – підрівні передостаннього шару в елементів побічних підгруп.
Вуглець С 1s2 | 2s2 p2 – валентні електрони
Залізо Fe 1s2 | 2s2 p6 | 3s2 p6 d6 | 4s2 – валентні електрони

Валентні можливості визначають по будові атомів хімічних елементів у нормальному й збудженому стані.
Число неспарених валентних електронів у нормальному стані визначає мінімальну валентність, у збудженому стані – проміжні й максимальну (вищу) валентність:
↑↓
↑
↑
↑
↑
↑
↑
Валентність - II (мінімальна) Валентність – IV (вища)

Вища (максимальна) валентність здебільшого збігається з номером групи хімічного елемента.
Мінімальну валентність неметалів можна визначити по таблиці Менделєєва різницею між 8 і № групи хімічного елемента.
8-№групи=валентність

Постійну валентності мають
Н –I,
O-II,
метали Iа групи - I,
групи II - II
Al – III

Визначення валентності елементів за формулами їхніх сполук.
За формулою речовини, яка складається з двох елементів, можна визначити валентність одного елемента, якщо відома валентність іншого.

У формулах бінарних сполук число одиниць валентності всіх атомів
одного елемента повинне дорівнювати числу одиниць валентності всіх атомів іншого елемента.

Алгоритм визначення валентності по формулі:
Позначити відому валентність елемента (постійні валентності мають Н –I, O-II, метали Iа групи - I, Iiа групи II і Al – III): II
Наприклад: SO3
Знайти загальне число валентностей елемента з відомою валентністю (валентність помножити на індекс цього елемента):
наприклад, для кисню з формули SO3 загальне число валентностей буде рівно:
2 (валентність кисню)∙ 3 (індекс кисню) = 6
Розділити знайдене загальне число валентностей на індекс іншого елемента – це й буде невідома валентність:
6 (загальне число валентностей) :1(індекс сірки) = 6