Презентація на тему «Сульфур» (варіант 1)

Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
СУЛЬФУР

Періодична система хімічних елементів Д.І.Менделєєва
Періоди
1
2
3
4
5
6
7
Ряди
1
2
3
4
10
9
8
7
5
6
Групи елементів
I
II
VI
V
VII
III
IV
VIII
Характеристика
1.
Відома людині з давніх-давен. Згадується у епічних поемах Гомера.
2.
У Періодичній системі знаходиться в 3 періоді, VІ група, головна підгрупа.
3.
У природі зустрічається як у вільному так і у зв'язаному станах.
4.
Крихка кристалічна речовина жовтого кольору. Погано проводить теплоту і не проводить електричного струму
5.
Найхарактернішими для Сульфура є ступені окиснення –2, 0, +4, +6.
32
+16
S

Алотропні модифікації Сульфура
пластична
кристалічна
ромбічна
моноклінна
сірка

Хімічні властивості
При незначному нагріванні сірка енергійно реагує із багатьма металами (з рідкою ртуттю), воднем, виступаючи як окисник:
Fe +S FeS
2Al+3S Al2S3
H2+S H2S
При дії кисню і галогенів (Cl, F) сірка виявляє відновні властивості:
S+O2 SO2
S+2Cl2 SCl4

H2S (сірководень) – газ з різким неприємним запахом, дуже отруйний. У розчинах – це слабка кислота.
SO2 (сірчистий газ) - оксид Сульфуру (ІV) за звичайних умов - безбарвний газ з різким запахом, є отруйним. Це кислотний оксид добре розчинний у воді. Частково реагує з водою з утворенням сульфітної кислоти:
SO2+H2O H2SO3
SO3 - оксид Сульфуру (VI), безбарвна рідина, твердне за t0 < 16,8 0С, перетворюючись на світлу кристалічну масу, схожу на мед, енергійно сполучається з водою, утворюючи сульфатну кислоту:
SO3+H2O H2SO4

Сполуки Сульфуру в природі
мірабіліт
(глауберова сіль)
пірит
свинцевий блиск
цинкова обманка
(галеніт)
гіпс
(сфалерит)

Сполуки Сульфуру в природі
мірабіліт
(глауберова сіль)
пірит
свинцевий блиск
цинкова обманка
(галеніт)
гіпс
(сфалерит)
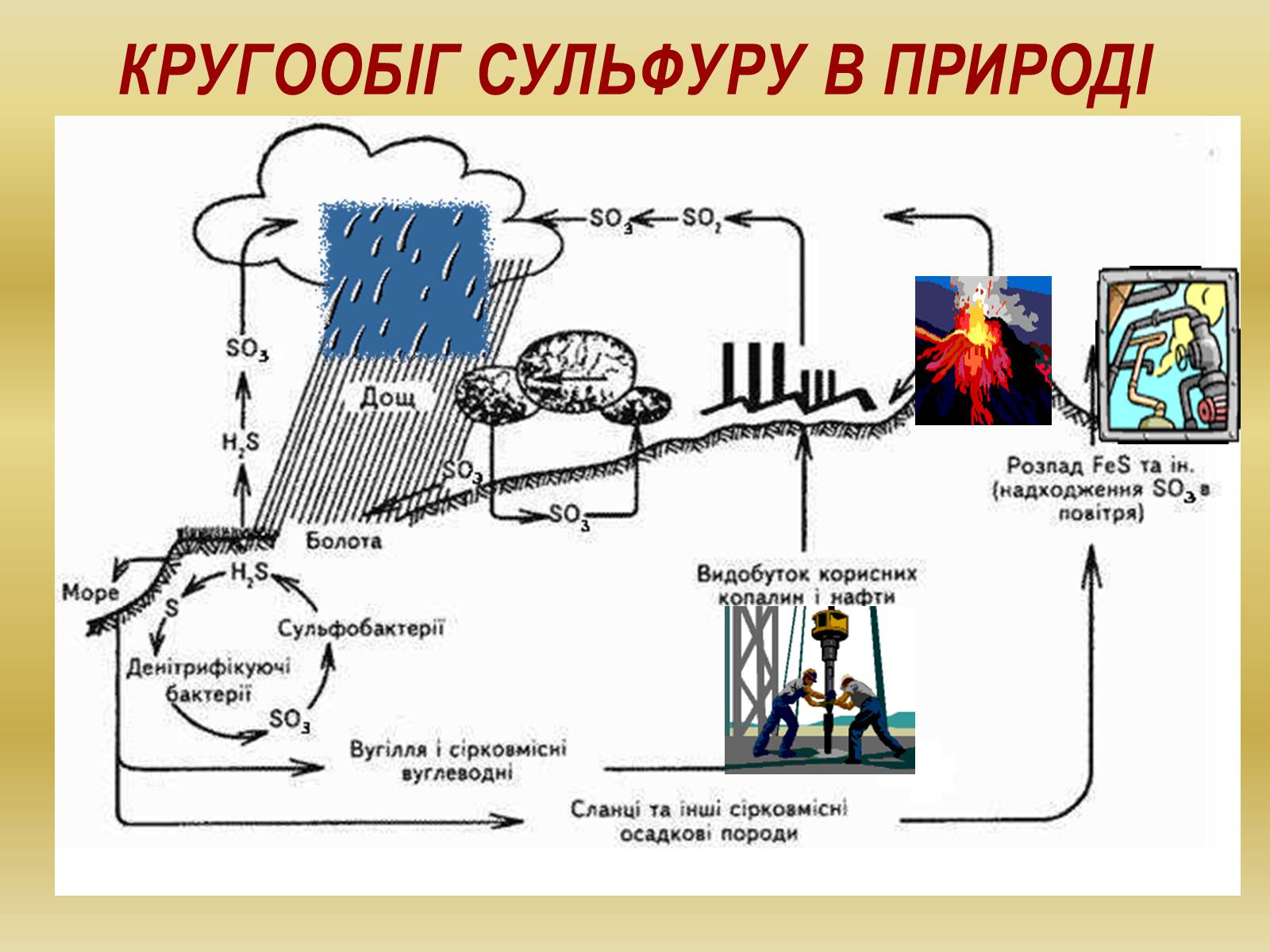
Кругообіг Сульфуру в природі