Презентація на тему «Сульфатна кислота і сульфати» (варіант 1)

Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.
Сульфатна кислота і сульфати. Найважливіші природні сульфати, якісна реакція на сульфат-іон. Застосування сульфатної кислоти і сульфатів

Мета:
Відновити знання про склад, фізичні властивості і відношення до води сульфатної кислоти.
Ознайомити з сульфатами та їхніми властивостями, практичним застосуванням.
Розкрити значення для хімічної промисловості і народного господарства.
Розвинути вміння встановлювати причинно-наслідковий зв'язок між властивостями сульфатної кислоти та її застосуванням.
Загострити увагу на правилах (Т/Б) при роботі з сульфатною кислотою та при приготуванні її водних розчинів.
Пояснити окиснювальну здатність концентрованої сульфатної кислоти.
Удосконалити вміння складати рівняння реакцій з металами, оксидами, основами і солями в молекулярній, повній і скороченій йонних формах.
Дати поняття про якісну реакцію на сульфат-іон.
Ознайомити із сировиною та хімічними реакціями, що покладені в основу виробництва сульфатної кислоти, з умовами їх здійснення.
Розкрити значення цих знань для управління процесом виробництва.
Формувати вміння складати рівняння реакцій, що лежать в основі виробництва сульфатної кислоти (випалювання піриту та сульфідів, окиснення сульфур(IV) оксиду, гідратація сульфур(VI) оксиду).
Розвивати поняття про каталіз, формувати поняття “вихід продукту реакцій”.
Висвітлити проблему охорони праці і довкілля від забруднення.

Демонстрації:
5. Спалювання сірки і доведення кислотного характеру утвореного оксиду.
6. Виділення теплоти під час розчинення у воді концентрованої сульфатної кислоти.
7. Водовідбірні властивості концентрованої сульфатної кислоти (дія на цукор і папір).
8. Якісна реакція на сульфат-іон.
Лабораторні досліди:
4. Ознайомлення зі зразками природних сполук Сульфуру.
5. Виявлення сульфат-іонів у розчині.

Сульфатна кислота.
Сульфатна, або сірчана, кислота їїформула — H2SO4.
Будова молекули. Графічна формула молекули:
Сульфатна кислота,як і всі інші кислоти, — молекулярна сполука
Кулестержневамодель молекули сульфатної кислоти

Укажіть значення валентності та ступеня окиснення Сульфуру в сульфатній кислоті.

Фізичні властивості.
За звичайних умов
чиста сульфатна кислота — безбарвна оліїста рідина
без запаху,
майже удвічі важча за воду (ρ = 1,83 г/см3).
Температура плавлення споолуки становить +10,3 °С, а кипіння +280 °С.
Під час кипіння кислота починає розкладатиися на сульфур(VI) оксид і воду.
Сульфатна кислота необмежено розчиняється у воді, тобто змішується з нею в будь яких співвідношеннях з утворенням розчину.

Переконатися в тому, що розчинення сульфатної кислоти — процес екзотермічний, допоможе такий демонстраційний дослід. Зберемо прилад
помістимо в стакан закріплену в лапці штатива пробірку, у яку налито легкокиплячу (t кип. 40 °С)органічну речовину — діетиловий етер.
У хімічний стакан наллємо 50 мл води кімнатної температури. Після цього повільно, по скляній паличці, час від часу помішуючи, увіллємо в стакан
50 мл концентрованої сульфатної кислоти. Спостерігатимемо, як рідина в пробірці закипає і випаровується. Причина цього явища —підвищення температури розчину. Якщо відкрити пробку й піднести до отвору пробірки запалену скіпку, пари етеру спалахнуть

Потрібно знати
Розчинення кислоти у воді супроводжується виділенням великої кількості теплоти.
Для того щоб із концентрованої сульфатної кислоти виготовити її розбавлений розчин, кислоту доливають у воду, а не навпаки.
Тоді температура рідини зростає повільніше, і вдається запобігти її закипанню й розбризкуванню.

Вона взаємодіє з:
1)металами, розміщеними в ряді активності до водню;
2) основними й амфотерними оксидами; 3) основами;
4) амфотерними гідроксидами;
5) солями

Хімічні властивості.
Сульфатна кислота завдяки наявності в молекулі двох ковалентт них полярних зв'язків О–Н є двохосновною.
Її дисоціація за першою стадією в розбавленому розчині відбувається майже повністю (це сильна кислота), а за другою — частково:
H2SO4→H + HSO4;
HSO4→H + SO4²ˉ.
Проте у йонноомолекулярних рівняннях сульфатну кислоту записують такою сукупністю йонів:
2H+ SO4²ˉ.

Реакції з металами.
взаємодіє майже з усіма металами. Можливість цих реакцій, а також склад їх продуктів залежать від концентрації кислоти і хімічної активності металу. Метал завжди є відновником. Тому сульфатна кислота, реагуючи з ним, буде окисником і відновлюватиметься.
+1 +6 –2
У молекулі H2SO4 можуть відновлюватися (зменшувати ступінь окиснення) два елементи — Гідроген і Сульфур.
Якщо з металом взаємодіє розбавлена сульфатна кислота, то відновлюється Гідроген.
Продукти реакції — сульфат металічного елемента і водень:
2Al + 3H2SO4 (розб.) = Al2(SO4)3+ 3H2↑.
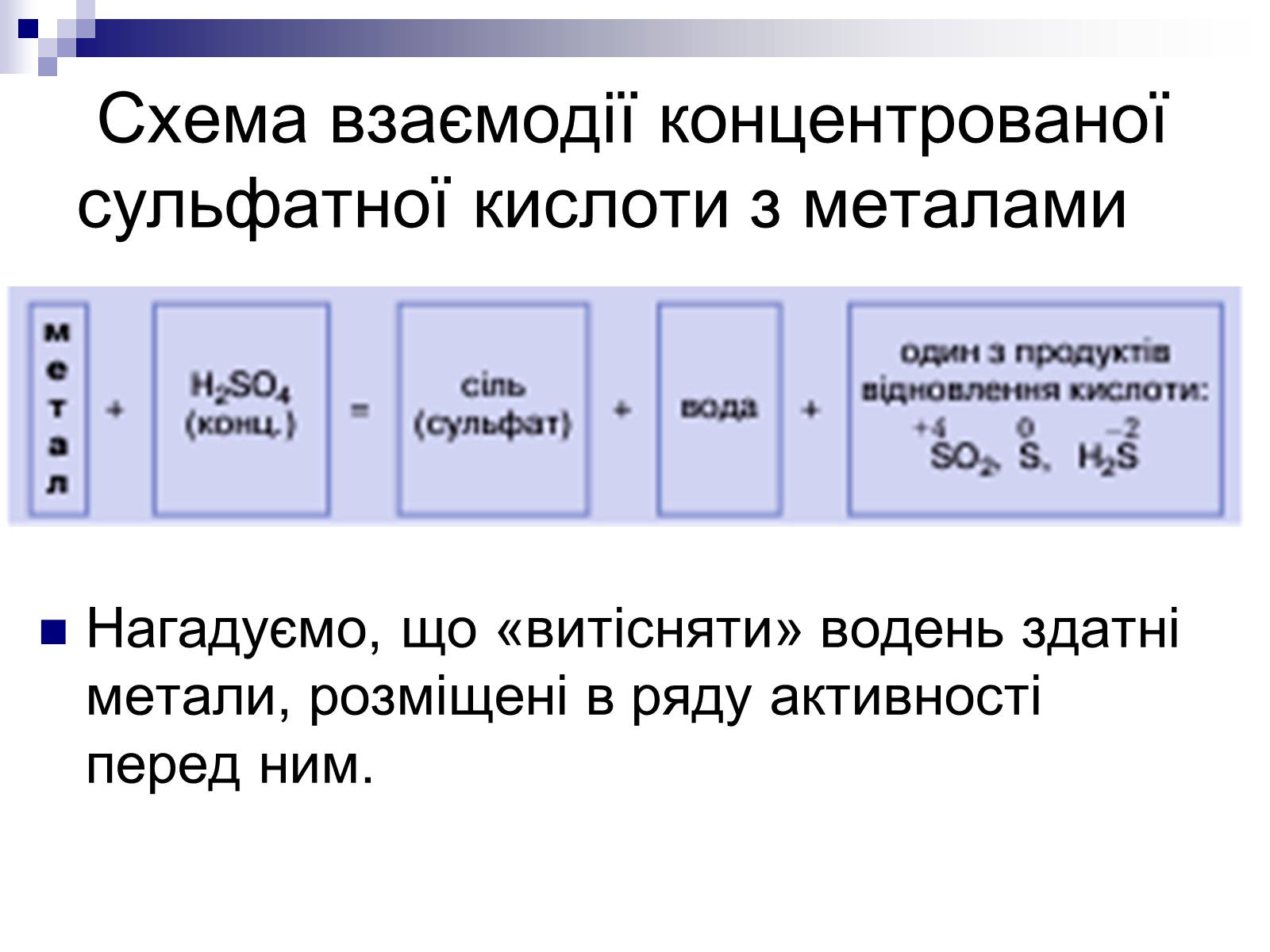
Схема взаємодії концентрованої сульфатної кислоти з металами
Нагадуємо, що «витісняти» водень здатні метали, розміщені в ряду активності перед ним.

Із розбавленою сульфатною кислотою не реагують мідь а), ртуть, золото, платина, інші хімічно пасивні метали.
Якщо реагентом є концентрована сульфатна кислота, то відновлюється Сульфур. Із концентрованою кислотою реагують також метали, розміщені в ряду активності після водню (крім золота,платини).

Малоактивні метали відновлюють
+4 –2
кислоту до SO2 ,а дуже активні —до H2S:
Cu + H2SO4(конц.)→CuSO4+ SO2↑+ H2O;
Mg + H2SO4(конц.)→MgSO4+ H2S↑+ H2O.
Складіть схеми окиснення, відновлення й
доберіть коефіцієнти методом електронного балансу.

Якщо в холодну концентровану сульфатну кислоту занурити кусочок заліза, то ми не помітимо взаємодії речовин.
Насправді кислота починає реагувати з металом:
2Fe + 3H2SO4 (конц.) = Fe2O3+ 3SO2↑+ 3H2O.
Однак реакція відразу припиняється, бо на поверхні металу утворюється тонка плівка ферум(ІІІ) оксиду, інертна щодо кислоти (оксид реагує з кислотою тільки при нагріванні).
Таке явище називають пасивацією. Аналогічно поводиться щодо цієї кислоти алюміній.

Реакції зі складними речовинами.
Сульфатна кислота взаємодіє з
основними оксидами амфотерними оксидами,
основами,
амфотерними гідроксидами
з утворенням у кожному випадку солі (сульфату) і води.
H2SO4 + Ві(OH)3→
H2SO4 + MnO →

Будучи нелеткою і сильною кислотою, вона вступає в реакції обміну з більшістю солей.
Напишіть рівняння реакцій сульфатної кислоти зі сполуками, що мають такі формули:
Li2O,
Fe(OH)3,
Na3PO4.
H2SO4 + Pb(NO3)2→
H2SO4 + NaF →

Розклад цукру і целюлози під дією сульфатної кислоти
Розклад цукру і целюлози під дією сульфатної кислоти
Цю речовину називають «хлібом»хімічної промисловості.

Сульфати.
Сульфатна кислота утворює солі, загальна назва яких — сульфати
Більшість сульфатів розчиняється у воді.
При випарюванні їх розчинів часто виділяються кристалогідрати, наприклад CuSO4•5H2O, FeSO4•7H2O, Al2(SO4)3•18H2O.
Малорозчинними є солі CaSO4 і Ag2SO4, а практично нерозчинними — BaSO4 і PbSO4.
Утворення осаду барій сульфату використовують як якісну реакцію на йони SO4²ˉ

Сульфати.
Сульфатна кислота утворює солі, загальна назва яких — сульфати
Більшість сульфатів розчиняється у воді.
При випарюванні їх розчинів часто виділяються кристалогідрати, наприклад CuSO4•5H2O, FeSO4•7H2O, Al2(SO4)3•18H2O.
Малорозчинними є солі CaSO4 і Ag2SO4, а практично нерозчинними — BaSO4 і PbSO4.
Утворення осаду барій сульфату використовують як якісну реакцію на йони SO4²ˉ

Найважливіші природні сульфати
гіпсСаSO4·2Н2О; глауберова сільNa2SO4·10H2О; гірка сільMgSO4·7H2О.
Із наведених формул стає зрозуміло, що це кристалогідрати, тобто вони містять кристалізаційну воду, яка при нагріванні випаровується.
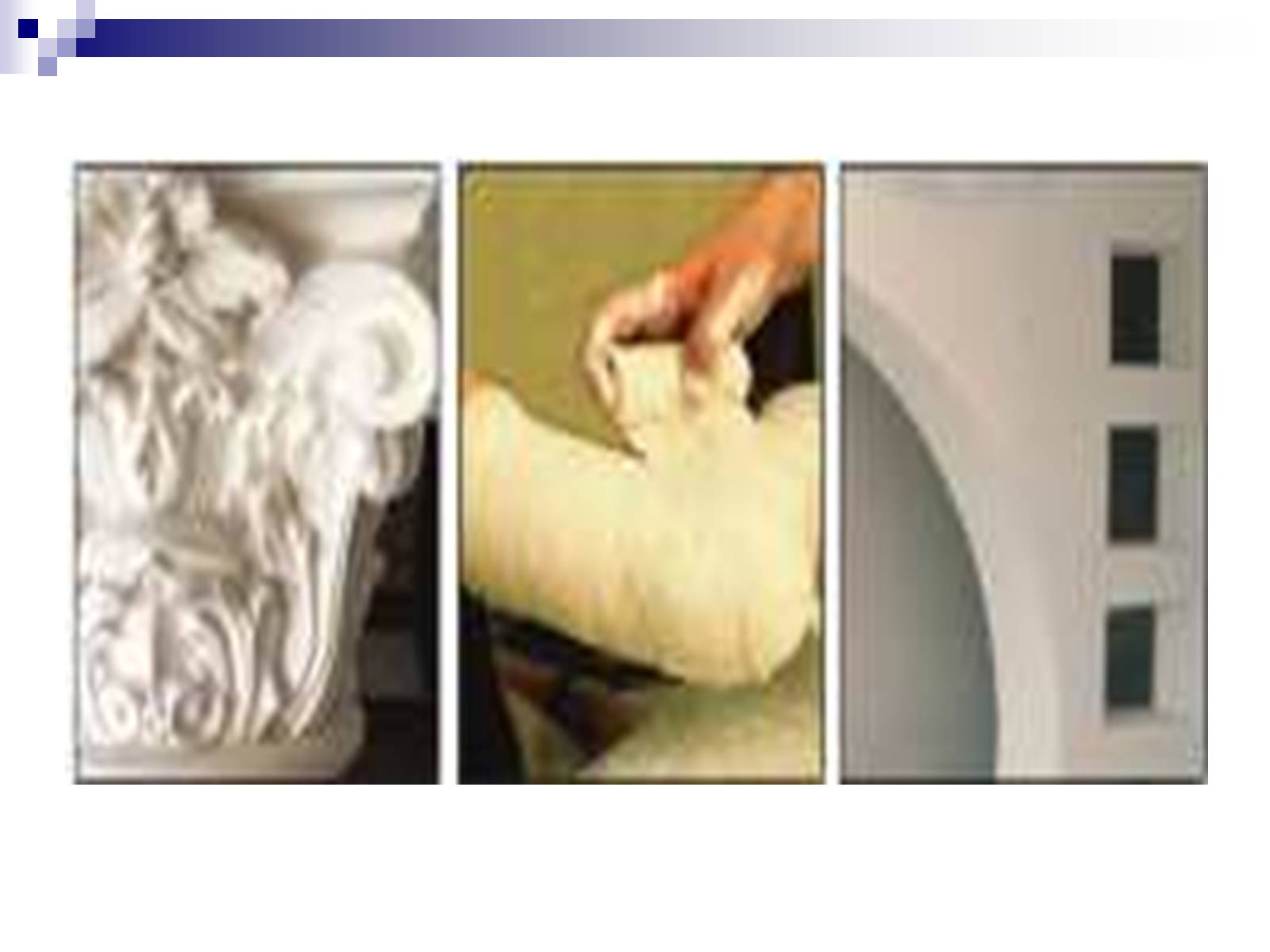
На цій властивості кристалогідратів ґрунтується виробництво алебастру 2СаSO4·Н2О з природного гіпсу, який нагрівають до 120–190 °С, у наслідок чого він втрачає частину води.
При змочуванні водою кімнатної температури алебастр легко приєднує воду й знову перетворюється на гіпс.
Це відбувається щоразу при накладанні гіпсових пов'язок на травмовані частини тіла, під час виготовлення гіпсових виробів художнього та будівельного призначення.
Найважливіші природні сульфати
гіпсСаSO4·2Н2О; глауберова сільNa2SO4·10H2О; гірка сільMgSO4·7H2О.
Із наведених формул стає зрозуміло, що це кристалогідрати, тобто вони містять кристалізаційну воду, яка при нагріванні випаровується.
На цій властивості кристалогідратів ґрунтується виробництво алебастру 2СаSO4·Н2О з природного гіпсу, який нагрівають до 120–190 °С, у наслідок чого він втрачає частину води.
При змочуванні водою кімнатної температури алебастр легко приєднує воду й знову перетворюється на гіпс.
Це відбувається щоразу при накладанні гіпсових пов'язок на травмовані частини тіла, під час виготовлення гіпсових виробів художнього та будівельного призначення.

Глауберову сіль Na2SO4·10H2О застосовують у виробництві скла, соди, фарб, у медицині.
Гірку сіль MgSO4·7H2О використовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
Купрум(ІІ) сульфат, пентагідрат, або мідний купорос CuSO4•5H2O,застосовують у сільському господарстві як засіб проти хвороб і шкідників рослин.

Глауберову сіль Na2SO4·10H2О застосовують у виробництві скла, соди, фарб, у медицині.
Гірку сіль MgSO4·7H2О використовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
Купрум(ІІ) сульфат, пентагідрат, або мідний купорос CuSO4•5H2O,застосовують у сільському господарстві як засіб проти хвороб і шкідників рослин.

Глауберову сіль Na2SO4·10H2О застосовують у виробництві скла, соди, фарб, у медицині.
Гірку сіль MgSO4·7H2О використовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
Купрум(ІІ) сульфат, пентагідрат, або мідний купорос CuSO4•5H2O,застосовують у сільському господарстві як засіб проти хвороб і шкідників рослин.

Якісною реакцією на сульфат аніони є взаємодія їх з катіонами Барію (розчинними у воді сполуками Барію), у результаті чого утворюється нерозчинний у воді і кислотах білий дрібнокристалічний осад барій сульфату.
Скорочене йонне рівняння якісної реакції таке:
Ba² + SO4 = BaSO4 ²ˉ↓

Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.
Серед сульфуровмісних забрудників навколишнього середовища найбільш шкідливими є сульфур(ІV) оксид і гідроген сульфід, або сірководень.
Щодо гідроген сульфіду, то потрібно наголосити на високій токсичності цієї газуватої речовини з неприємним запахом тухлих яєць (утворюється при гнитті білка курячого яйця й спричинює його неприємний запах).

Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.
Серед сульфуровмісних забрудників навколишнього середовища найбільш шкідливими є сульфур(ІV) оксид і гідроген сульфід, або сірководень.
Щодо гідроген сульфіду, то потрібно наголосити на високій токсичності цієї газуватої речовини з неприємним запахом тухлих яєць (утворюється при гнитті білка курячого яйця й спричинює його неприємний запах).

Поняття про кислотні дощі та причини їх виникнення.
Чи доводилося вам спостерігати, як після довгоочікуваного літнього дощу рослини замість того, щоб рости й давати врожай, жовкнуть,в'януть і навіть гинуть (досить часто це трапляється з огірками)?
З великою ймовірністю можна стверджувати, що дощ був не звичайний, а кислотний, і завдав шкоди рослинам. Кислотні дощі пошкоджують листки, руйнують їх захисні воскові покриви, через що ті стають легкопроникними для комах, шкідливих грибів і мікроорганізмів. Окрім рослин, кислотні дощі завдають шкоди тваринам,водоймам, ґрунтам.
Хімічний аналіз кислотних дощів показує наявність у них сульфатної та нітратної кислот. Поява цих речовин — наслідок розглянутих хімічних перетворень оксидів Сульфуру і Нітрогену в атмосфері.
Кислотний дощ— це дощ, що містить певну кількість кислот, утворених унаслідок взаємодії з водою наявних у повітрі таких забруднювачів, як оксиди Сульфуру і Нітрогену.
Щороку внаслідок спалювання твердого палива, роботи двигунів внутрішнього згорання, промислових викидів заводів по виробництву сульфатної і нітратної кислот концентрація цих оксидів у повітрі збільшується. Тому кислотні дощі створюють реальну загрозу людині, рослинному й тваринному світу.

Фізіологічна дія гідроген сульфіду проявляється в тому, що він блокує дихальний центр.
Смертельною дозою для людини є вдихання протягом 5–10 хв повітря з об'ємною часткою гідроген сульфіду 0,08%.
Забруднюють повітря сульфуровмісними речовинами викиди нафтопереробних заводів, теплові електростанції.

Охорона навколишнього середовища полягає насамперед у зменшенні викидів, а отже, у модернізації виробництва, запровадженні технології замкненого циклу, коли гази, що є відходами названих виробництв, використовують як сировину для інших виробництв.
Користь від цього подвійна — не забруднюється навколишнє середовище, а вироблена з гідроген сульфідних відходів нафтопереробної промисловості сульфатна кислота має найменшу вартість.
Удосконаленням технології виробництва сульфатної кислоти
займався український хімік Іван Євграфович Ададуров (1879–1938).

З якими з перелічених речовин взаємодіє розбавлена сульфатна кислота: залізо, купрум(ІІ) оксид, мідь, натрій гідроксид, нітратна кислота, калій карбонат, нітроген(ІІ) оксид? Напишіть молекулярні рівняння реакцій, зазначте їх типи.
Запропонуйте спосіб розпізнавання концентрованої та розбавленої сульфатної кислоти, що перебувають у банках без етикеток.Мотивуйте його.
Обчисліть масову частку кристалізаційної води в гіркій солі.

Ознайомтеся з виданими вам зразками
сульфатів і сульфідів.
Дослідіть агрегатний стан й такі їх фізичні властивості: колір, розчинність у воді.
Використовуючи міжпредметні зв'язки з географією, назвіть поклади природних сульфатів і сульфідів в Україні.
Одержані результати оформіть у робочому зошиті у вигляді таблиці.

ВИСНОВКИ
Сульфатна кислота H2SO4 — безбарвна оліїста рідина без запаху, яка необмежено розчиняється у воді. Це сильна й нелетка двохосновна кислота.
Вона реагує з металами, основними й амфотерними оксидами, основами, амфотерними гідроксидами, а також солями з утворенням сульфатів.
Сульфатну кислоту та її солі широко використовують у різних галузях.