Презентація на тему «Основи» (варіант 4)

План:
Основні відомості
Формули основ
Назви основ
Класифікація
Фізичні властивості
Хімічні властивості
Способи добування
Використання основ
Основи

Основні відомості
Основа-сполука,що складається із катіонів металічного елемента Me і гідроксид-аніонів ОН
Гідроксильна група, або гідроксогрупа, утворюється з молекул води Н20:
Н—ОН

Загальна формула основ
Ме(ОН)n,
де Ме — метал, а n — валентність цього металу, належать до класу основ.

Назви основ
назва металу
+
Валентність римскими цифрами
+
слово “гідроксид”

Наприклад
NaOH — натрій гідроксид, Al(OH)3 — алюміній гідроксид.
Для металів, що мають змінну валентність, у дужках після назви металу римською цифрою зазначають його валентність в даному гідроксиді.
Наприклад, Fe(OH)3 — ферум(ІІІ) гідроксид, Fe(OH)2 — ферум(ІІ) гідроксид
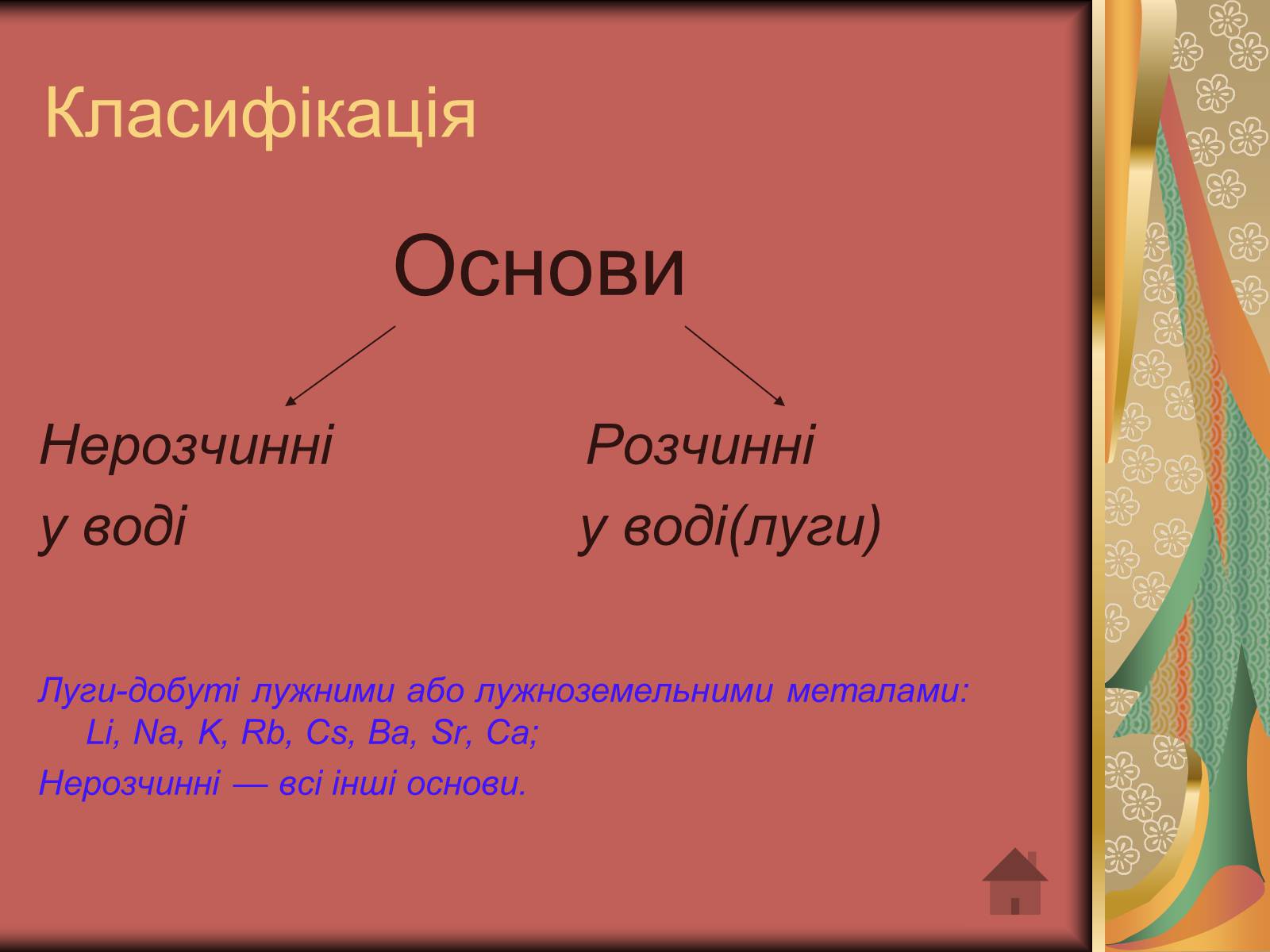
Класифікація
Основи
Нерозчинні Розчинні
у воді у воді(луги)
Луги-добуті лужними або лужноземельними металами:Li, Nа, K, Rb, Сs, Ba, Sr, Ca;
Нерозчинні — всі інші основи.

Фізичні властивості
За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз'їдають шкіру, тканини, папір. Нерозчинні основи — тверді речовини різного кольору.
Працюючм з лугами та їхніми розчинами,будьте особливо обережними!

Хімічні властивості
Луги мають такі хімічні властивості:
1) змінюють забарвлення індикаторів: фенолфталеїну без кольору на малинове, метилового оранжевого на жовте, фіолетового лакмусу на синє, універсального індикаторного паперу на синє;
2)взаємодіють із кислотними оксидами:
Луг+кислотний оксид=сіль+вода
3) взаємодіють із кислотами:
Луг+кислота=сіль+вода
4) реагують із солями:
Луг+сіль=основа+сіль

Нерозчинні основи мають такі хімічні властивості:
1) не змінюють забарвлення індикаторів;
2) практично не взаємодіють із кислотними оксидами;
3) взаємодіють із кислотами:
Основа+кислота=сіль+вода
4) розкладаються при нагріванні:
Основа=оксид+вода

Способи добування
Розчинні у воді основи, тобто луги, добувають під час взаємодії металів або їх оксидів з водою:
2Na + 2H2O =2NaOH + H2
Сполучення основного оксиду з водою:
Na2O + H2O = 2NaOH
Малорозчинні у воді основи добувають непрямим шляхом, а саме: дією лугів на воді розчини відповідних солей
FeSo4 + 2NaOH Fe(OH)2 + NaSO4
AlCl3 + 3NaOH Al(OH)3 3NaCl

Широкого застосування серед основ
набули лише луги,передусім
гідроксиди Кальцію
і Натрію.Гашене вапно викорис
товують як в'яжучий матеріал у
будівництві. Кальцій гідроксид
також застосовують у цукровій
промисловості,сільському
господарстві,при виготовленні
зубних паст.Натрій гідроксид
використовують для виробництва
мила,ліків,для очистки нафти.
Використання