Презентація на тему «Оцтова кислота» (варіант 4)

Оцтова кислота

Будова оцтової кислоти
Оцтова, або етанова, кислота належить до оксигеновмісних органічних сполук і є представником гомологічного ряду насичених одноосновних карбонових кислот. Загальна формуло цих речовин: R- COOH.
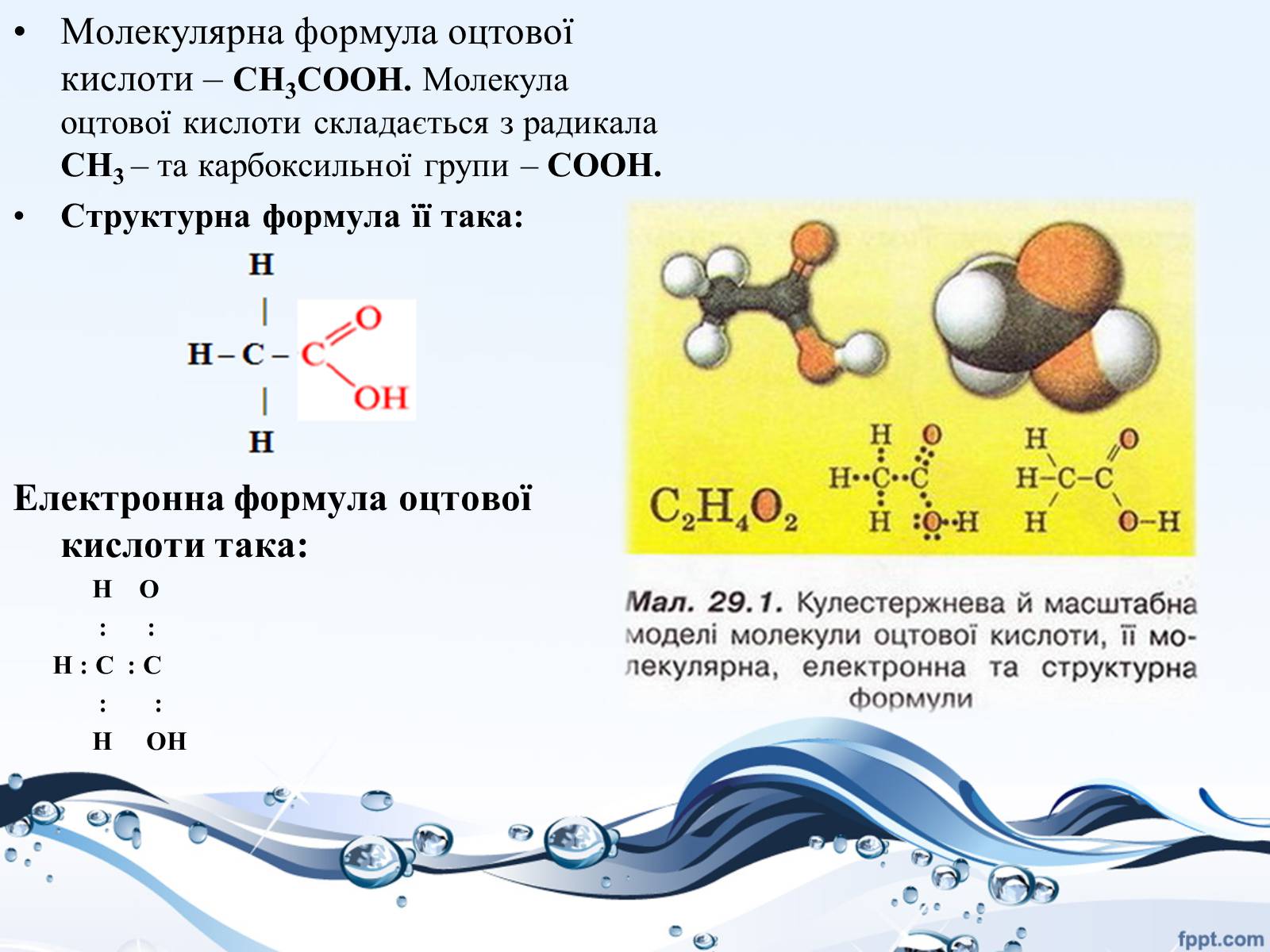
Молекулярна формула оцтової кислоти – CH3COOH. Молекула оцтової кислоти складається з радикала CH3 – та карбоксильної групи – COOH.
Структурна формула її така:
Електронна формула оцтової кислоти така:
Н О
: :
Н : С : С
: :
Н ОН

Молекули оцтової кислоти існує у вигляді спарених молекул – димерів, сполучені попарно водневими зв'язками:
О…НО
|
– С – С – CH3
|
ОН…О
Це зумовлює порівняно велику міцність димерних сполук, а тому і високу температуру кипіння. Добра розчинність оцтової кислоти у воді пояснюється утворенням водневих зв'язків молекул кислоти з молекулами води.

Фізичні властивості оцтової кислоти.
Оцтова кислота – безбарвна рідина, з різким запахом, добре розчинна у воді. Розчиняється в етанолі, етері, гліцерині, жирних та етерних оліях. Має характерний кислий смак, проводить електричний струм. Розчиняє деякі неорганічні й органічні речовини.

70-80% водний розчин оцтової кислоти називають оцтовою есенцією, а 3-6% – оцтом. Оцтова кислота є нетоксичною та не подразнювальною речовиною, але її розчини в концентрації понад 50% є корозійно активними, здатні викликати опіки шкіри, очей, слизових оболонках носа та ротової порожнини .У парах оцтова кислота має подразливу дію на дихальні шляхи, ГДК для неї становить 5 мг/м

Синтетична харчова оцтова кислот – легкозаймиста рідина, за ступенем впливу на організм відноситься до речовин 3-го класу небезпеки. При роботі з оцтової кислотою слід застосувати індивідуальні засоби захисту (фільтруючі протигази). Перша допомога при опіках – рясне промивання водою.

Хімічні властивості оцтової кислоти
Оцтова кислота, подібно до розчинних неорганічних кислот, дисоціює з утворенням кислого середовища, змінює забарвлення індикатора:
CH3 → СООН ⇄ CH3 → СОО + Н
Оцтова кислота є слабким електролітом.
Оцтова кислота виявляє загальні властивості кислот щодо взаємодії з:
а) металами
2 CH3→СООН + Mg →(CH3→COO)2 Mg + H2
Утворена сіль – магній етаноат (історична назва – ацетат магнію);

б) основними оксидами
2CH3 → СООН + СаО →(CH3→ COO)2 Са+ H2О;
в) лугами (вступає в реакцію нейтралізації, утворюючи сіль і воду)
CH3 → СООН + NaOH → СH3 →COONa + H2O
Утворена сіль – натрій етаноат;
г) солями ( слабкіших за неї кислот, наприклад, карбонами,силікатами)
2CH3→СООН + Na2СО3→ 2CH3→COONa + H2О + CO2

Оцтова кислота вступає в реакцію етерифікації із спиртами – при слабкому нагріванні та наявності концентрованої сульфатної кислоти як каталізатора і водопоглинаючої речовини (роль водопоглинаючої речовини в цьому разі полягає в полегшенні протіканні реакції та зміщенні рівноваги і бік утворення продуктів реакції):
CH3 → СООН + HО→ C2H5→CH3 → CОO + C2H5 + H2O
Продуктом реакції – є етиловий естер оцтової кислоти (етилетаноат).

Етанова кислота в реакціях виявляє також певні хімічні властивості завдяки вуглеводневому радикалу (атоми Гідрогену можуть легко зміщатися галогенами). Наприклад, взаємодія з хлором:
CH3→ СООН + Cl2→CH2Cl→CООН + HCl
Утворюється хлороцтова кислота.
Оцтова кислота є типовою карбоновою кислотою і на відміну від мурашиної кислоти є дуже стійкою до дії навіть сильних окисників, наприклад КМnO4.
Як і більшість органічних сполук, оцтова кислота дуже добре горить:
CH3→СООН + 2О2→2CО2 + Н 2О.

Добування оцтової кислоти
У давнину оцет виробляли з вина. При контакті з натурального виноградного вина, в якому масова частка етанолу не перевищує 10%, з повітрям за участю особливих бактерій протягом двох – трьох тижнів відбувається окиснення спирту до оцтової кислоти. Цей процес називають оцтовокислим бродінням. Назва розчину оцтової кислоти, добутого таким способом, – винний оцет.

У сьогоднішній час в промисловості оцтову кислоту отримують наступними методами:
суха перегонка деревини;
оцтове бродіння розчинів етанолу:
СН3 – СН2 – О + 2[О] — СН3СООН + Н2О
окислення оцтового альдегіду киснем повітря у присутності каталізатора: СН3СОН + [О] — СН3СООН
окиснення бутану:
2СН3-СН2-СН2-СН3 +5О2 — 4СН3СООН +2Н2О

Застосування оцтової кислоти
Оцтова кислота — один з базових продуктів промислового органічного синтезу. Більш ніж 65 % світового виробництва оцтової кислоти іде на виготовлення полімерів, похідних целюлози та вінілацетату. Полівінілацетат є основою багатьох ґрунтівних покритів та фарб. З ацетатної целюлози виготовляють ацетатне волокно.
Етанову кислоту використовують при друкуванні книг та фарбуванні

Оцтову кислоту використовують у харчовій промисловості як консервант при консервуванні харчових продуктів, наприклад, у складі маринадів. У вигляді 5 – 15%-ного розчину оцтова кислота добре відома як оцет. Оцтова кислот є як харчова добавка Е260 - нешкідливий компонент натурального походження, яку спеціально додають до продуктів їжі в технологічних цілях.

Широке застосування етанова кислота має у виробництві лікарських препаратів (наприклад, аспірину).
Солі оцтової кислоти використовують для боротьби з шкідниками рослин.
Ферум (III) ацетат відомий як протрава при фарбуванні.
Розчин плюмбум (II) ацетату використовують у медицині як свинцеву примочку.

Оцет широко використовують у народній медицині як неспецифічний жарознижуючий засіб. Поширене застосування оцту при укусах комах у вигляді компресів.
Відоме застосування спиртового оцту в косметології.
Оцтову кислоту використовують при видаленні накипу.
Яблучний оцет застосовується при приготуванні різноманітних страв і консервуванні.

Виконала:
учениця 9 класу
ЗСШ № 78 м. ЛьвоваХомишин Ольга
Керівник:
Бавдис Галина Михайлівна