Презентація на тему «Нітратна кислота» (варіант 2)

Підготував
Учень 10-а класу
СШ№28
Прядко Андрій
Презентація на тему :Нітратна кислота

Зміст:
Історія
Промислове виробництво
Хімічні властивості
Фізичні властивості
Отримання
Застосування

Історія відкриття
Дж. Глаубер отримав в середині 17-го сторіччя, чисту нітратну кислоту реакцією і перегонкою селітри з сірчаною кислотою, зараз цей процес застосовується при лабораторному отриманні кислоти.

Склад кислоти вперше визначив А.Лавуазьє в 18 сторіччі, він визначив що речовина має в своєму складі азот та кисень та точна формула не була відома. Точний склад був визначений Генрі Кавендішем. Промислове виробництво почалося лише на початку 19 століття, коли сірчана кислота та нітрат натрію були доступні в великих кількостях.

Промислове виробництво
Азотну кислоту отримують шляхом реакції діоксиду азоту (NO2) з водою.
3NO2 + H2O → 2HNO3 + NO

Хімічні властивості
Нітратна кислота — дуже сильний окисник. Окислює сірку (до H2SO4), фосфор (H3PO4), руйнує органічні речовини. Ступінь відновлення HNO3 залежить від її концентрації і активності відновника. Концентрована HNO3 відновлюється до NO2, а розведена — звичайно до NO. Нітратна кислота взаємодіє майже зі всіма металами, за винятком золота, платини і деяких інших, утворюючи солі — нітрати. Так, при дії концентрованої нітратної кислоти на мідь утворюється нітрат міді, діоксид азоту і вода:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O

Фізичні властивості
Нітратна кислота є безбарвною димучою рідиною з їдким запахом, легко розкладається, забарвлюючись у жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при — 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
Нітратна кислота нестійка і вже під впливом сонячного світла поступово розкладається:
4HNO3 = 4NO2 + O2 + 2H2O

Отримання
У сучасній хімічній промисловості нітратну кислоту добувають шляхом каталітичного окиснення аміаку до монооксиду азоту з наступним окисненням NO киснем при 700—900 °C до діоксиду (гемітетраоксиду) азоту і поглинанням останнього водою. Каталізатор — платинова сітка.
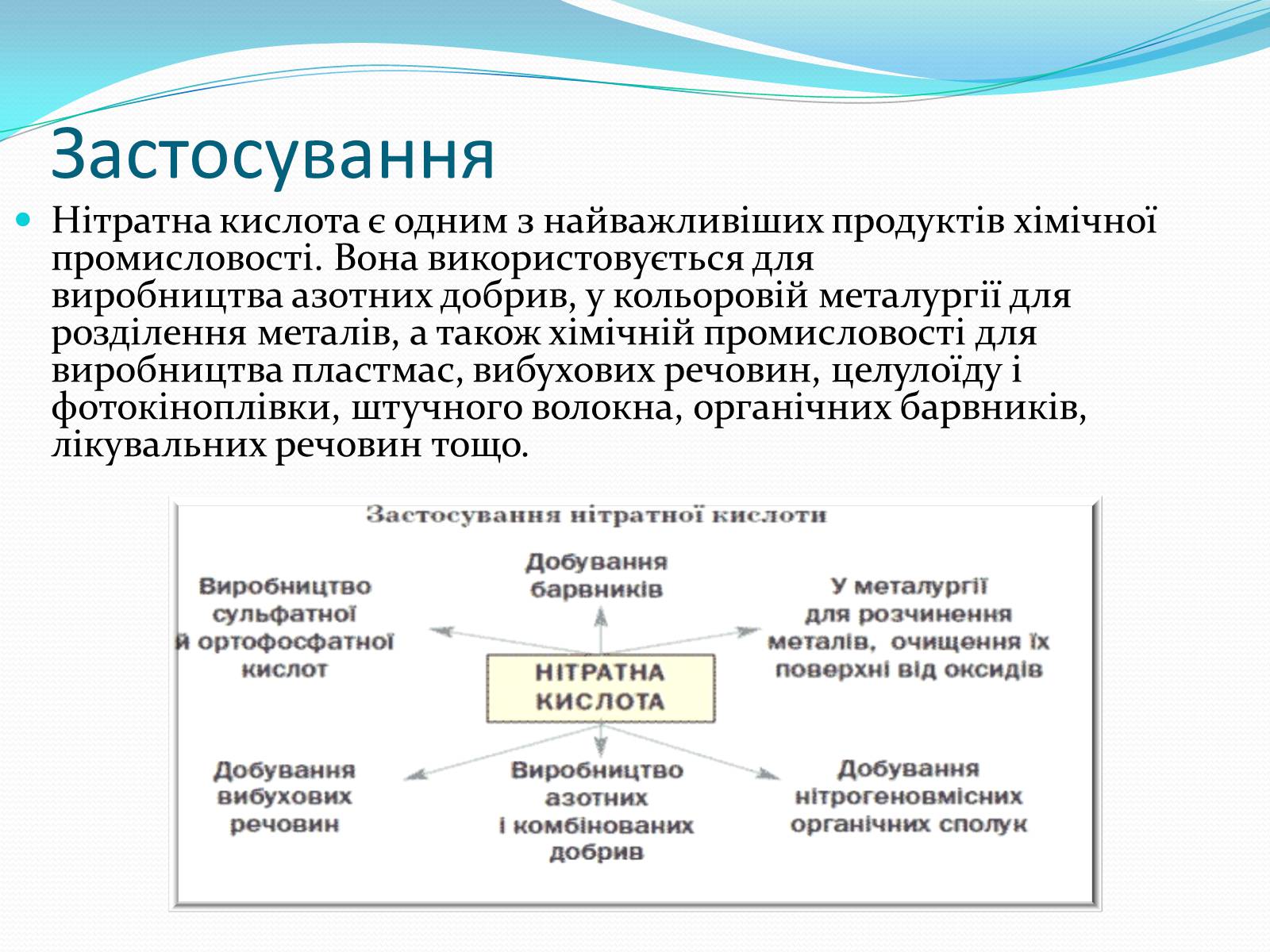
Застосування
Нітратна кислота є одним з найважливіших продуктів хімічної промисловості. Вона використовується для виробництва азотних добрив, у кольоровій металургії для розділення металів, а також хімічній промисловості для виробництва пластмас, вибухових речовин, целулоїду і фотокіноплівки, штучного волокна, органічних барвників, лікувальних речовин тощо.

Використані матеріали
http://uk.wikipedia.org
http://school.xvatit.com