Презентація на тему «Насичені вуглеводні»

Підготувала: Мучичка І., 11-Б
Насичені вуглеводні(алкани)

Що таке алкани?
Алкани (також насичені вуглеводні, парафіни, аліфатичні сполуки) - ациклічні вуглеводні лінійного або розгалуженого будови, що містять тільки прості зв'язки і утворюють гомологічний ряд із загальною формулою C n H 2n +2.

Алкани є насиченими вуглеводнями і містять максимально можливе число атомів водню. Кожен атом вуглецю в молекулах алканів знаходиться в стані sp 3-гібридизації - всі 4 гібридні орбіталі атома С рівні за формою і енергії, 4 електронних хмари направлені до вершини тетраедра під кутами 109 28 '. За рахунок одинарних зв'язків між атомами С можливо вільне обертання навколо вуглецевого зв'язку. Тип вуглецевого зв'язку - σ-зв'язку, зв'язку малополярни і погано поляризованим. Довжина вуглецевого зв'язку - 0,154 нм.
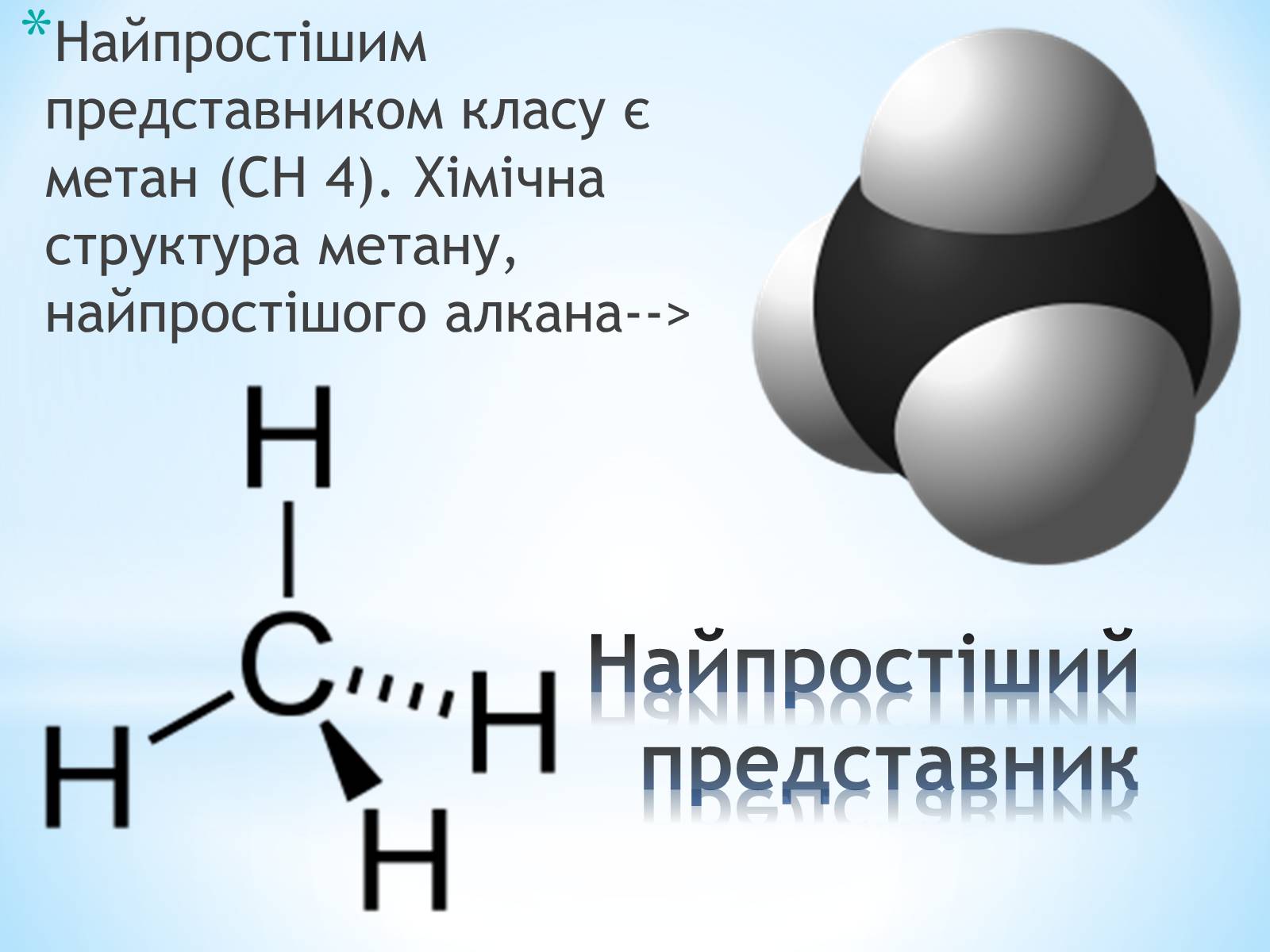
Найпростіший представник
Найпростішим представником класу є метан (CH 4). Хімічна структура метану, найпростішого алкана-->
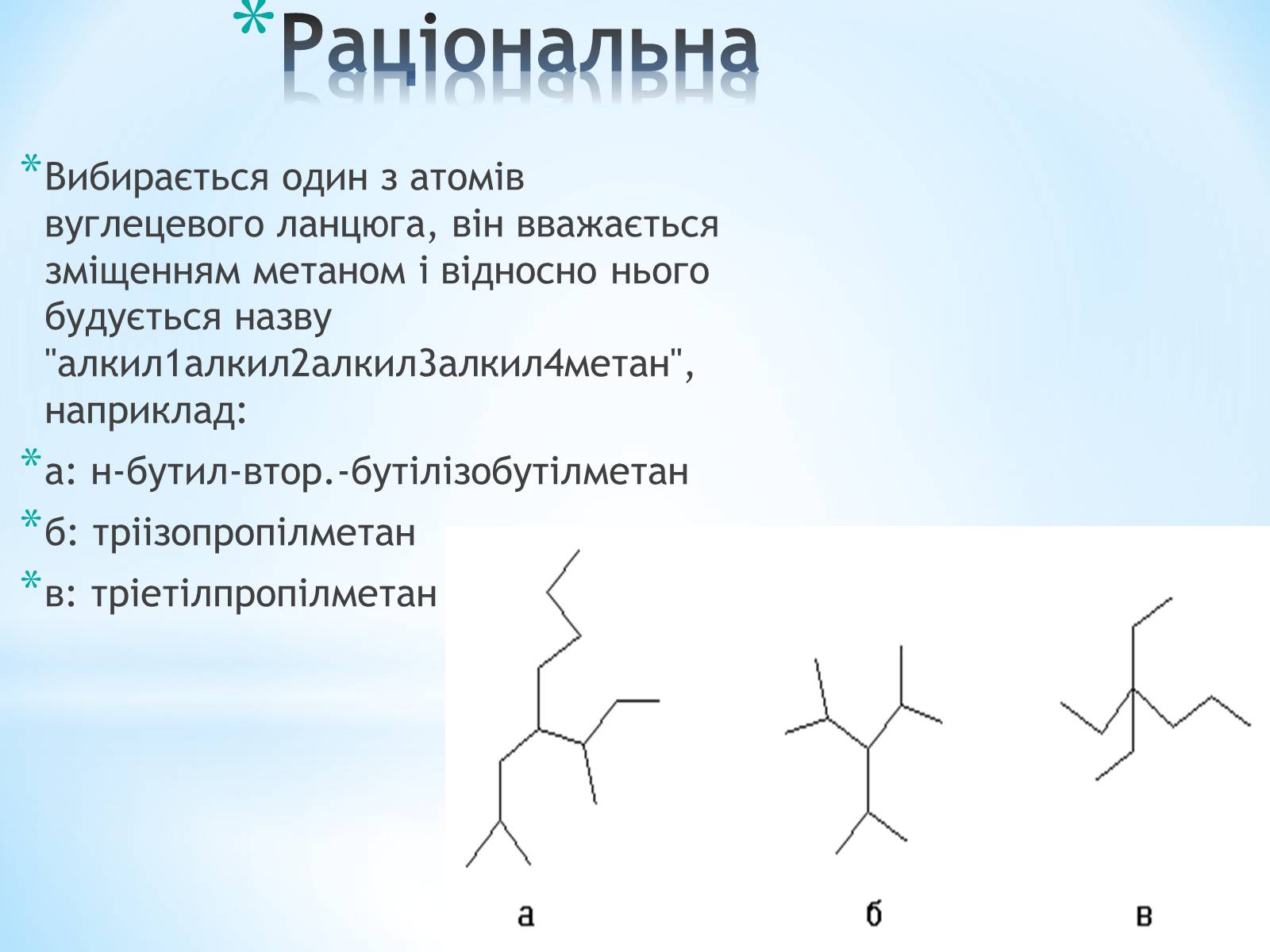
Раціональна
Вибирається один з атомів вуглецевого ланцюга, він вважається зміщенням метаном і відносно нього будується назву "алкил1алкил2алкил3алкил4метан", наприклад:
а: н-бутил-втор.-бутілізобутілметан
б: тріізопропілметан
в: тріетілпропілметан

Систиматизація за ІЮПАК
За номенклатурою ІЮПАК назви алканов утворюються за допомогою суфікса-ан шляхом додавання до відповідного кореня від назви вуглеводню. Вибирається найбільш довга нерозгалужене вуглеводнева ланцюг так, щоб у найбільшого числа заступників був мінімальний номер в ланцюзі. У назві з'єднання цифрою вказують номер вуглецевого атома, при якому знаходиться замещающая група або гетероатом, потім назва групи або гетероатома і назва головного ланцюга.
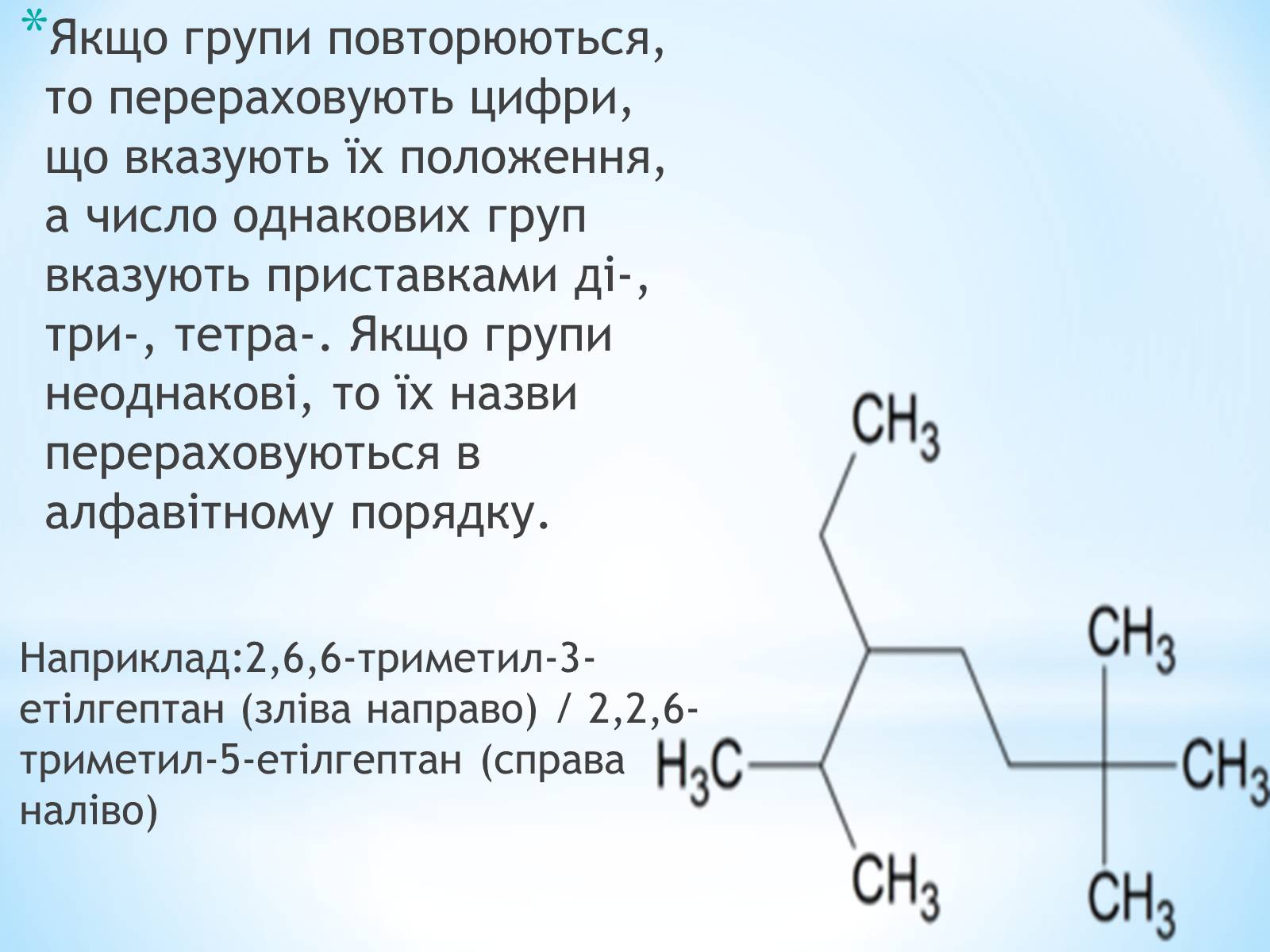
Якщо групи повторюються, то перераховують цифри, що вказують їх положення, а число однакових груп вказують приставками ді-, три-, тетра-. Якщо групи неоднакові, то їх назви перераховуються в алфавітному порядку.
Наприклад:2,6,6-триметил-3-етілгептан (зліва направо) / 2,2,6-триметил-5-етілгептан (справа наліво)

Явище ізомерії
Ізомері́я — існування сполук, однакових за хімічним складом, але різних за будовою і властивостями. Такі сполуки називають ізомерами. Є структурна (конституційна), просторова (конформаційна) та оптична (конфігураційна) ізомерія. Ізомерія — одна з причин різноманітності та численності органічних сполук. Залежно від характеру відмінностей у будові ізомерів розрізняють структурну ізомерію та стереоізомерію.
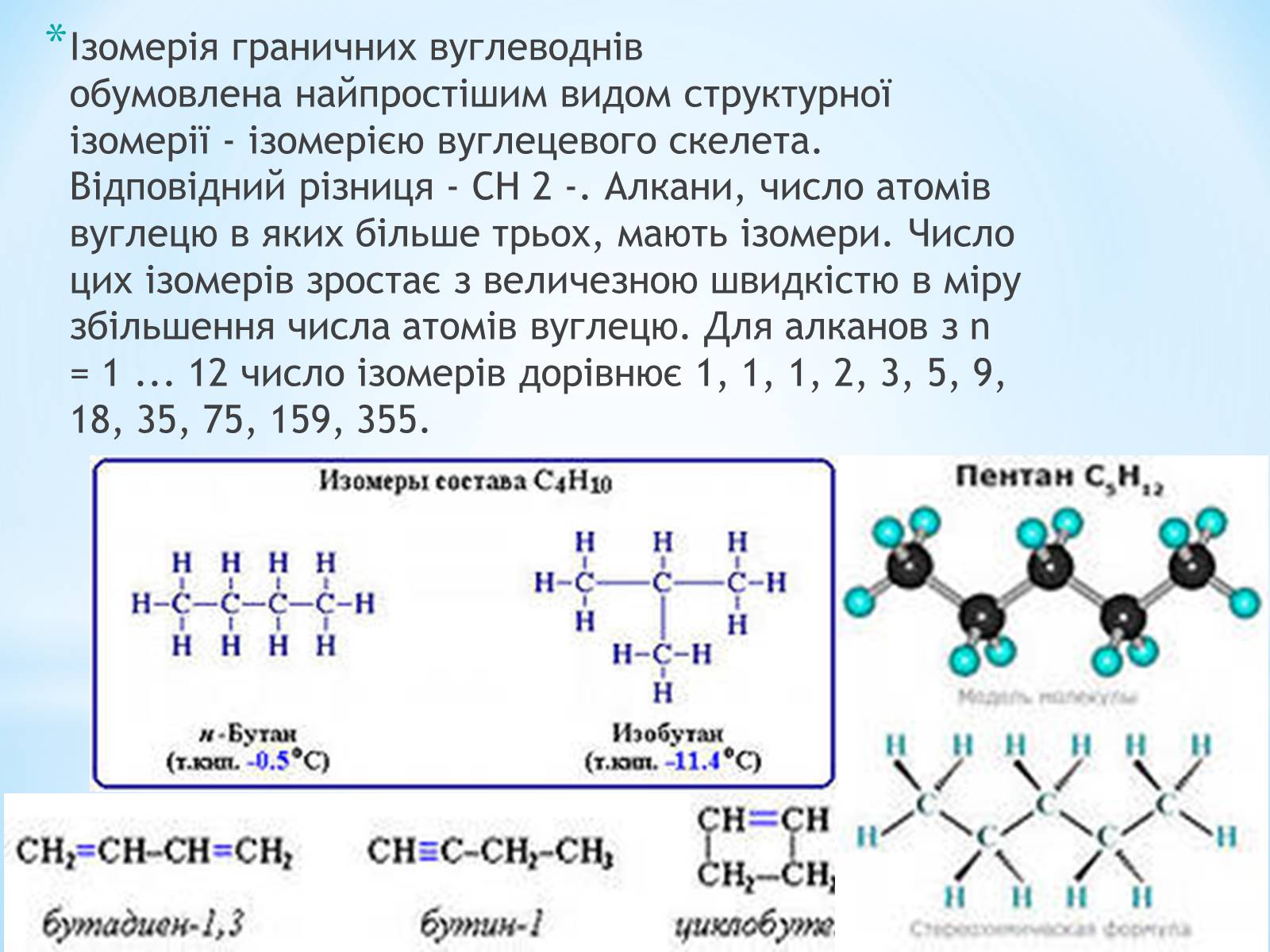
Ізомерія граничних вуглеводнів обумовлена найпростішим видом структурної ізомерії - ізомерією вуглецевого скелета. Відповідний різниця - CH 2 -. Алкани, число атомів вуглецю в яких більше трьох, мають ізомери. Число цих ізомерів зростає з величезною швидкістю в міру збільшення числа атомів вуглецю. Для алканов з n = 1 ... 12 число ізомерів дорівнює 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355.

Представники алканів

Фізичні властивості
Температури плавлення і кипіння збільшуються з молекулярної масою і довжиною головної вуглецевого ланцюга
При нормальних умовах нерозгалужені алкани з CH 4 до C 4 H 10 - гази; з C 5 H 12 до C 13 H 28 - рідини; після C 14 H 30 - тверді речовини.
Температури плавлення і кипіння знижуються від менш розгалужених до більш розгалуженим. Так, наприклад, при 20 C н-пентан - рідина, а неопентана - газ.
Газоподібні алкани горять безбарвним або блідо-блакитним полум'ям з виділенням великої кількості тепла.
Фізичні властивості насичених вуглеводнів закономірно змінюються залежно від їх складу. Як видно з таблиці, перші чотири гомологи (від C1 до C4) при звичайній температурі є газами, наступні одинадцять (від C6 до C15) — рідини, а починаючи з гексадекану C16H34 — тверді речовини. Із збільшенням молекулярної маси їх точки плавлення і точки кипіння поступово підвищуються, а також збільшується і їх густина. У воді насичені вуглеводні практично нерозчинні, але добре розчиняються в багатьох органічних розчинниках.

Г а з о п о д і б н а. здатні з водою утворювати, особливо під тиском, молекулярні сполуки — газогідрати, для яких температура розкладу при тиску 0,1 МПа і критична температура відповідно рівні: з метаном — 29 і 21,50°C, з етаном — 15,8 і 14,50°C, з пропаном 0 і 8,50°C. Такі гідрати часто вимерзають на внутрішніх стінках газопроводів. Гідрати — сполуки, включення (клатрати) — являють собою снігоподібні речовини, з загальною формулою Мn Н2О, де значення n змінюється від 5,75 до 17 в залежності від складу газу і умов утворення. Природні гази містять в основному метан і менше 20% в сумі етану, пропану і бутану, домішки легкокиплячих рідких вуглеводнів — пентану, гексану та інших. Окрім цього присутні в малій кількості оксид вуглецю (IV), азот, сірководень й інертні гази.

Р і д к а., особливо нормальної будови, можуть у порівняно м'яких умовах окиснюватися киснем повітря. Вони є компонентами моторного палива: бензину, газотурбінних (авіаційних, наземних, морських) і дизельних.
Т в е р д а. виділяються із нафтової сировини при виробництві змащувальних олив, оскільки вони викристалізовуються із оливи, зменшуючи її рухомість і зумовлюючи застигання при високих температурах. Тверді алкани діляться на дві групи речовин — власне парафін і церезин.

Спектральні властивості
В ІЧ-спектрах алканов чітко проявляються частоти валентних коливань зв'язку С-Н в області 2850-3000 см -1. Частоти валентних коливань зв'язку С-С змінні і часто малоінтенсивне. Характеристичні деформаційні коливання в зв'язку С-Н в метильної і метиленової групах зазвичай лежать в інтервалі 1400-1470 см -1, однак метильная група дає в спектрах слабку смугу при 1380 см -1.
Чисті алкани не поглинають в ультрафіолетовій області вище 2000 і з цієї причини часто виявляються відмінними розчинниками для зняття УФ-спектрів інших сполук.

Хімічні властивості
Алкани мають низьку хімічну активність. Це пояснюється тим, що поодинокі зв'язку CH і CC щодо міцні і їх складно зруйнувати. Оскільки вуглецеві зв'язку неполярних, а зв'язку С-Н малополярни, обидва види зв'язків малополярізуеми і відносяться до σ-виду, їх розрив найбільш вірогідний по гомолитического механізму, тобто з утворенням радикалів.

Галогенування - це одна з реакцій заміщення. У першу чергу галогеніруется найменш гідрування атом вуглецю (третинний атом, потім вторинний, первинні атоми галогеніруются в останню чергу). Галогенування алканів проходить поетапно - за один етап заміщається не більше одного атома водню:
CH 4 + Cl 2 → CH 3 Cl + HCl ( хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl ( дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl ( тріхлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl ( тетрахлорметан).
Під дією світла молекула хлору розпадається на радикали, потім вони атакують молекули алкана, забираючи у них атом водню, в результаті цього утворюються метильні радикали СН 3, які стикаються з молекулами хлору, руйнуючи їх і утворюючи нові радикали.
Бромування алканів відрізняється від хлорування через більшу різниці в швидкостях бромування третинних, вторинних і первинних атомів вуглецю при низьких температурах.
Йодування алканів йодом не відбувається, отримання иодидов прямим йодування здійснити не можна.
З фтором і хлором реакція може протікати з вибухом, в таких випадках галоген розбавляють азотом або відповідним розчинником

Хімічні реакції
Алкани реагують з 10% розчином азотної кислоти або оксидом азоту NO 2 в газовій фазі при температурі 140 C і невеликому тиску з утворенням нітропохідних.
RH + HNO 3 → RNO 2 + H 2 O.
Усі наявні дані вказують на вільнорадикальних механізм. У результаті реакції утворюються суміші продуктів.
При опроміненні УФ-світлом алкани реагують з сумішшю SO 2 і Cl 2, Після того, як з відходом хлороводорода утворюється алкільних радикал, приєднується діоксид сірки. Утворився складний радикал стабілізується захопленням атома хлору з руйнуванням черговий молекули останнього.

Реакції окислення
Основним хімічним властивістю граничних вуглеводнів, що визначають їхнє використання в якості палива, є реакція горіння. Приклад:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q.
Значення Q досягає 46 000 - 50 000 кДж / кг.
У разі браку кисню замість вуглекислого газу виходить чадний газ чи вугілля (в залежності від концентрації кисню).
В загальному вигляді реакцію горіння алканов можна записати наступним чином:
З n Н 2 n +2 + (1,5 n +0,5) O 2 → n CO 2 + (n +1) H 2 O.
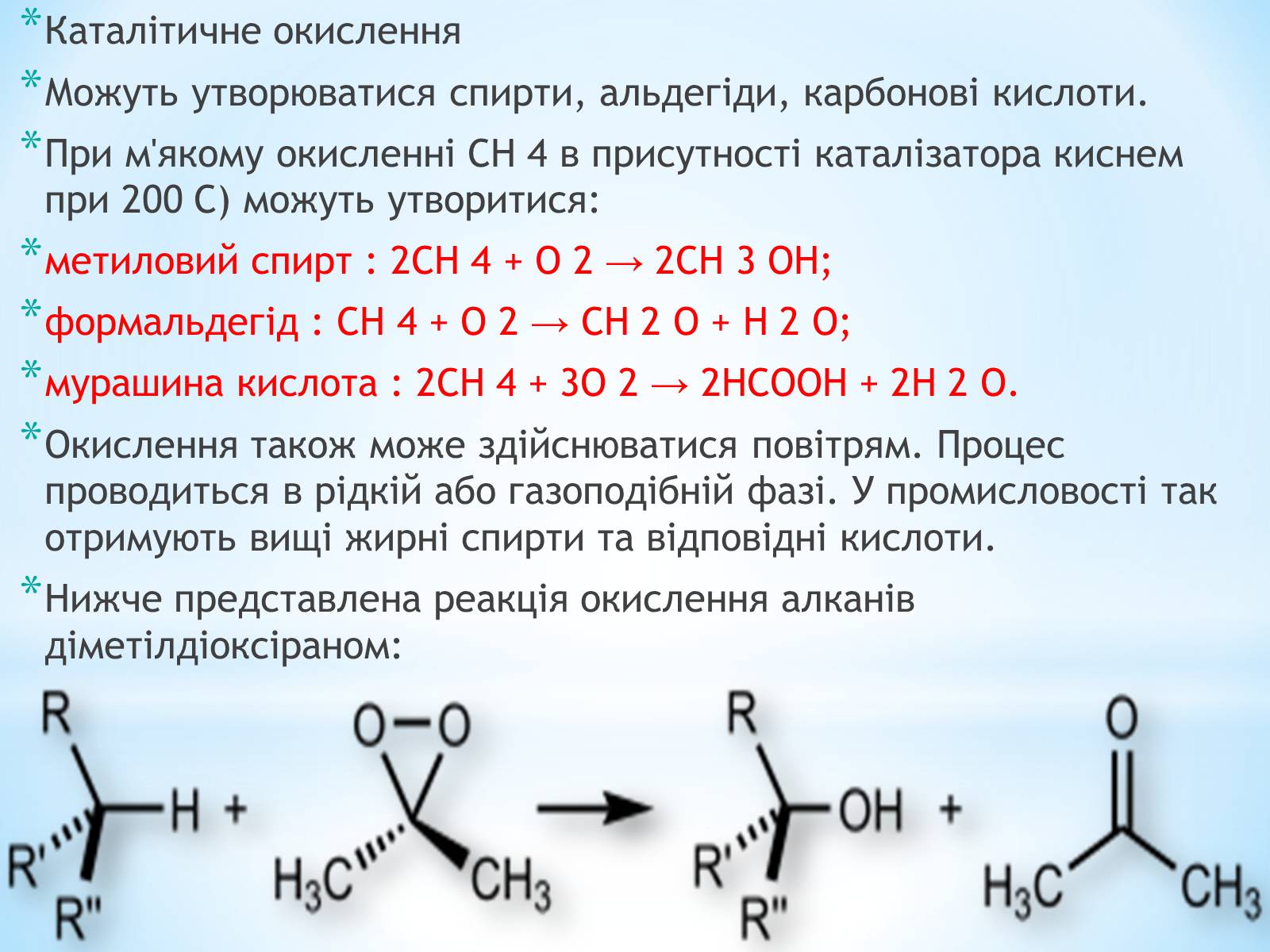
Каталітичне окислення
Можуть утворюватися спирти, альдегіди, карбонові кислоти.
При м'якому окисленні СН 4 в присутності каталізатора киснем при 200 C) можуть утворитися:
метиловий спирт : 2СН 4 + О 2 → 2СН 3 ОН;
формальдегід : СН 4 + О 2 → СН 2 О + Н 2 O;
мурашина кислота : 2СН 4 + 3О 2 → 2НСООН + 2Н 2 O.
Окислення також може здійснюватися повітрям. Процес проводиться в рідкій або газоподібній фазі. У промисловості так отримують вищі жирні спирти та відповідні кислоти.
Нижче представлена реакція окислення алканів діметілдіоксіраном:

Крекінг
При нагріванні вище 500 C алкани піддаються піролітичної розкладання з утворенням складної суміші продуктів, склад і співвідношення яких залежать від температури і часу реакції. При піролізі відбувається розщеплення вуглець-вуглецевих зв'язків з утворенням алкільних радикалів.
В 1930-1950 рр.. піроліз вищих алканів використовувався в промисловості для отримання складної суміші алканів і алкенів, що містять від п'яти до десяти атомів вуглецю. Він отримав назву "термічний крекінг". За допомогою термічного крекінгу вдавалося збільшити кількість бензинової фракції за рахунок розщеплення алканів, що містяться в гасової фракції ( 10-15 атомів вуглецю в вуглецевому кістяку) і фракції солярового масла ( 12-20 атомів вуглецю). Однак октанове число бензину, отриманого при термічному крекінгу, не перевищує 65, що не відповідає вимогам умов експлуатації сучасних двигунів внутрішнього згоряння.
В даний час термічний крекінг повністю витіснено в промисловості каталітичним крекінгом, який проводять в газовій фазі при більш низьких температурах - 400-450 C і низькому тиску - 10-15 атм на алюмосиликатном каталізаторі, який безперервно регенерується спалюванням утворюється на ньому коксу в струмі повітря. При каталітичному крекінгу в отриманому бензині різко зростає вміст алканів з розгалуженою структурою.
Для метану:
CH 4 → С + 2H 2 - при 1000 C.
Частковий крекінг:
2CH 4 → C 2 H 2 + 3H 2 - при 1500 C.

Поширення алканів
Основне джерело алканів в природі - нафта; фракції нафти 200-430 ° С містять 30-50% (за масою) насичених вуглеводнів (З них до 60% вуглеводнів нормальної будови); нижчі газоподібні насичені вуглеводні входять до складу природного газу (До 98% метану) і розчинені в нафті; тверді зустрічаються у вигляді покладів озокериту, а також утворюють воскові покриття листя, квітів і насіння рослин, входять до складу бджолиного воску.

Метан та його застосування
Мета́н — найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4.
Зустрічається в осадовому чохлі земної кори у вигляді вільних скупчень (покладів), в розчиненому (в нафті, пластових і поверхневих водах), розсіяному, сорбованому (породами і органіч. речовиною) і твердому (газогідратному) станах.
При використанні в побуті, до метану звичайно додають одоранти зі специфічним «запахом газу».

Метан є основним компонентом:
газів природних горючих (до 99,5 %),
нафтових попутних (39-91 %),
болотяних (понад 99 %) і рудникових (34-48 %) газів;
присутній у газах грязьових вулканів (понад 95 %),
спорадично зустрічається у вулканічних газах і в газах магматичних і метаморфічних порід.
Велика кількість метану розчинена у водах океанів, морів, озер. Середній вміст метану у водах Світового океану близько 10-2 см3/л, загальна кількість — 14·1012 м3. Кількість метану, розчиненого у пластових водах, на декілька порядків вища від його промислових запасів.
Метан присутній також в атмосферах Землі, Юпітера, Сатурна, Урану; в газах поверхневого ґрунту Місяця. Основна маса метану літо- і гідросфери Землі утворилася при біохімічній і термокаталітичній деструкції розсіяної органічної речовини, вугілля і нафт. Метан утворюється при анаеробному розкладанні органічних речовин, зокрема целюлози (метанове бродіння).

В природі Землі метан досить поширений. Горючі природні гази складаються на 90—97 % з метану. Він утворює багато родовищ, з яких добувається і по газопроводах подається до місця використання. На дні болот і ставків метан утворюється внаслідок розкладу залишків рослин без доступу повітря. Тому його називають ще болотним газом. Під назвою «рудниковий газ» метан нагромаджується у вугільних шахтах, внаслідок виділення з пластів вугілля і супутніх порід, в яких знаходиться у вільному та зв'язаному вигляді. На діючих шахтах спостерігається виділення метану з вугільних пластів у обсязі, що робить економічно доцільним його самостійне або супутнє (дегазація) видобування з вугільних родовищ.
Рудниковий газ дуже небезпечний, оскільки з повітрям може утворювати вибухову суміш. Найбільш вибухонебезпечні концентрації метану у повітрі — 9—14 %.
Основний компонент природних (77—99 %), супутніх нафтових (31—90 %), рудникового та болотного газів. Є парниковим газом.
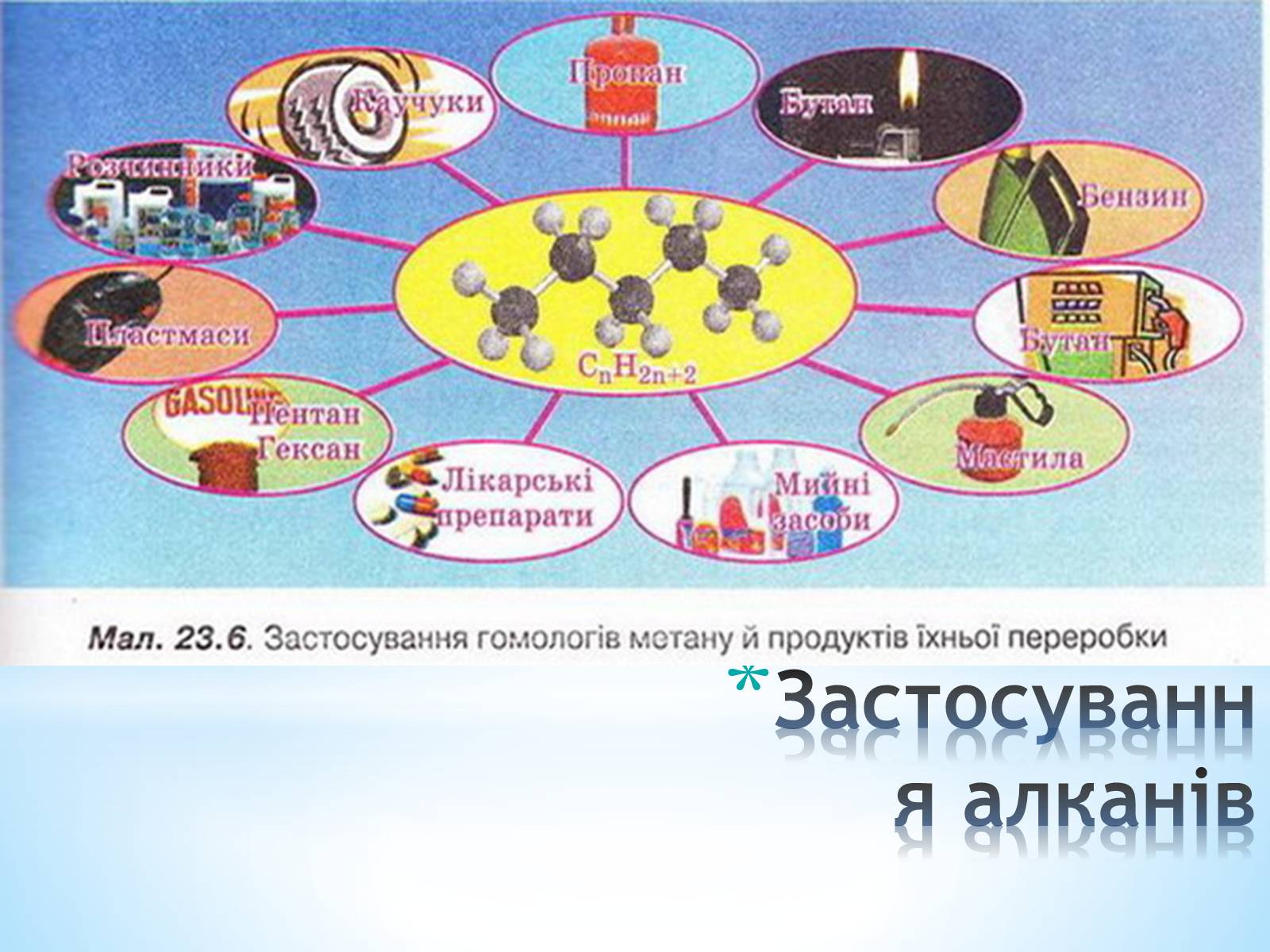
Застосування алканів

Дякую
за
увагу!