Презентація на тему «Молекула»

Молекула
Виконала учениці 10-В
Висоцька Ірина і
Замора Карина
Моле́кула (новолат. molecula, зменшувально від лат. moles — маса) — здатна до самостійного існування частинка простої або складної речовини, що має її основні хімічні властивості, які визначаються її складом та будовою.

Будова та склад молекули
Молекула складається з атомів, а якщо точніше, то з атомних ядер, оточених певним числом внутрішніх електронів, та зовнішніх валентнихелектронів, які утворюють хімічні зв'язки. Внутрішні електрони атомів, зазвичай, не беруть участі в утворенні хімічних зв'язків. Склад та будова молекул речовини не залежать від способу її отримання. У випадку одноатомних молекул (наприклад, інертних газів) поняття молекули й атома збігаються.
Атоми об'єднуються в молекулі в більшості випадків за допомогою хімічних зв'язків. Як правило, такий зв'язок утворюється однією, двома або трьома парами електронів, які перебувають у спільному володінні двох атомів, утворюючи спільну електронну хмару, форма якої описується типом гібридизації. Молекула може мати позитивно та негативно заряджені атоми (йони).
Склад молекули передається хімічними формулами. Емпірична формула встановлюється на основі атомного співвідношення елементів речовини та молекулярної маси.

Міжмолекулярна взаємодія
Міжмолекулярна взаємодія — взаємодія між електрично нейтральними молекулами у просторі. У залежності від полярності молекул характер міжмолекулярної взаємодії різний. Розрізняють орієнтаційний, індукційний та дисперсійний типи міжмолекулярної взаємодії. Природа останнього залишалася неясною до створення квантової механіки.
Орієнтаційний тип міжмолекулярної взаємодії виникає між двома полярними молекулами, тобто, такими, які мають власний дипольний момент. Взаємодія дипольних моментів і визначає результуючу силу — притягання або відштовхування. У випадку, якщо дипольні моменти молекул розміщуються на одній лінії, взаємодія молекул буде найінтенсивніша.
Індукційний тип міжмолекулярної взаємодії виникає між однією полярною та однією неполярною молекулами. При цьому типові взаємодії полярна молекула поляризує неполярну молекулу так, що заряд неполярної молекули, протилежний діючому на неї заряду полярної молекули, зміщується до останнього: загалом, позитивний заряд зміщується по напряму електричного поля, яке створює полярна молекула, а негативний — проти. Це обумовлює поляризацію неполярної молекули, тобто, явища зміщення зв'язаної електронної оболонки відносно центру позитивного заряду.
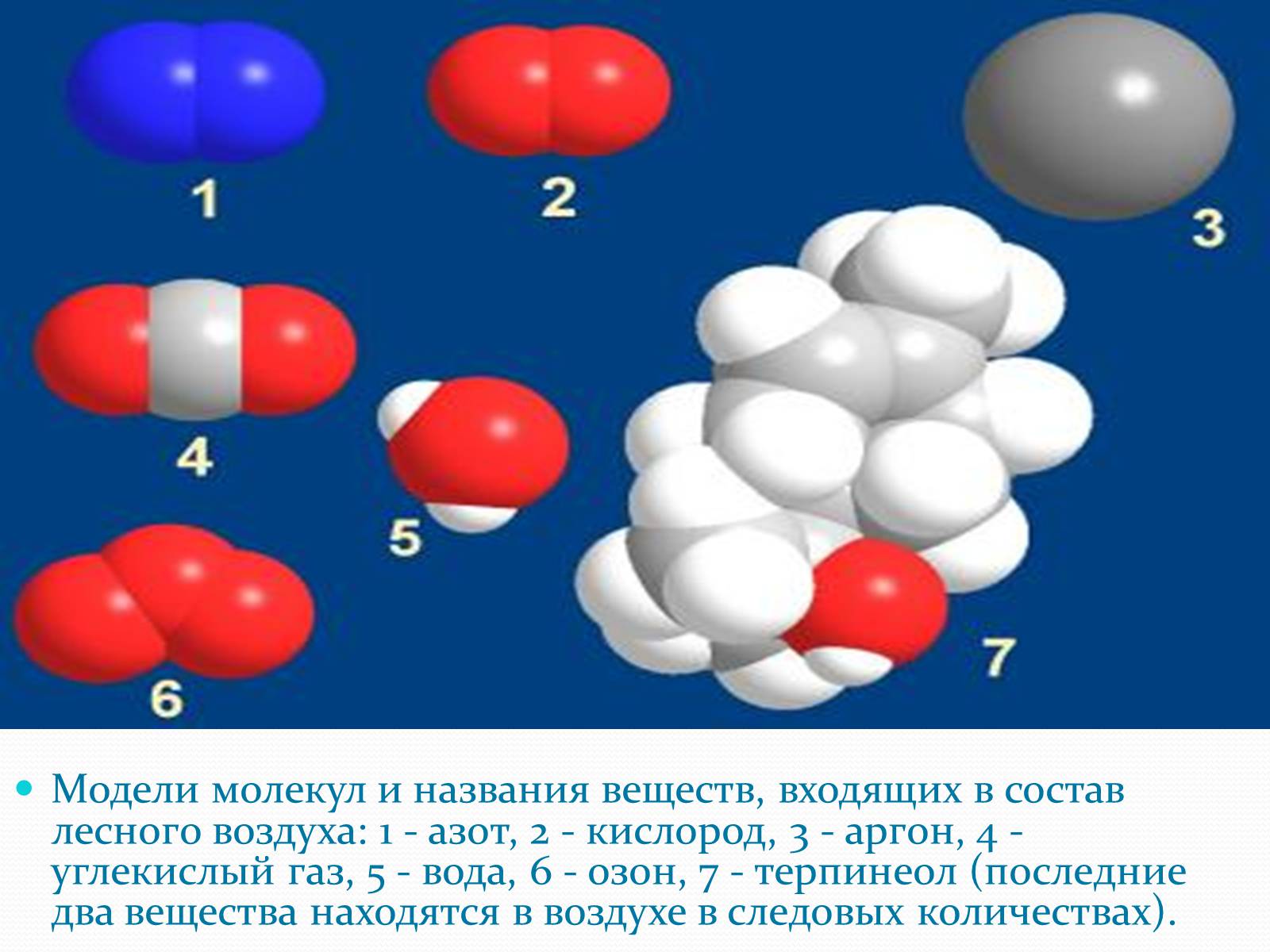
Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 - азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон, 7 - терпинеол (последние два вещества находятся в воздухе в следовых количествах).

Швидкість молекул
середня квадратична
найбільш ймовірна
середня арифметична
k - стала Больцмана, T — абсолютна температура

Молекули в хімії, фізиці та біології
Поняття молекули є основним для хімії, і більшою частиною відомостей про будову і функціональність молекул наука зобов'язана хімічним дослідженням. Хімія визначає будову молекул на основі хімічних реакцій і, навпаки, на основі будови молекули, визначає яким буде хід реакцій.
Будовою і властивостями молекули визначаються фізичні явища, які вивчаються молекулярною фізикою. В фізиці поняття молекули використовується для пояснення властивостей газів, рідин і твердих тіл. Рухомістю молекул визначається здатність речовини до дифузії, її в'язкість, теполопровідність тощо. Перший прямий експериментальний доказ існування молекул було отримано французьским фізиком Ж. Перреном в 1906 році під час вивчення броунівського руху.
Оскільки всі живі організми існують на основі тонко збалансованої хімічної і нехімічної взаємодії між молекулами, вивчення будови і властивостей молекул має фундаментальне значення для біології і природознавства в цілому.
Розвиток біології, хімії та молекулярної фізики призвели до виникнення молекулярної біології, яка досліджує основні явища життя, виходячи з будови і властивостей біологічно функціональних молекул.

Тепловий рух молекул газу
Найважливішою рисою теплового руху молекул газу — це безладність (хаотичність) руху. Експериментальним доказом безперервного характеру руху молекул є дифузія і броунівський рух.
Дифузія — це явище самовільного проникнення молекул однієї речовини в іншу. У результаті взаємної дифузії речовин відбувається поступове вирівнювання їх концентрації у всіх областях займаного ними об'єму. Встановлено, що швидкість протікання процесу дифузії залежить від роду речовин, що дифундують і температури.
Одним з найцікавіших явищ, які підтверджують хаотичність руху молекул, є броунівський рух, котрий проявляється у вигляді теплового руху мікроскопічних часток речовини, що знаходяться в завислому стані у газі. Це явище у 1827 році вперше спостерігав[3] Р. Браун, від імені якого воно отримало назву. Безладність переміщення таких частинок пояснюється випадковим характером передачі імпульсів від молекул газу до частки з різних сторін. Броунівський рух виявляється тим помітніше, чим менші частки і чим вища температура системи. Залежність від температури свідчить про те, що швидкість хаотичного руху молекул зростає зі збільшенням температури, саме тому його і називають тепловим рухом.