Презентація на тему «Метан»

Метан
Автор презентації:
Учень 11-Б класу
Пташник Євген

Найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4.
Зустрічається в осадовому чохлі земної кори у вигляді вільних скупчень (покладів), в розчиненому (в нафті, пластових і поверхневих водах), розсіяному, сорбованому (породами і органіч. речовиною) і твердому (газогідратному) станах.
При використанні в побуті, до метану звичайно додають речовини з різким запахом.
Загальні відомості

Метан — безбарвний газ без запаху і смаку, майже у два рази легший від повітря. У воді малорозчинний.Має густину за повітрям 0,555 (20 °C); молекулярна маса 16,04, tпл = −182,49 °C, t кип = −161,56 °C критичний тиск 4,58 МПа,критична температура −82,°С, температура спалаху 87,8 °C, температура самозаймання 537,8 °C.
Фізичні властивості

Вибухонебезпечний при концентрації в повітрі від 4,4 % до 17 % . Найбільш вибухонебезпечна концентрація 9,5 %. Є наркотиком ; дія послаблюється незначною розчинністю у воді і крові. Клас небезпеки - четвертий .
Сер Хемфрі Деві (вчений - хімік ) ще в 1813 р. уклав зі своїх аналізів , що копальневий газ є суміш метану CH4 з невеликою кількістю азоту N2 і вугільного ангідриду СО2 - тобто , що він якісно тотожний за складом з газом, що виділяється з боліт .

Характерна для метану також реакція з хлором, яка відбувається при звичайній температурі під впливом розсіяного світла.
CH4 + Cl2 = CH3Cl + HCl
CH3Cl + Cl2 = CH2Cl2 + HCl
CH2Cl2 + Cl2 = CHCl3 + HCl
CHCl3 + Cl2 = CCl4 + HCl
Внаслідок реакції утворюється суміш хлоропохідних метану.
В атмосфері повітря метан горить безбарвним полум'ям з виділенням значної кількості тепла:
CH4 + 2O2 = СО2 + 2Н2О
З повітрям метан утворює вогненебезпечну вибухову суміш. При нагріванні метану без доступу повітря до температури вище 1000 °C він розкладається на елементи — на вуглець і водень:
CH4 = С + 2Н2
Хімічні Властивості

Застосування метану

Паливна промисловість
СН4 + 2О2 = СО2 + 2Н2О + 880 Дж
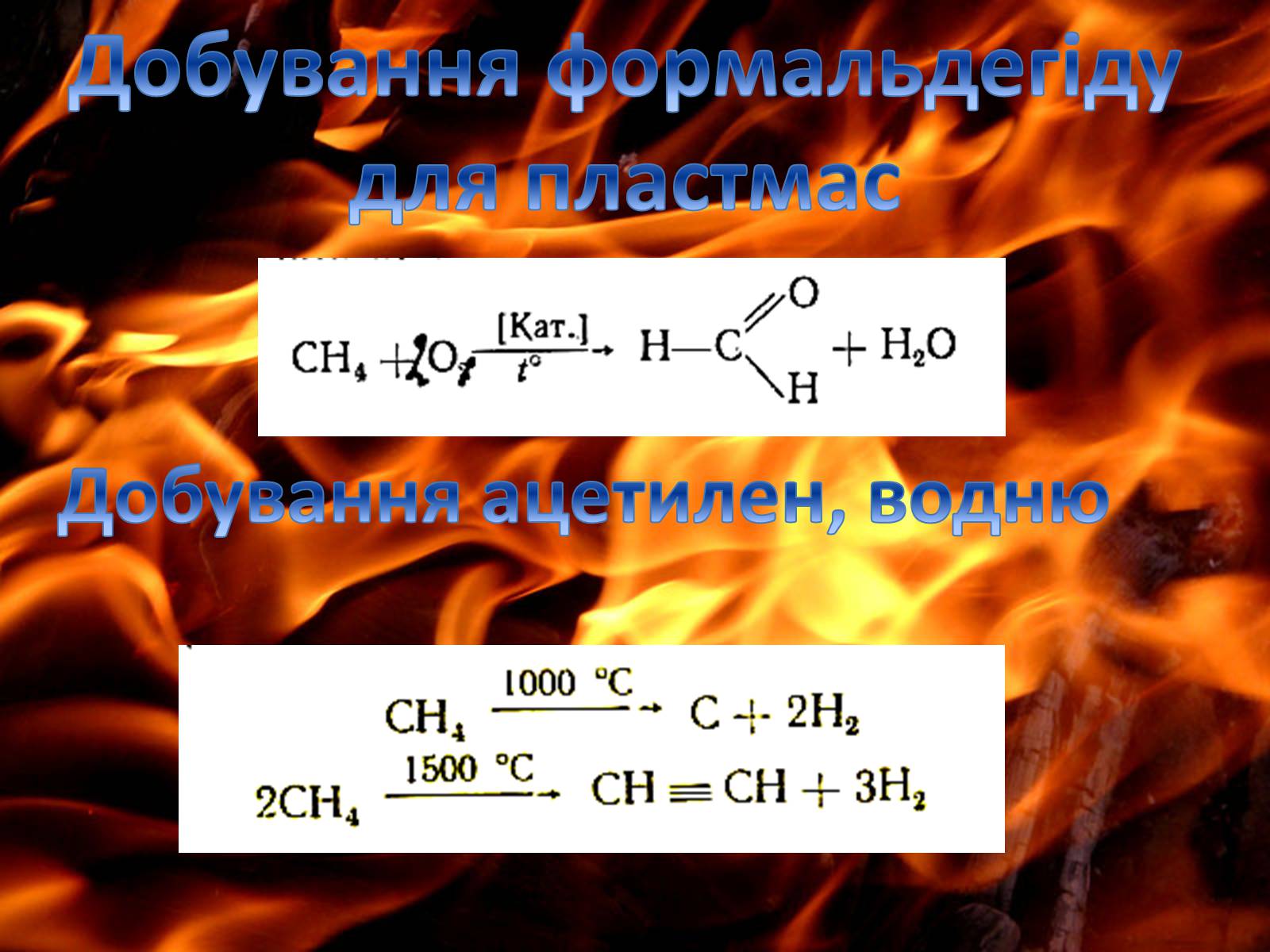
Добування формальдегіду
для пластмас
Добування ацетилен, водню

Добування хлорпохідних
СН4 + Cl2 CH3Cl + HCl
СН4 + Cl2 =CH3Cl + HCl
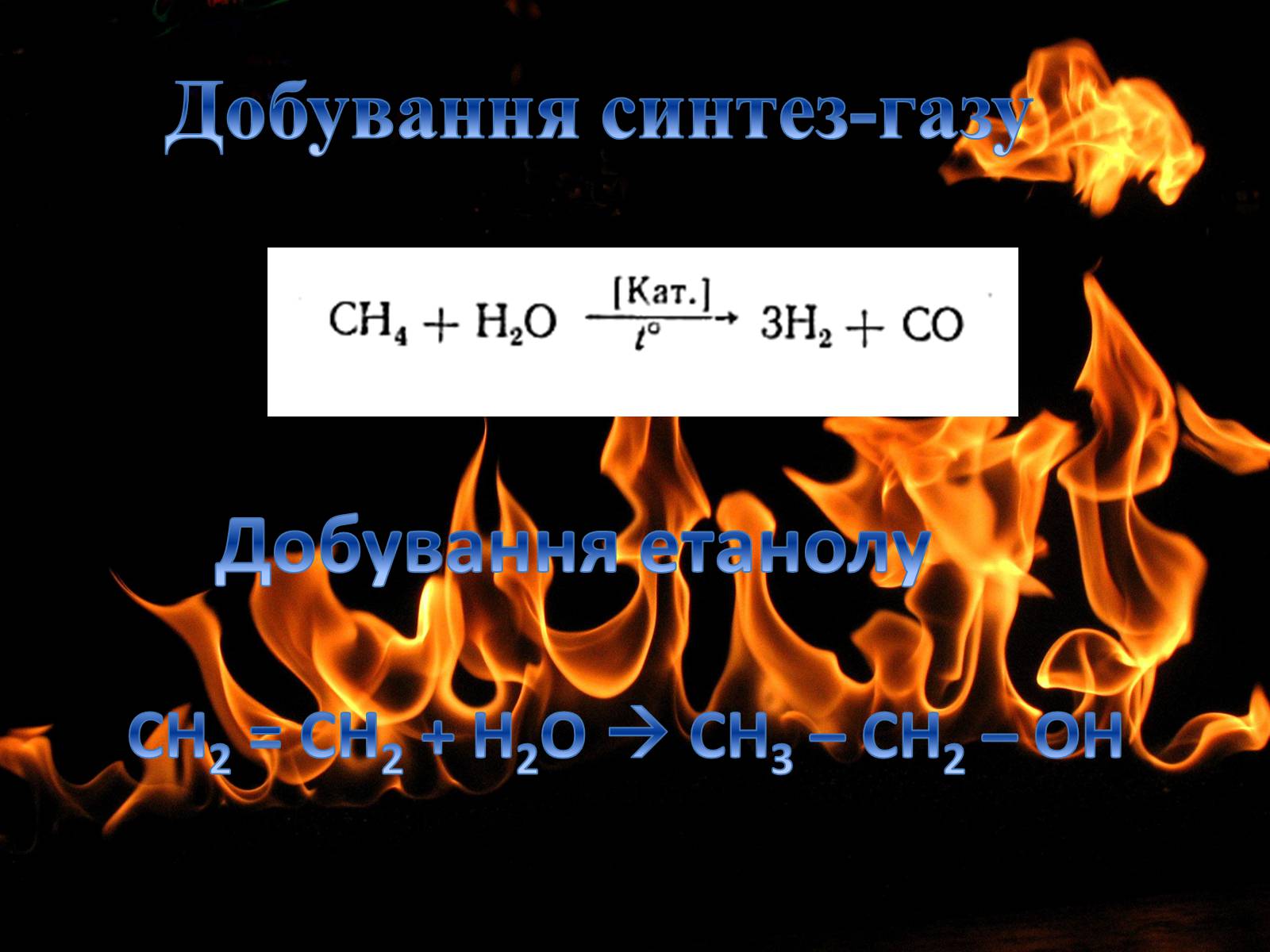
Добування синтез-газу
Добування етанолу
СН2 = СН2 + Н2О CH3 – CH2 – OH

Добування поліетилену
nСН2 = СН2 (- CH2 – CH2 –)n