Презентація на тему «Метали» (варіант 1)

Метали
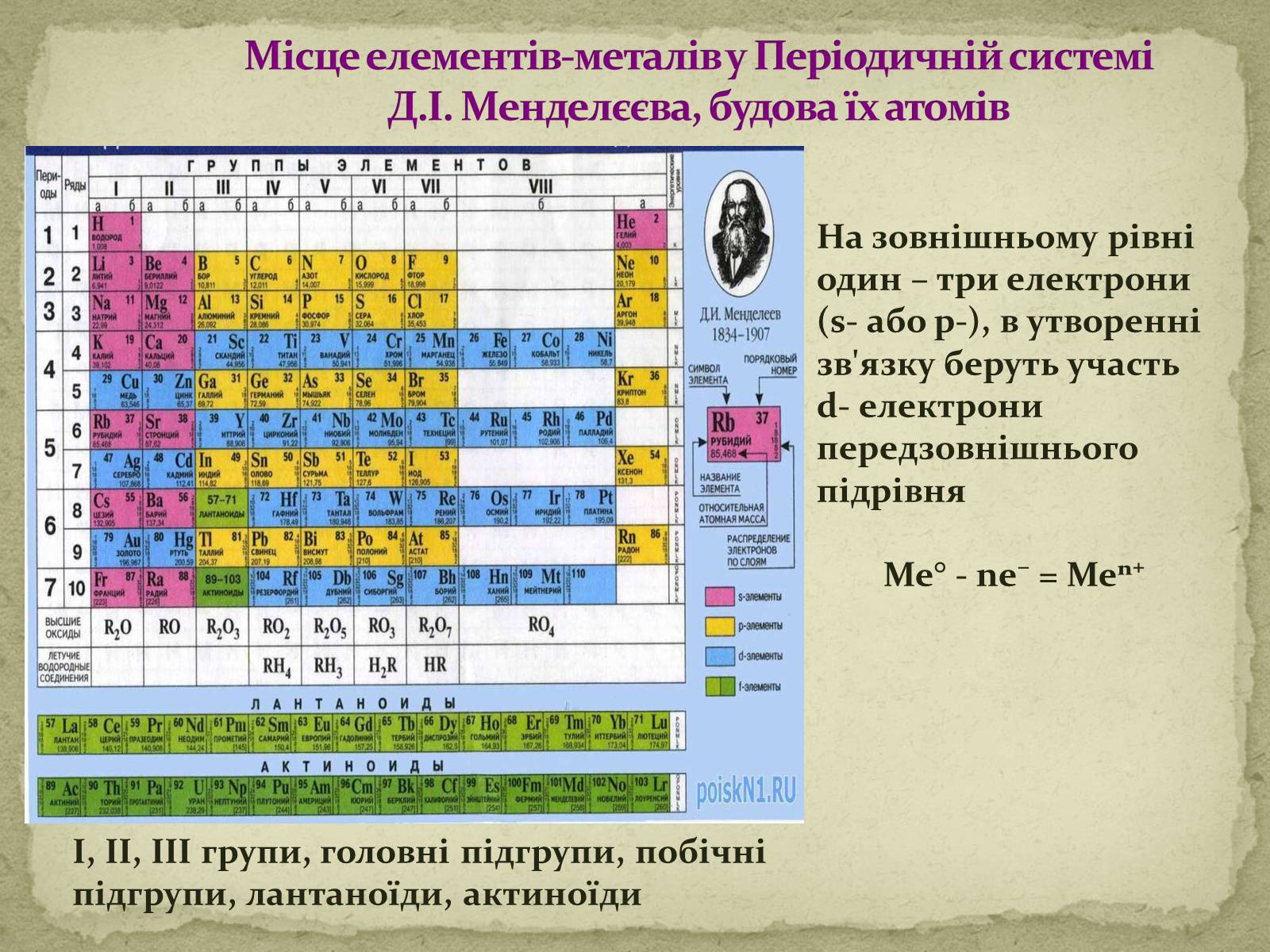
Місце елементів-металів у Періодичній системі Д.І. Менделєєва, будова їх атомів
І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи, лантаноїди, актиноїди
На зовнішньому рівні один – три електрони (s- або p-), в утворенні зв'язку беруть участь d- електрони передзовнішнього підрівня
Me° - ne⁻ = Meⁿ⁺

Металічна кристалічна гратка
Металевий зв'язок і кристалічна гратка
+
+
+
+
У вузлах ґраток – атоми й
катіони металу, між вузлами –
відносно вільні електрони.
Металевий зв'язок – це хімічний зв'язок, утворений за рахунок усуспільнення валентних електронів усіх атомів металевого кристала,
що зв'язуються. У результаті утворюється єдина електронна хмарина кристала, що легко зміщається під дією електричної напруги.
Металевий зв'язок не має спрямованості й насичуваності. Він зберігається й у розплавах металів.
+
+

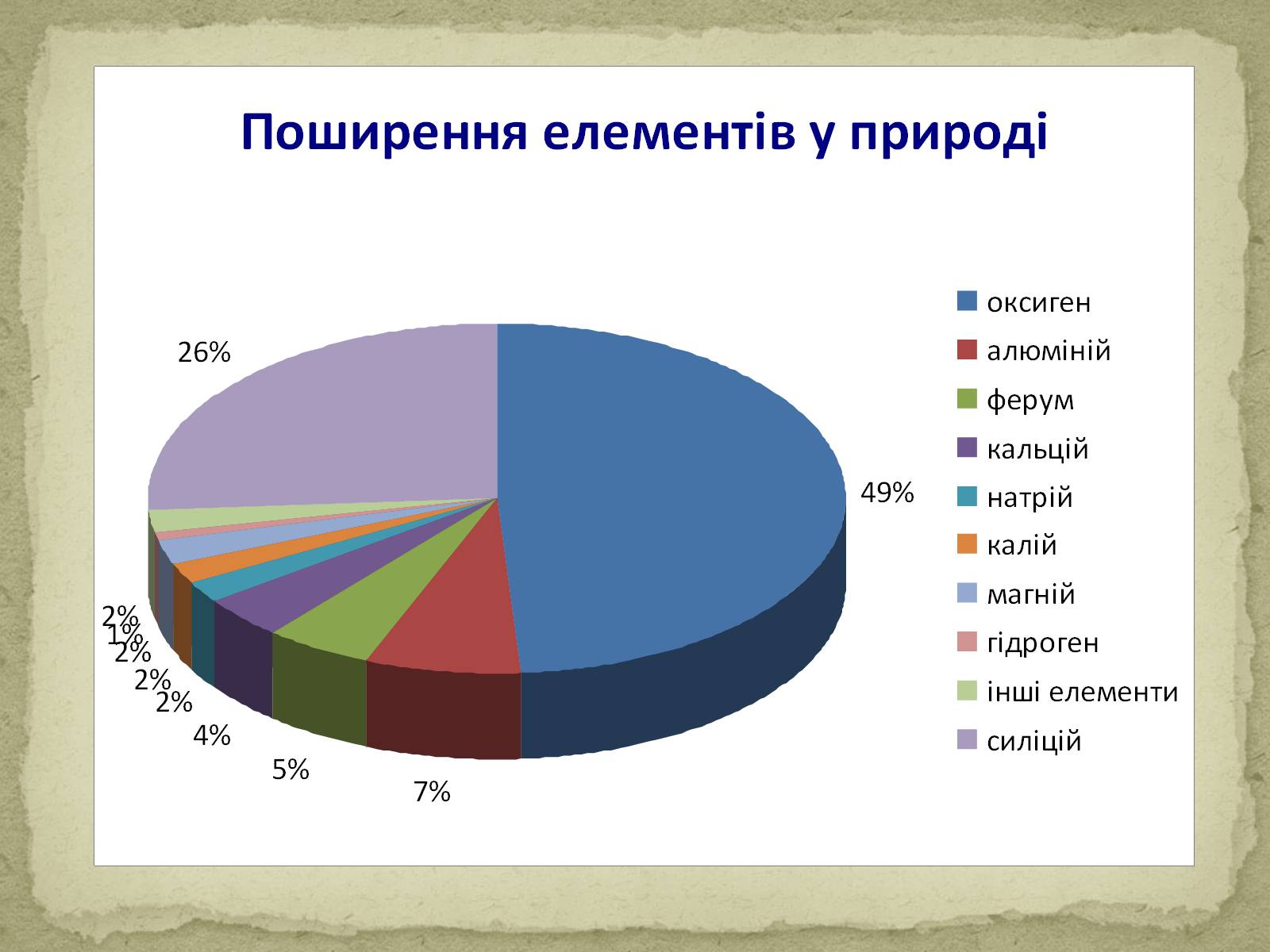
Агрегатний стан: тверді, за винятком Hg, Ga.
Колір: усі відтінки від сірого до чорного (винятки Cu, Au).
Тепло – й електропровідність (за рахунок вільних електронів) збільшуються в ряді Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag.
Ковкість і пластичність (йони безпосередньо один з одним не зв'язані, тому окремі їх шари можуть зміщатися один відносно одного). Найбільш пластичний метал – золото, найбільш крихкий – хром, манган, стибій.
Густина: легкі – ρ < 5 г/см ³ (ρ (Li) = 0,53 г/см ³); важкі – ρ > 5 г/см ³ (ρ (Os) = 22,48 г/см ³).
Твердість: м'які (лужні метали); тверді (хром).
Температура плавлення: легкоплавкі – Tпл (Hg) = 38,87 С; тугоплавкі – Тпл (W)=3370 С.
Температура кипіння в металів висока.
Загальні фізичні властивості металів
Агрегатний стан: тверді, за винятком Hg, Ga.
Колір: усі відтінки від сірого до чорного (винятки Cu, Au).
Тепло – й електропровідність (за рахунок вільних електронів) збільшуються в ряді Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag.
Ковкість і пластичність (йони безпосередньо один з одним не зв'язані, тому окремі їх шари можуть зміщатися один відносно одного). Найбільш пластичний метал – золото, найбільш крихкий – хром, манган, стибій.
Густина: легкі – ρ < 5 г/см ³ (ρ (Li) = 0,53 г/см ³); важкі – ρ > 5 г/см ³ (ρ (Os) = 22,48 г/см ³).
Твердість: м'які (лужні метали); тверді (хром).
Температура плавлення: легкоплавкі – Tпл (Hg) = 38,87 С; тугоплавкі – Тпл (W)=3370 С.
Температура кипіння в металів висока.
Загальні фізичні властивості металів
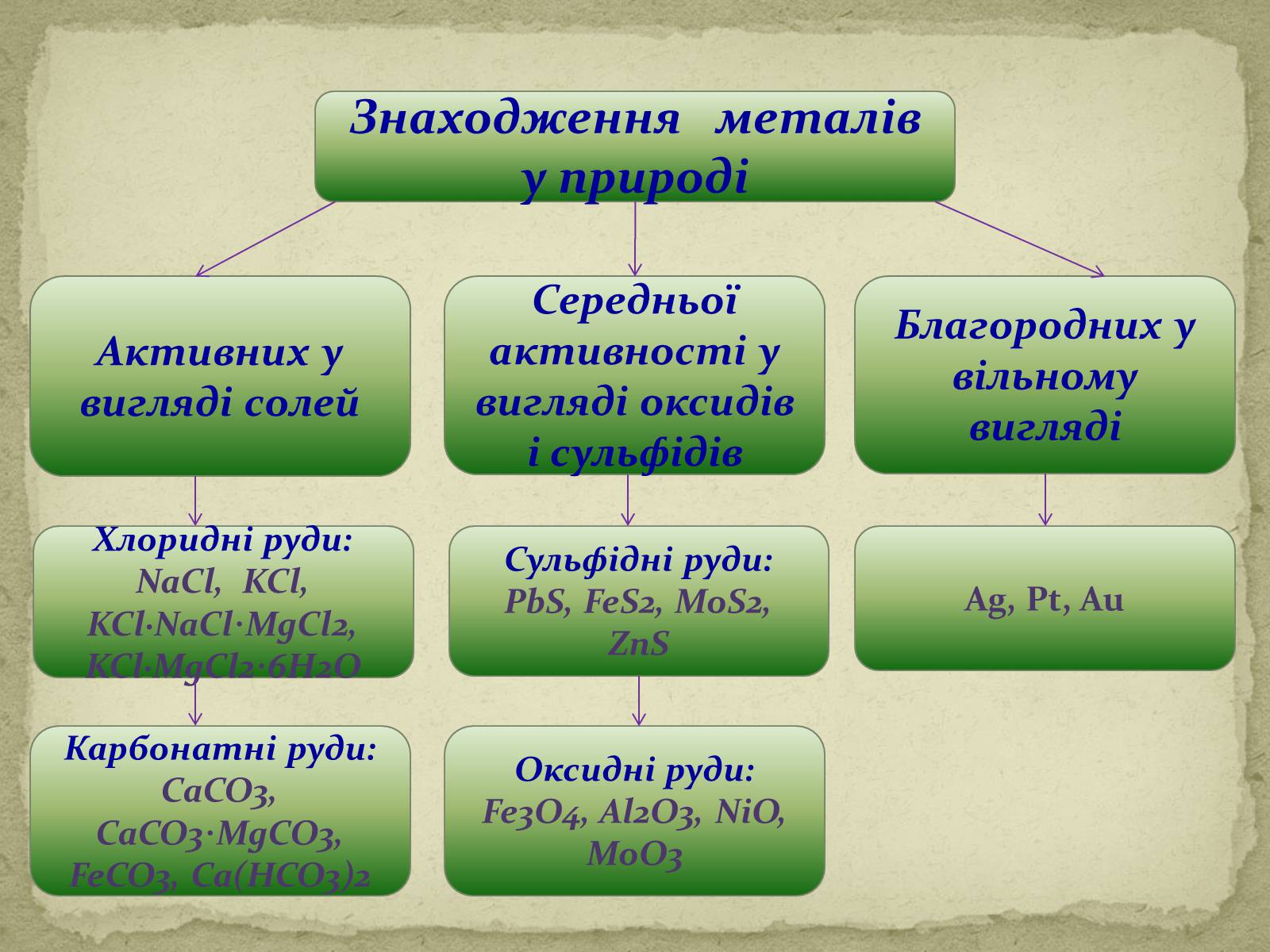
Благородних у вільному вигляді
Ag, Pt, Au
Середньої активності у вигляді оксидів і сульфідів
Активних у вигляді солей
Сульфідні руди: PbS, FeS2, MoS2, ZnS
Хлоридні руди: NaCl, KCl, KCl∙NaCl∙MgCl2, KCl∙MgCl2∙6H2O
Оксидні руди:
Fe3O4, Al2O3, NiO, MoO3
Карбонатні руди: CaCO3, CaCO3∙MgCO3, FeCO3, Ca(HCO3)2
Знаходження металів у природі

Благородних у вільному вигляді
Ag, Pt, Au
Середньої активності у вигляді оксидів і сульфідів
Активних у вигляді солей
Сульфідні руди: PbS, FeS2, MoS2, ZnS
Хлоридні руди: NaCl, KCl, KCl∙NaCl∙MgCl2, KCl∙MgCl2∙6H2O
Оксидні руди:
Fe3O4, Al2O3, NiO, MoO3
Карбонатні руди: CaCO3, CaCO3∙MgCO3, FeCO3, Ca(HCO3)2
Знаходження металів у природі

Якісні реакції
Na⁺ - дає жовте полум'я;
К⁺ - дає фіолетове полум'я;
Са²⁺ - дає яскраво-червоне полум'я;
Al³⁺ - з лугами дає білий осад, що
розчиняється в надлишку лугу;
Fe²⁺ - з лугами дає зеленуватий осад, який
на повітрі буріє;
Fe³⁺ - у лужному середовищі дає бурий осад.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au
РЯД АКТИВНОСТІ МЕТАЛІВ / ЕЛЕКТРОХІМІЧНИЙ РЯД НАПРУГ
активні
СреднЬОЇ активностІ
благородні

Хімічні властивості металів
Ме
+ Cl₂
+ S
+ HCl
+ НОН
МеО + Н₂ (магній, залізо)
+ Н₂
+ солі
+ О₂
МеCl (хлориди)
Ме₂S (сульфіди)
МеCl + Н₂
МеОН + Н₂ (лужні , Са)
МеН (гідриди)
сіль більш активного металу
Ме +
Ме₂О (K, Na K₂O₂; Na₂O₂)

Взаємодія лужного металу з водою
2Na + 2H2O = 2NaOH + H2
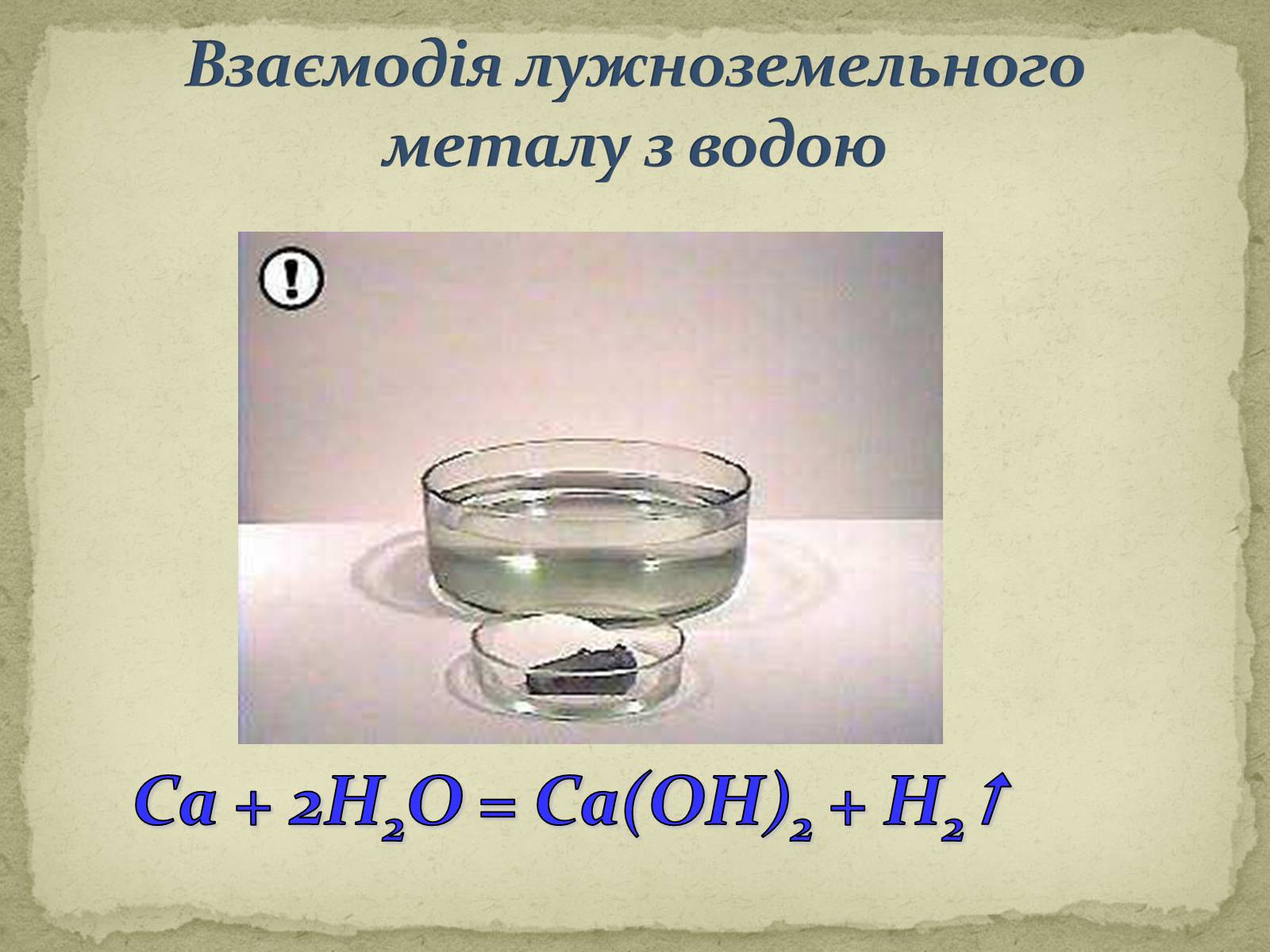
Взаємодія лужноземельного металу з водою
Са + 2Н2О = Са(ОН)2 + H2

Горіння магнію
0 0 +2 -2
2Мg + O2 = 2MgO

Реакція горіння кальцію в повітрі(реакція протікає бурхливо)
2Ca + O₂ = 2CaO

Реакція горіння літію
Li + O₂ = Li₂O

Каталітична реакція взаємодії алюмінію з йодом
4Al + 3I2 2AlI3

Оксиди металів
Li₂O; Na₂O; K₂O; CaO; MgO; FeO –
основні;
МеО + кислота сіль + вода
Al₂O₃; Fe₂O₃ - амфотерні;
Ме₂О₃ + кислота сіль + вода
Ме₂О₃ + луг сіль
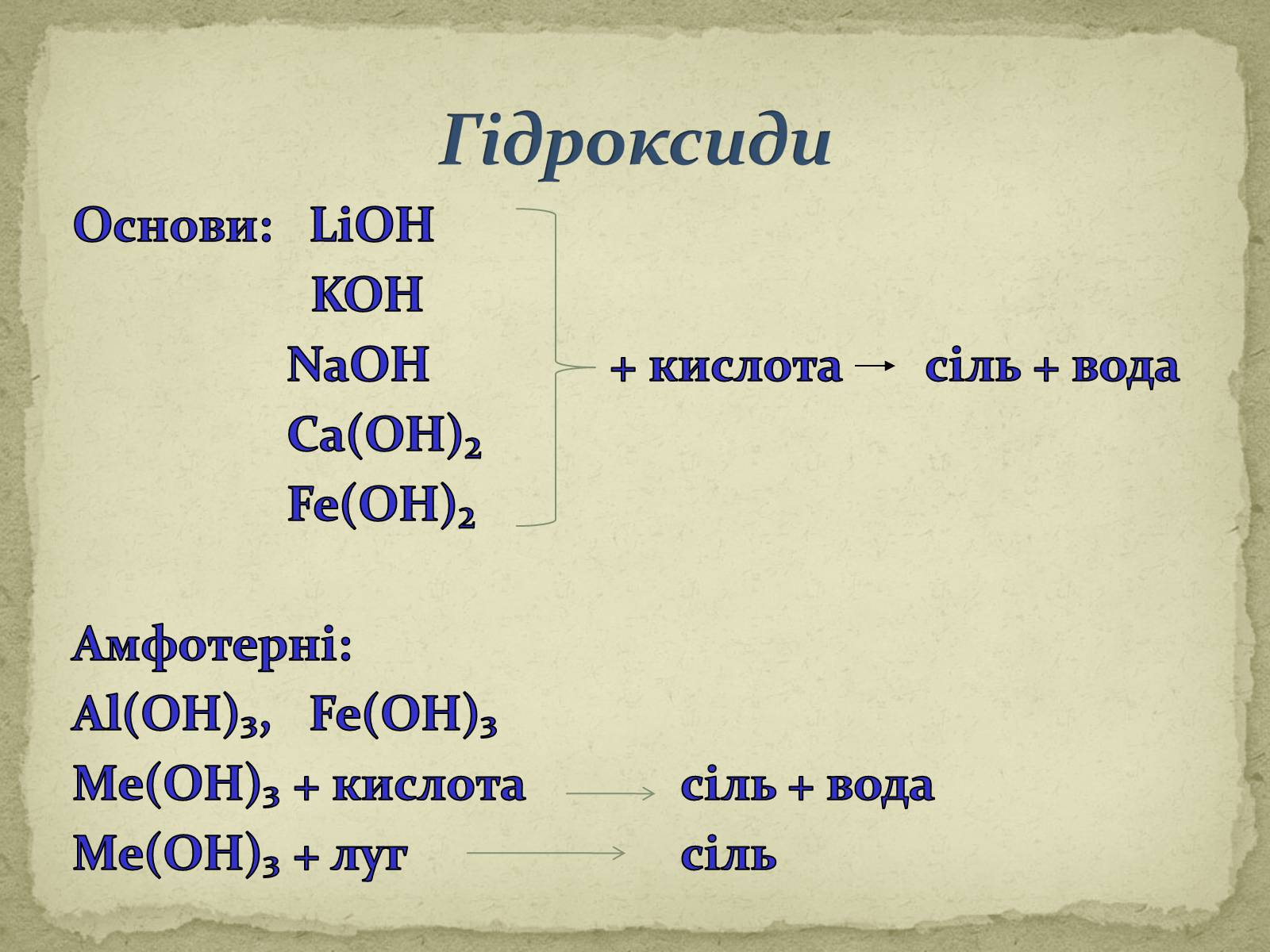
Основи: LiOH
KOH
NaOH + кислота сіль + вода
Ca(OH)₂
Fe(OH)₂
Амфотерні:
Al(OH)₃, Fe(OH)₃
Ме(ОН)₃ + кислота сіль + вода
Ме(ОН)₃ + луг сіль
Гідроксиди

Загальні способи одержання металів
1. Найактивніші (K, Ca, Mg, Na) відновлюють електролізом.
Електроліз – окисно-відновна реакція під дією постійного електричного струму.
2NaCl = 2Na + Cl₂
На катоді: Na⁺ + e⁻ = Na° - відновлення катіонів.
На аноді: Cl⁻ - e⁻ = Cl° - окиснення аніонів.

2. Менш активні метали відновлюють з оксидів або сульфідів (після попереднього випалу):
а) коксом за високих температур:
SnO₂ + C = CO₂ + Sn
б) карбон (ІІ) оксидом:
Fe₂O₃ + 3CO = 3CO₂ + 2Fe
в) воднем:
Fe₂O₃ + 3H₂ = 2Fe + 3H₂O
г) іншими більш активними металами, наприклад алюмінієм (алюмінотермія):
3MnO₂ + 4Al = 2Al₂O₃ + 3MnO
д) силіцієм (силікотермія):
2Al₂O₃ + 3Si = 4Al + 3SiO₂