Презентація на тему «Кислоти» (варіант 3)


Тема уроку:
КИСЛОТИ

Мета уроку:
Знати:
визначення,склад, класифікацію,формули,
номенклатуру ,фізичні та хімічні властивості
кислот
Вміти:
Визначати кислоти, складати їх формули
Записувати рівняння хімічних властивостей
Развивати:
Увагу,пам'ять,абстрактне мислення

Цілі:
Склад,класифікація кислот
Номенклатура,формули
Фізичні властивості
Хімічні властивості
Добування
Застосування
Дія на організм.Поводження з кислотами.

Актуалізація знань
Тест- тренажер з теми «Основи»

1.Вибрати формулу лугу
1
2
3
4
Fe(OH)2
KOH
Ba(OH)2
Fe(OH)3

2.Вибрати формулу основи
1
2
3
4
MnO2
H2O
NaOH
HCl

3.Яка формула написана вірно?
1
2
3
4
Cu(OH)2
KOH2
BaOH
MgOH

4. Яку основу утворює оксид MgO?
1
2
3
4
MgOH
Mg(OH)2
MgOH2
Mg(OH)3
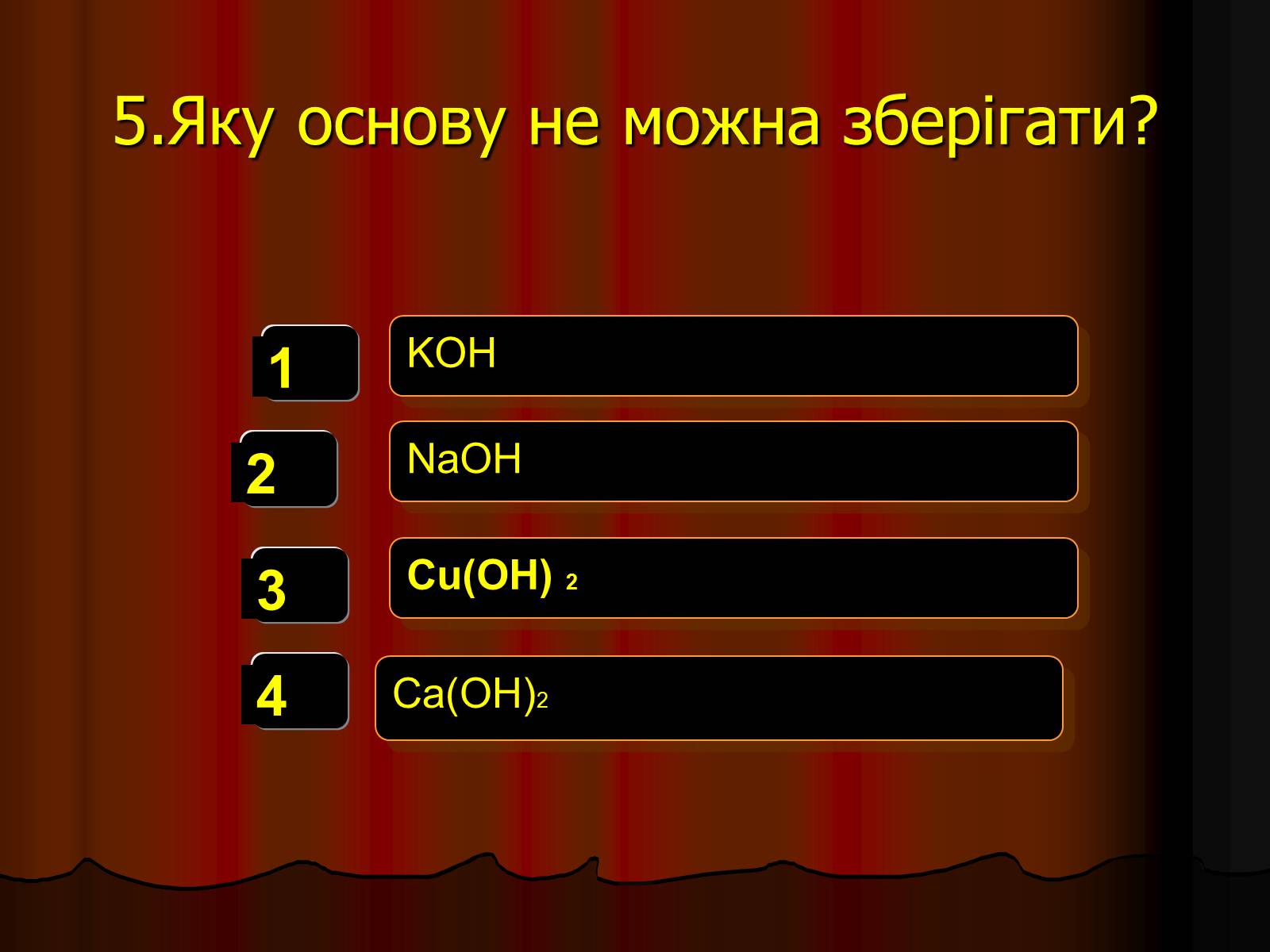
5.Яку основу не можна зберігати?
1
2
3
4
KOH
NaOH
Cu(OH) 2
Ca(OH)2
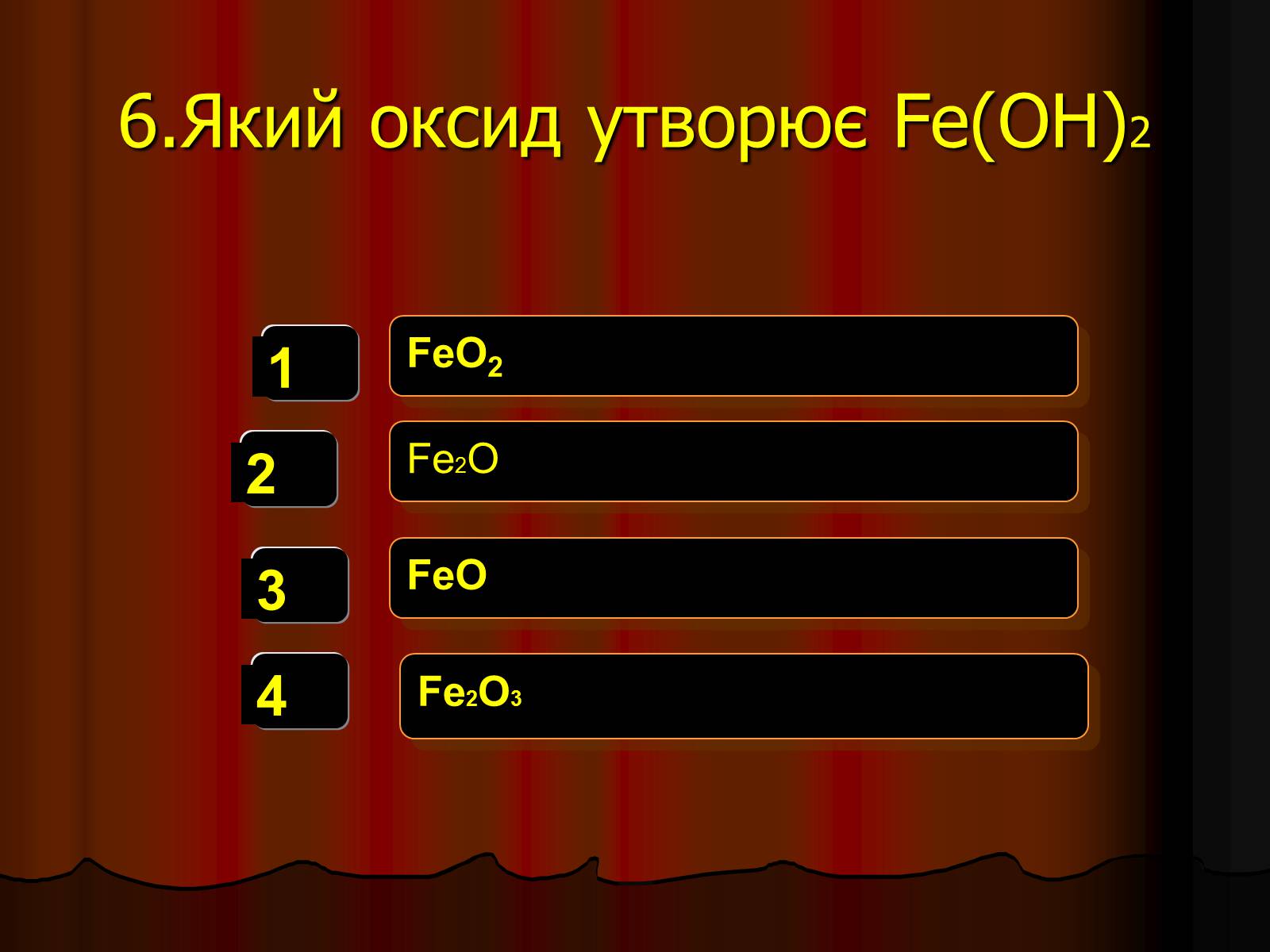
6.Який оксид утворює Fe(OH)2
1
2
3
4
FeO2
Fe2O
FeO
Fe2O3

7.Що таке “Їдкий натр”
1
2
3
4
NaO
Na2O
NaOH
Na(OH)2
)

8.Де застосовується Ca(OH)2 ?
1
2
3
4
Як миючий засіб
В будівництві
В металургії
У виробництві ліків

9.Чим луги відрізняються від основ?
1
2
3
4
їдкі
Роблять опіки
мильні
Не розчинні

10.Чого не повинно бути у миючих засобах?
1
2
3
4
лугів
кислот
фосфатів
нітратів
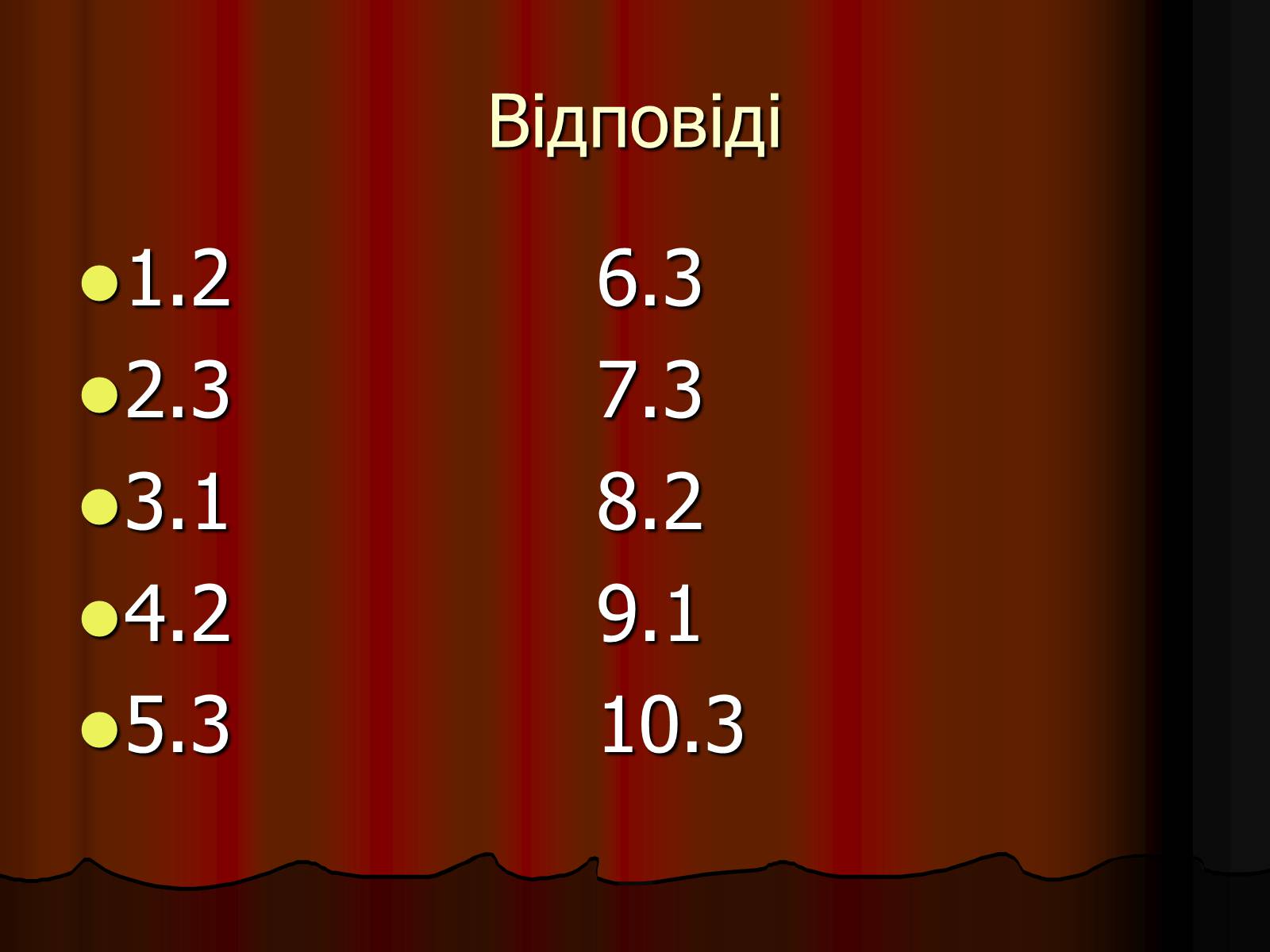
Відповіді
1.2 6.3
2.3 7.3
3.1 8.2
4.2 9.1
5.3 10.3

Кислоти
- це складні речовини, які складаються з одного або декількох атомів гідрогену та кислотного залишку
HxR

Кислоти утворюються з кислотних оксидів.
НеМеО +вода = кислота
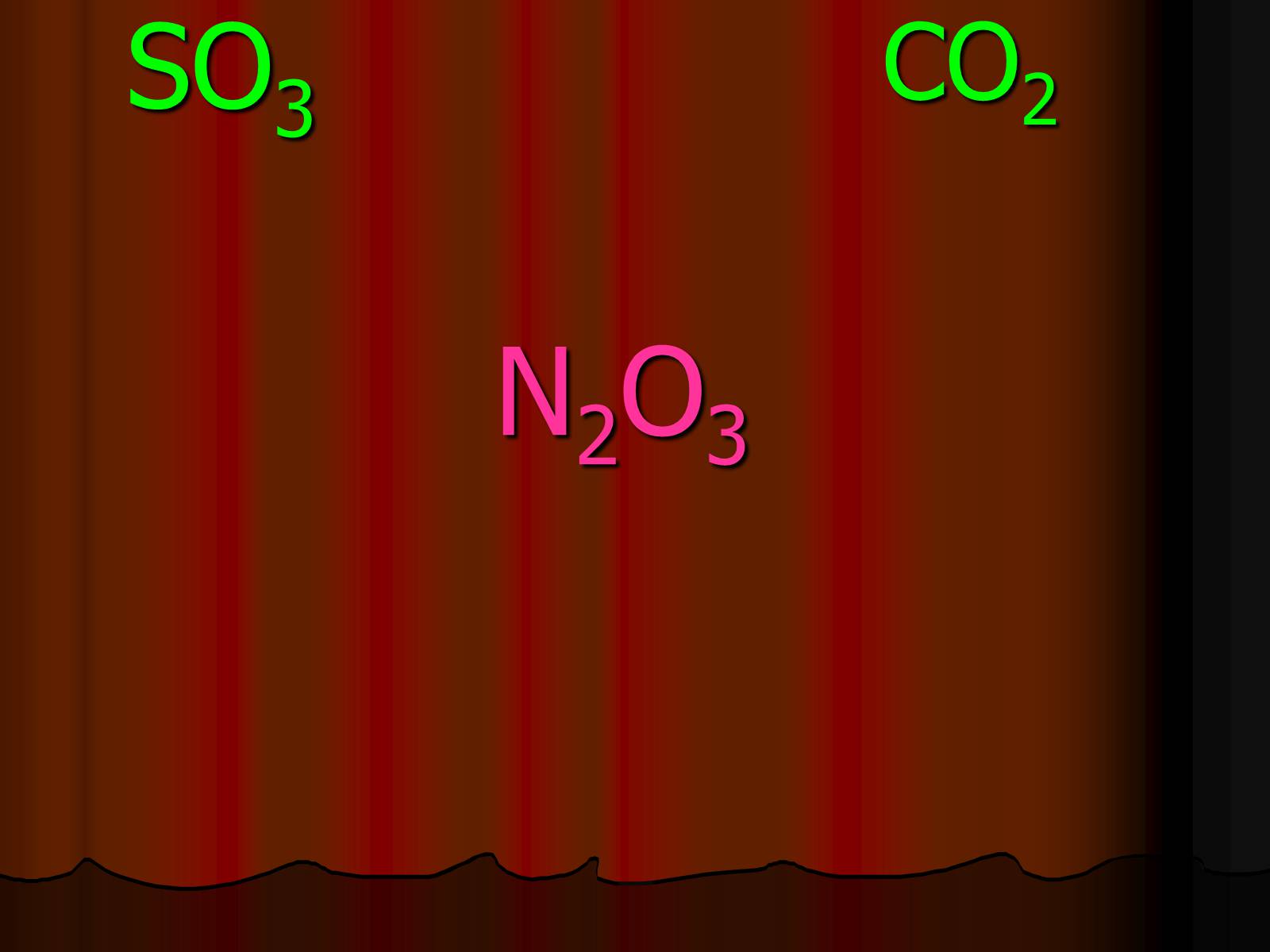
N2O3
SO3
CO2
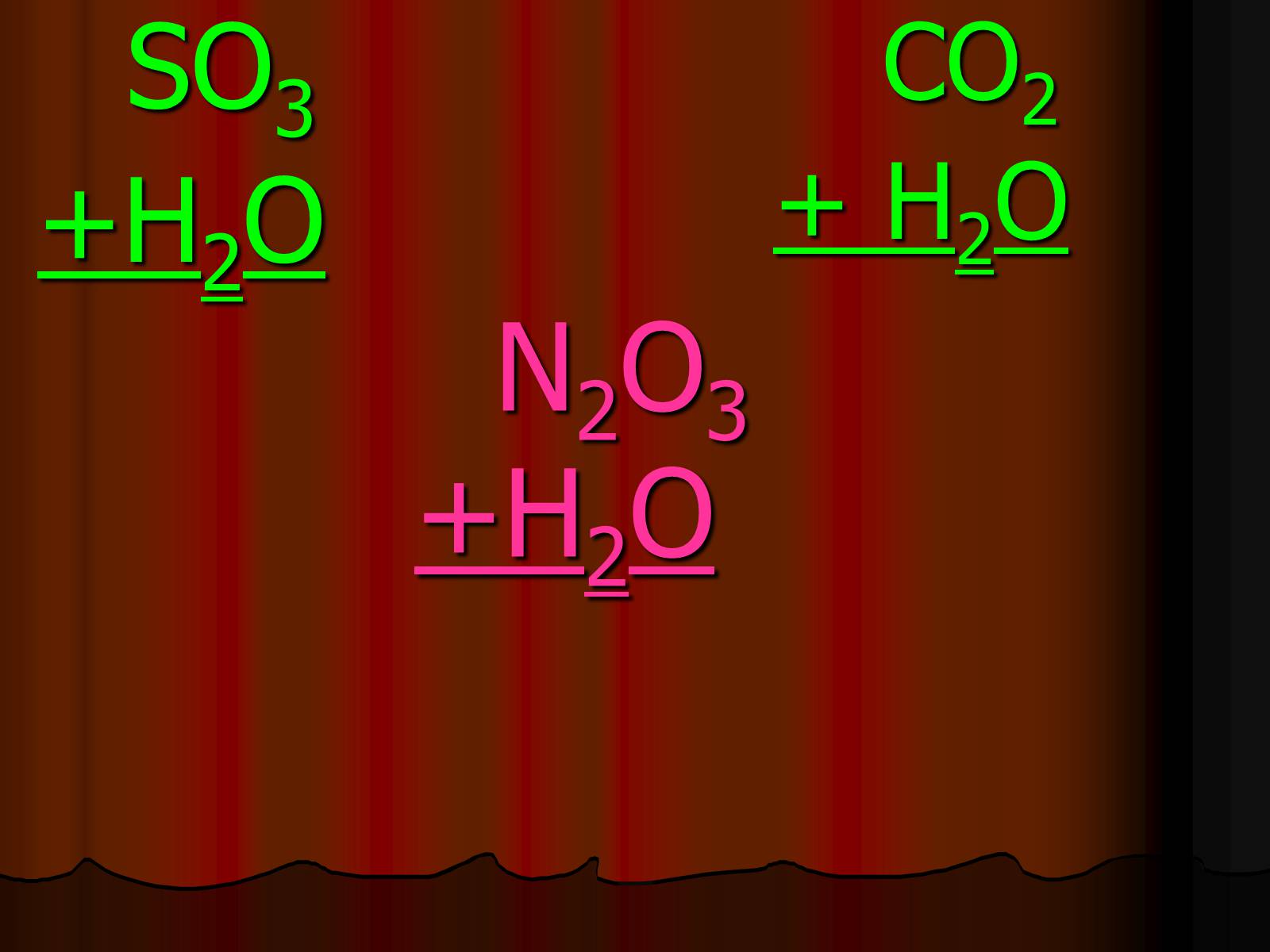
N2O3+H2O
SO3
+H2O
CO2
+ H2O
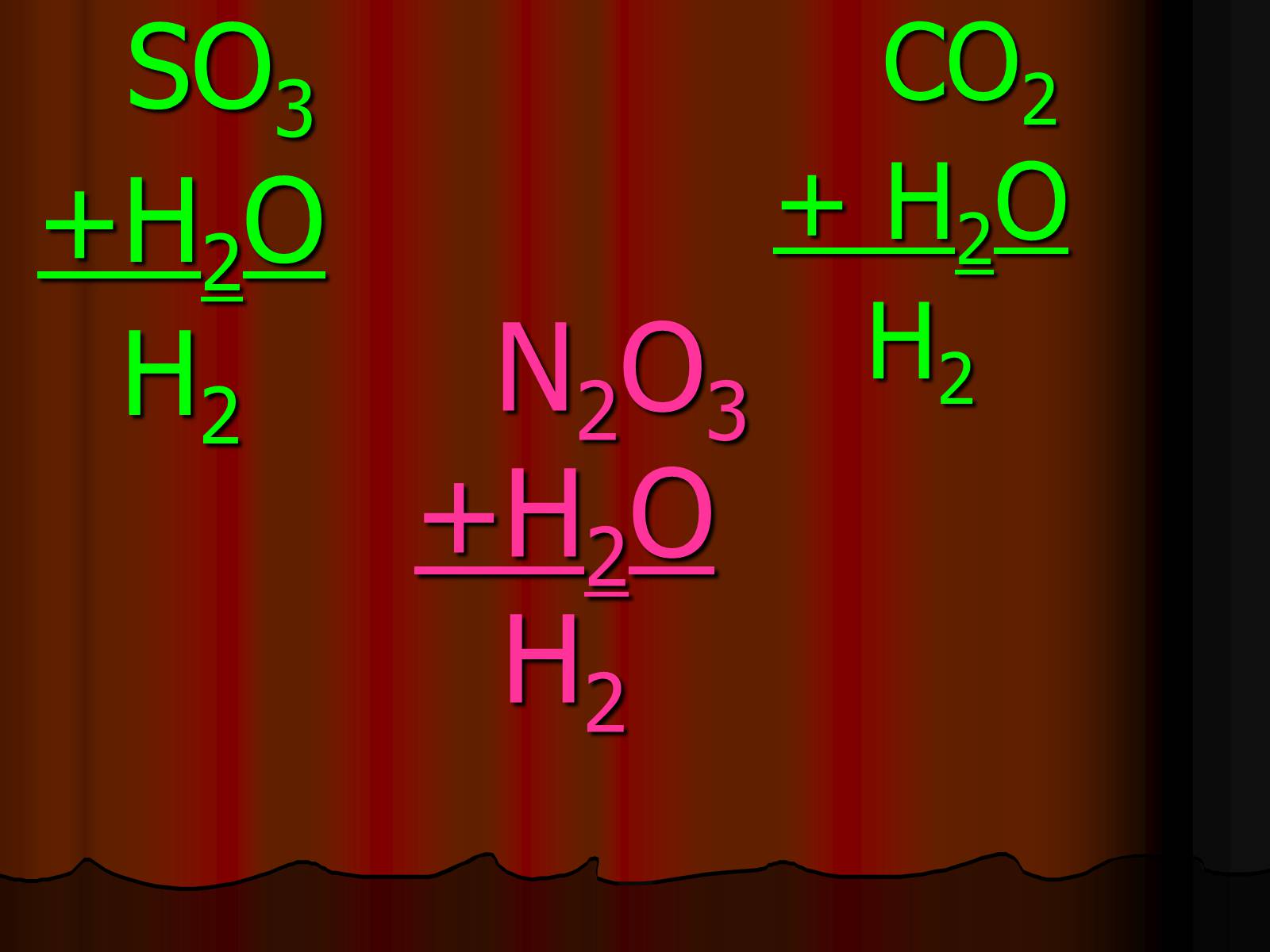
N2O3+H2OH2
SO3
+H2O
H2
CO2
+ H2O
H2
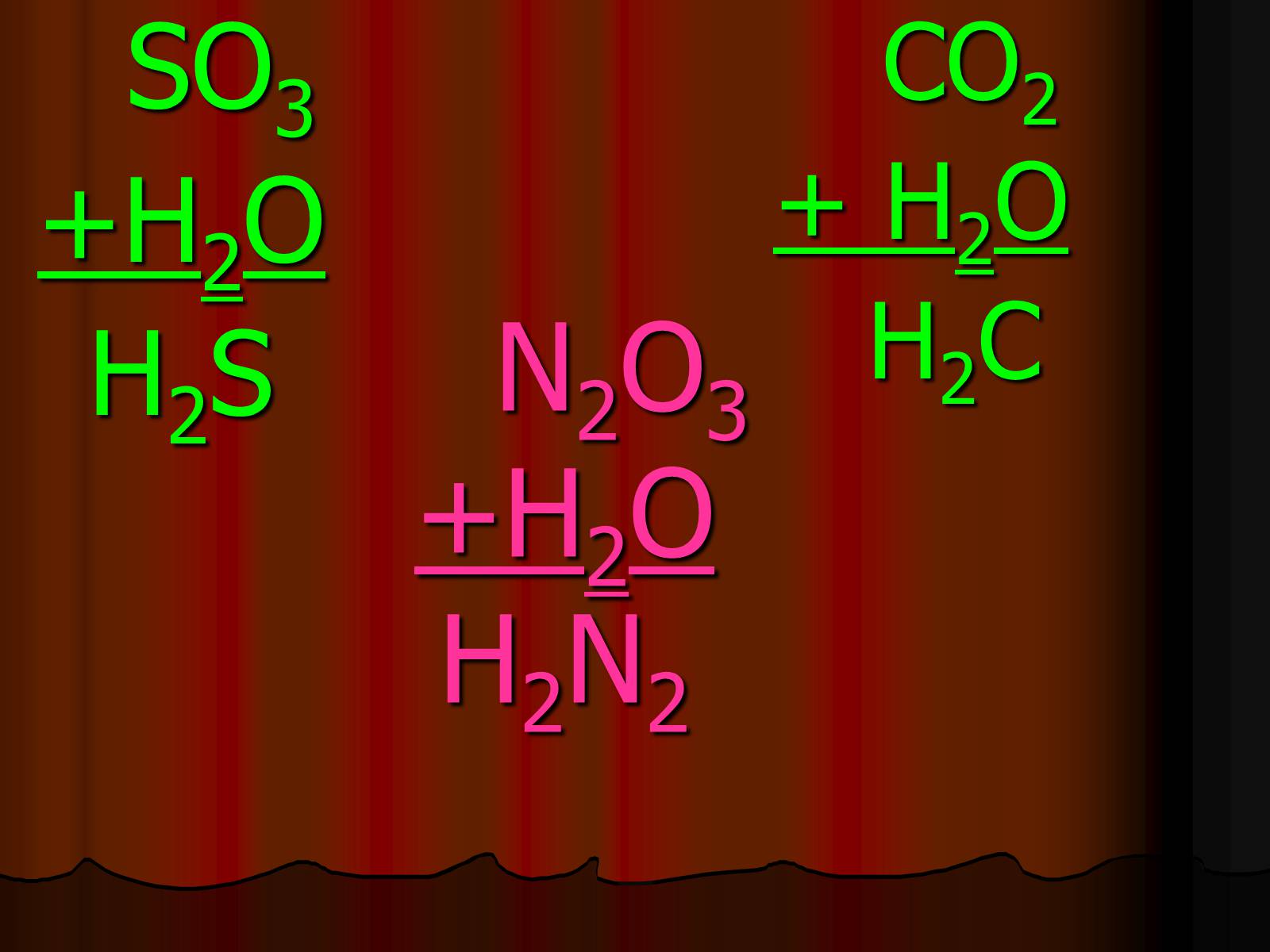
N2O3+H2OH2N2
SO3
+H2O
H2S
CO2
+ H2O
H2C
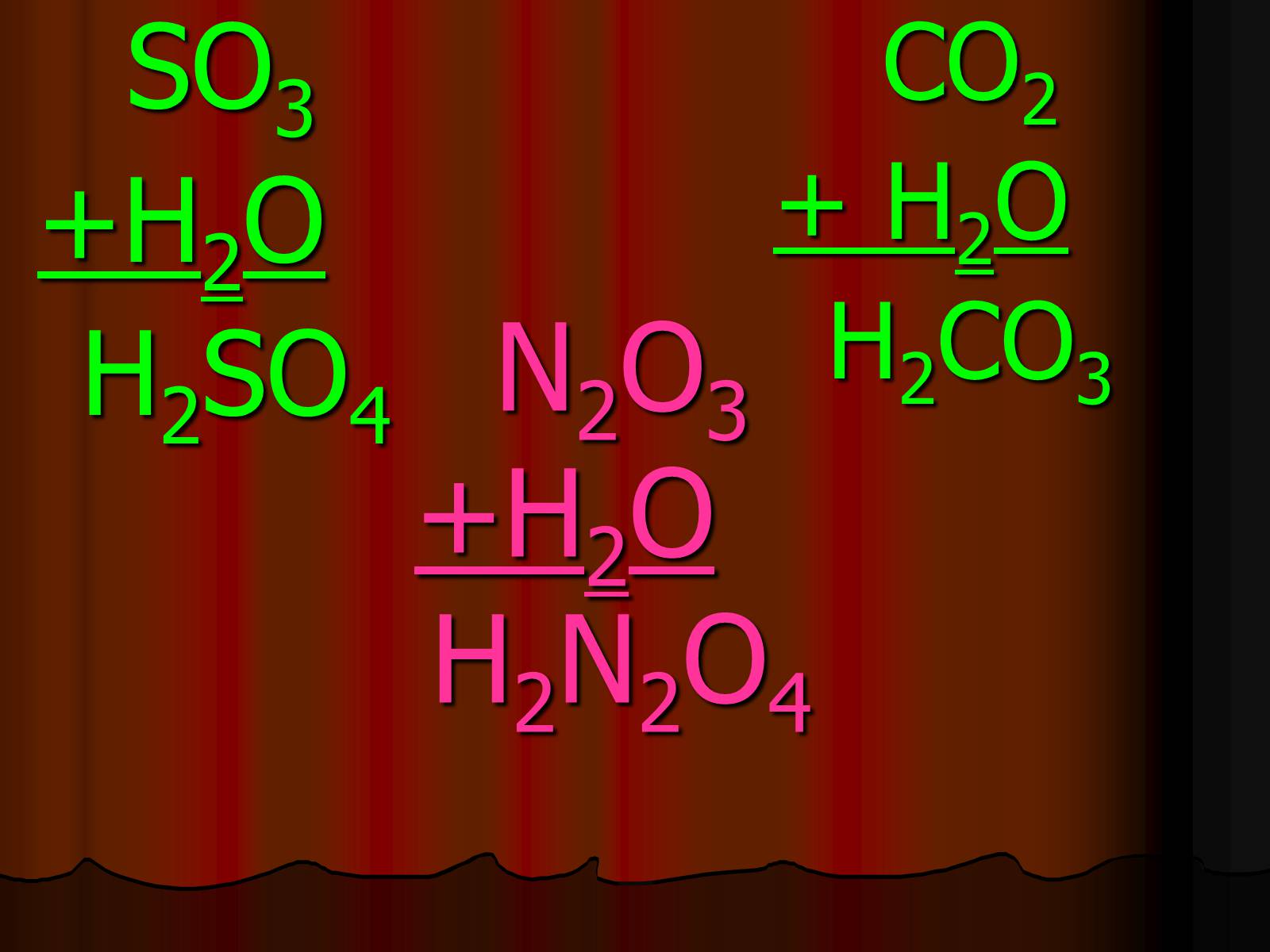
N2O3+H2O H2N2O4
SO3
+H2O
H2SO4
CO2
+ H2O
H2CO3
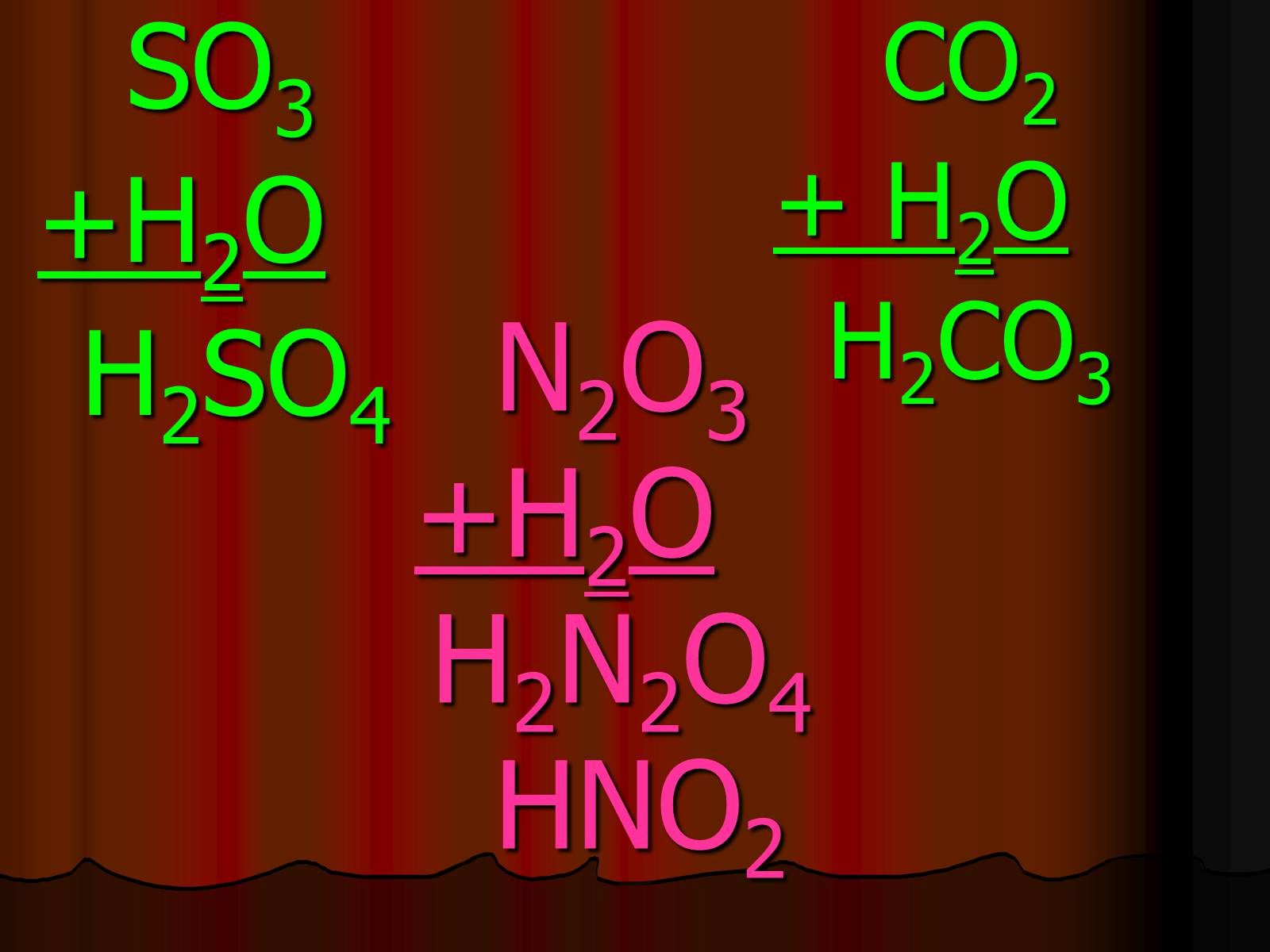
N2O3+H2O H2N2O4 HNO2
SO3
+H2O
H2SO4
CO2
+ H2O
H2CO3
HNO2
H2SO4
H2CO3
HNO2
H2SO4
H2CO3
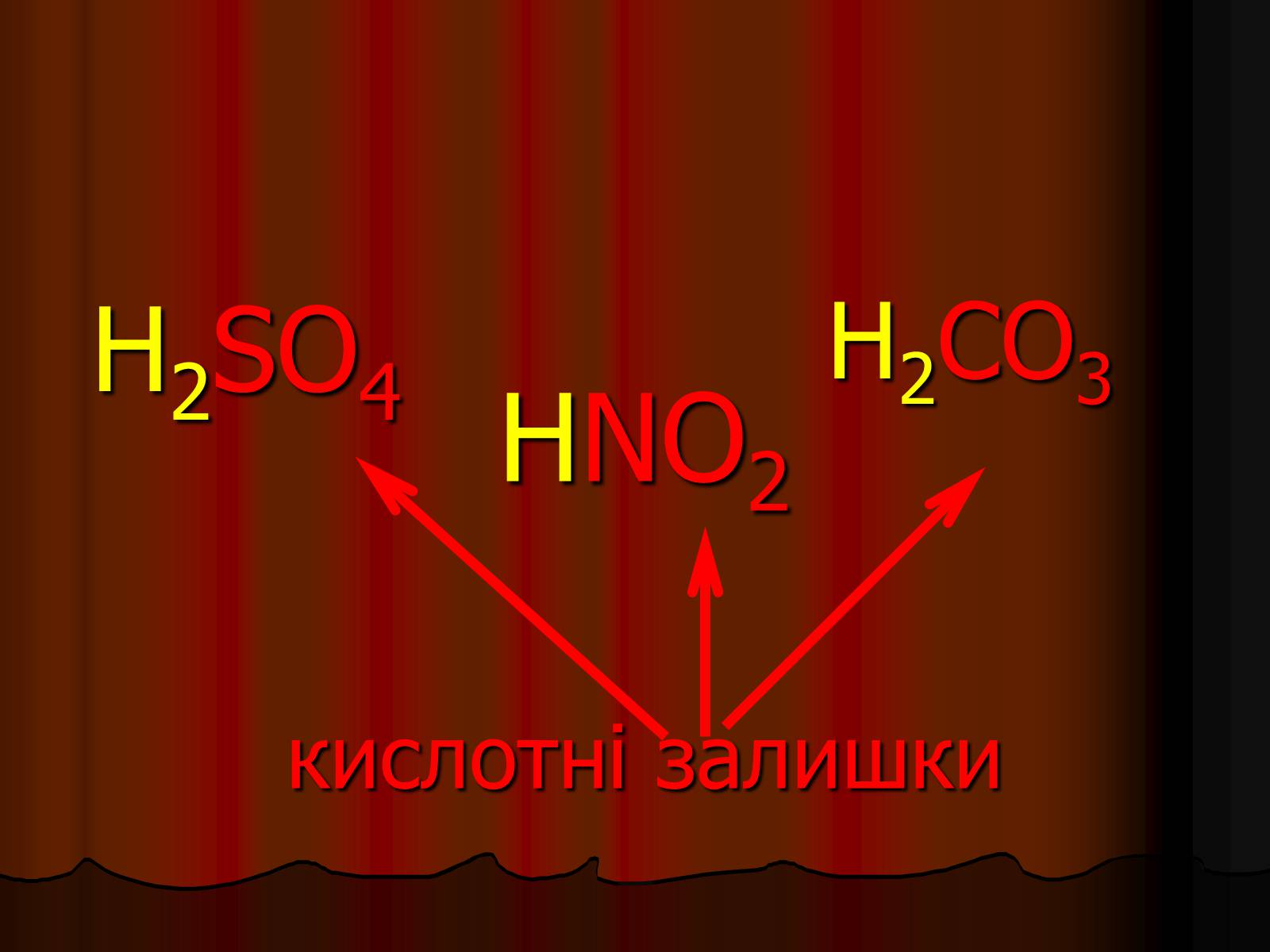
HNO2кислотні залишки
H2SO4
H2CO3
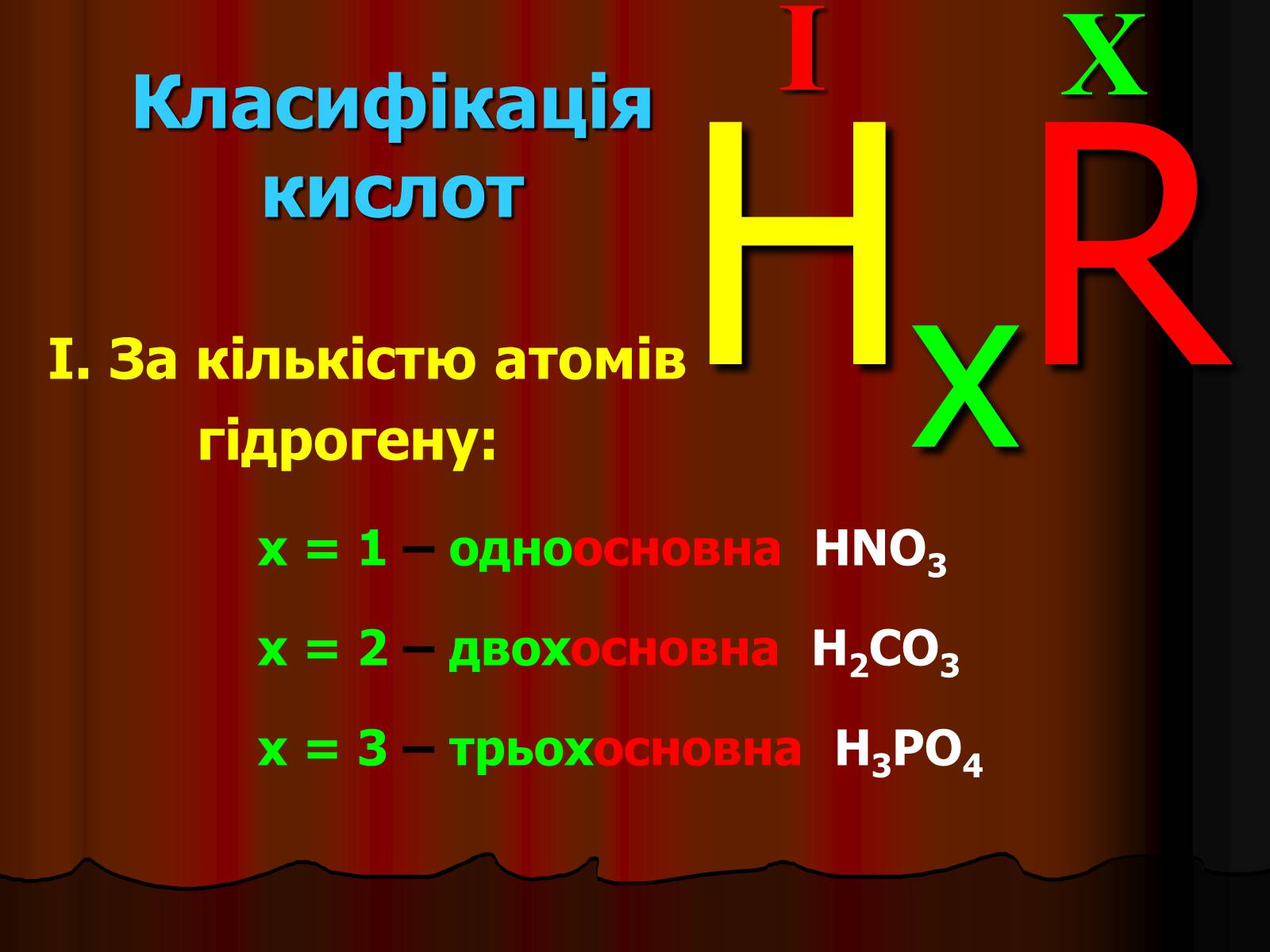
Класифікація кислот
I. За кількістю атомів
гідрогену:
X
I
HxR
x = 1 – одноосновна HNO3
x = 2 – двохосновна H2CO3
x = 3 – трьохосновна H3PO4
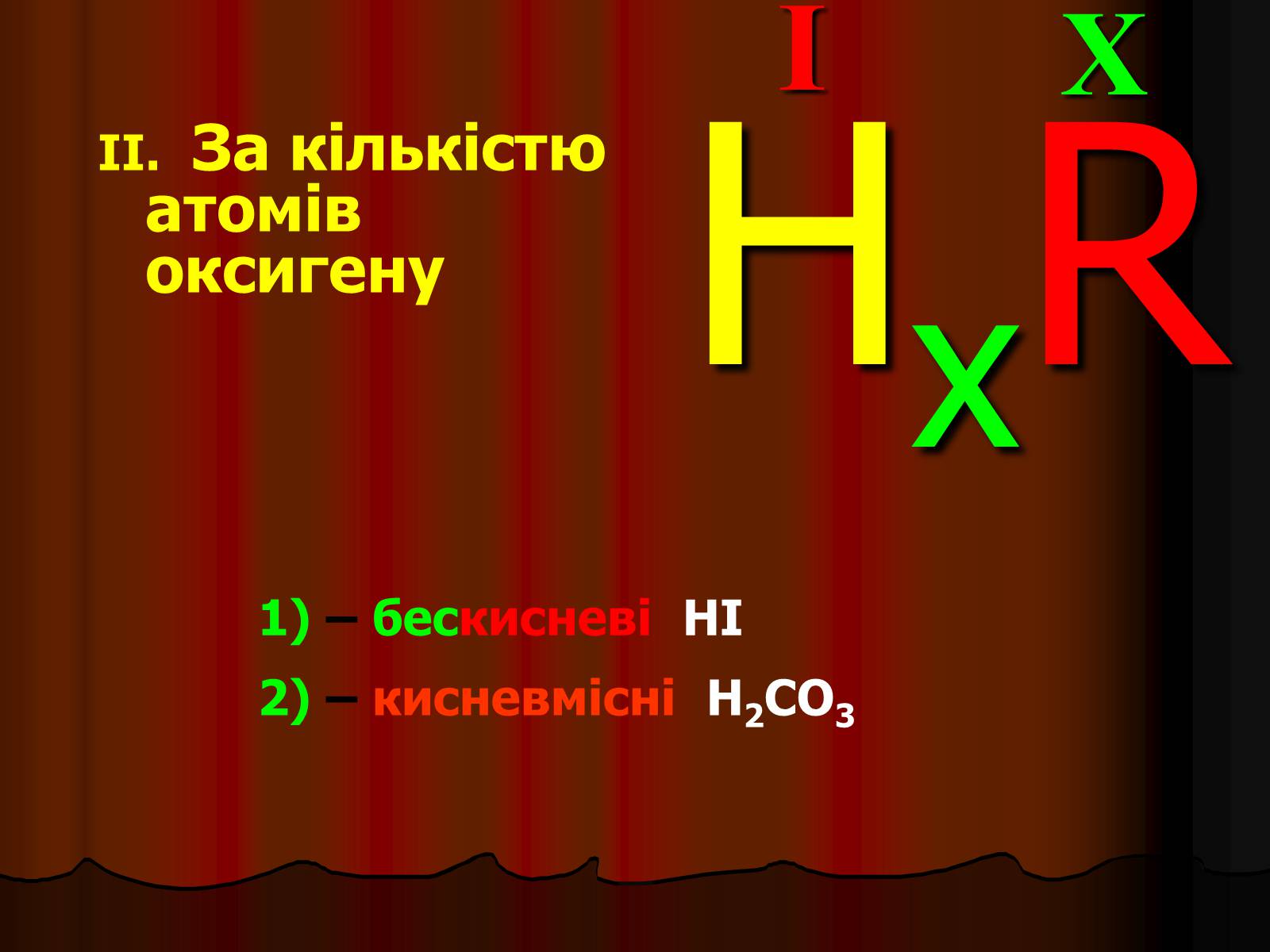
II. За кількістю атомів оксигену
X
I
HxR
1) – бескисневі HI
2) – кисневмісні H2CO3

X
I
HxR

Пікресліть кислотні залишки в молекулах кислот
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______ ________ _________ __________ _____
X
I
HxR
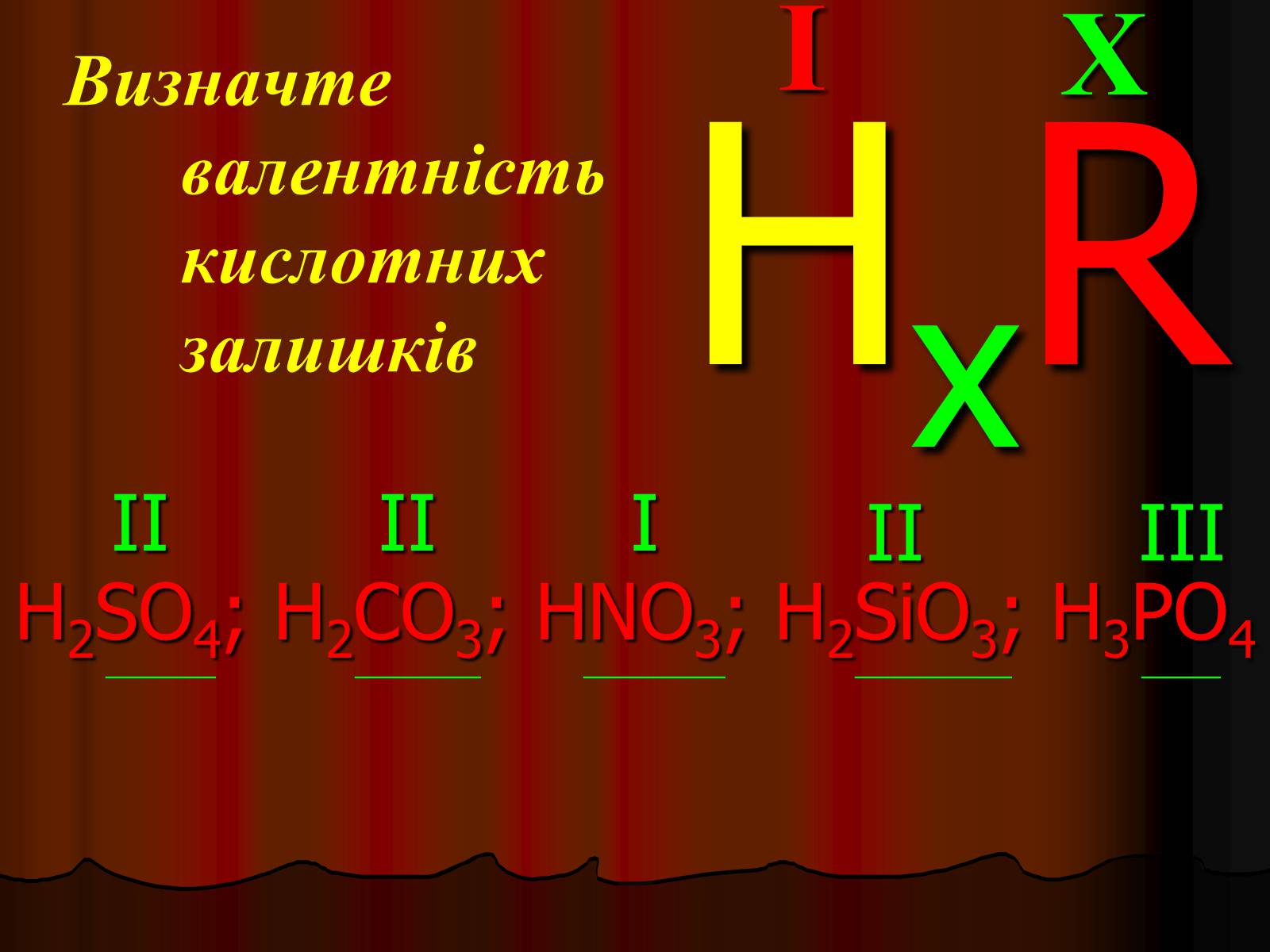
Визначте валентність кислотних залишків
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______ ________ _________ __________ _____
X
I
HxR
II
III
I
II
II

складіть формули кислот за кислотними залишками
Cl(I) →
S(II)→
PO4(III)→
SiO3(II)→
ClO4(I) →
MnO4(II) →
NO2(I)→
X
I
HxR
HCl
H2S
H3PO4
H2SiO3
HClO4
H2MnO4
HNO2

Завдання. Розподіліть кислоти за числом атомів гідрогену
H3PO4; HCl; H2S; HNO3; H2SO4: HBr; H2CO3; H2SO3; HClO4; H2SiO3.
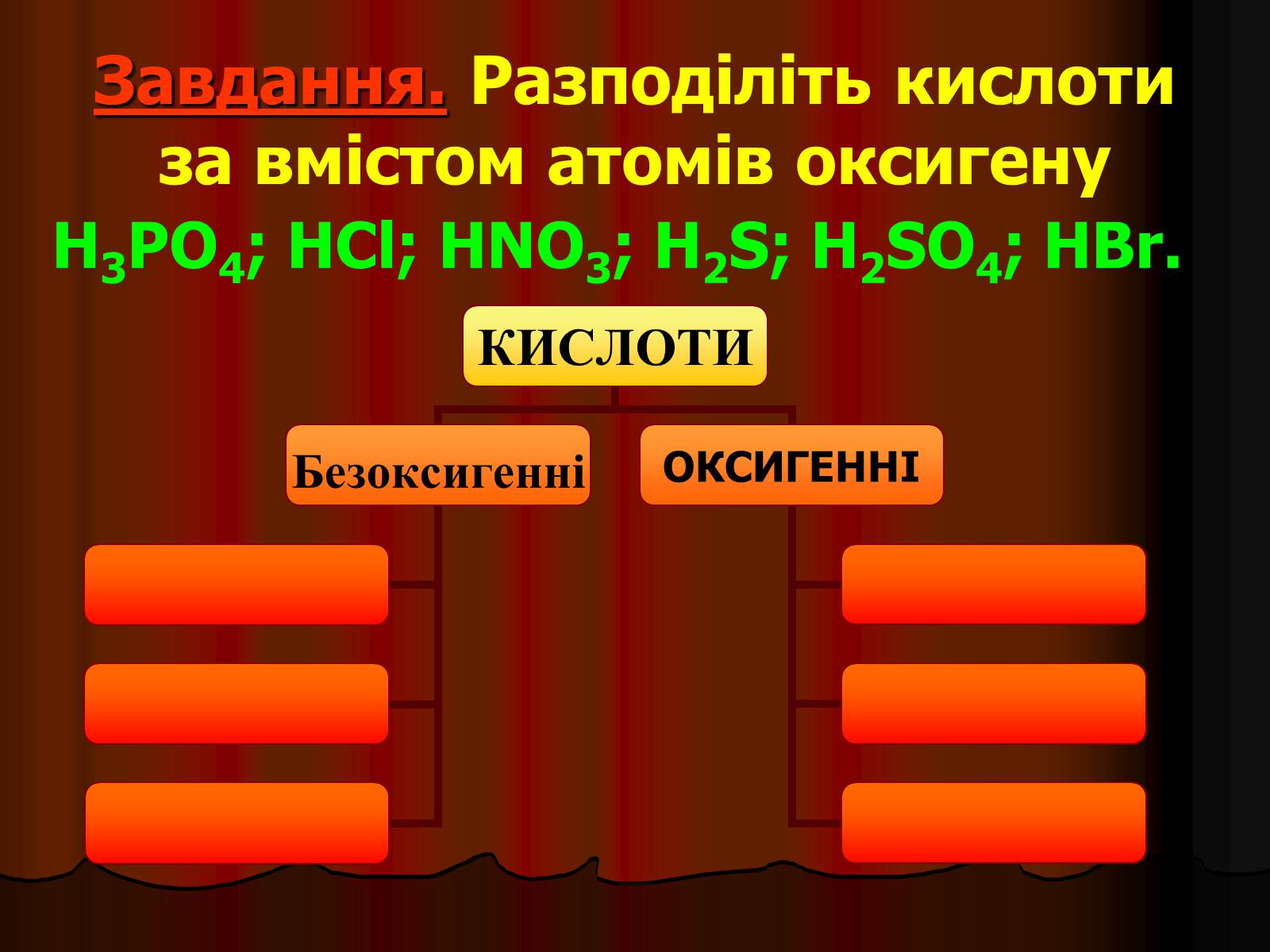
Завдання. Разподіліть кислоти за вмістом атомів оксигену
H3PO4; HCl; HNO3; H2S; H2SO4; HBr.

ФОРМУЛА КИСЛОТИ
НАЗВА КИСЛОТИ
HF
фторидна (плавикова)
HCl
хлоридна (соляна)
HBr
бромідна
HI
йодидна
H2S
сульфідна
Назви кислот.

HNO3
нітратна
H2SO3
сульфітна
H2SO4
сульфатна
H2CO3
карбонатна
H2SiO3
сілікатна
H3PO4
ортофосфатна

Фізичні властивості кислот
H2 CO3 = CO2↑ +H2O – карбонатна кислота H2SO3 = SO2↑ + H2O – сульфітна кислота у вільному вигляді не існують, розпадаються на газ та воду.
HCl -хлоридна кислота H2SO4 -сульфатна кислота рідкі
HNO3 -нітратна кислота
H2SiO3 - сілікатна кислота драглиста

Хімічні властивості кислот

Індикатори
речовини, які змінюють колір в залежності від середовища розчину
Лакмус
Метилоранж
Фенолфталеин
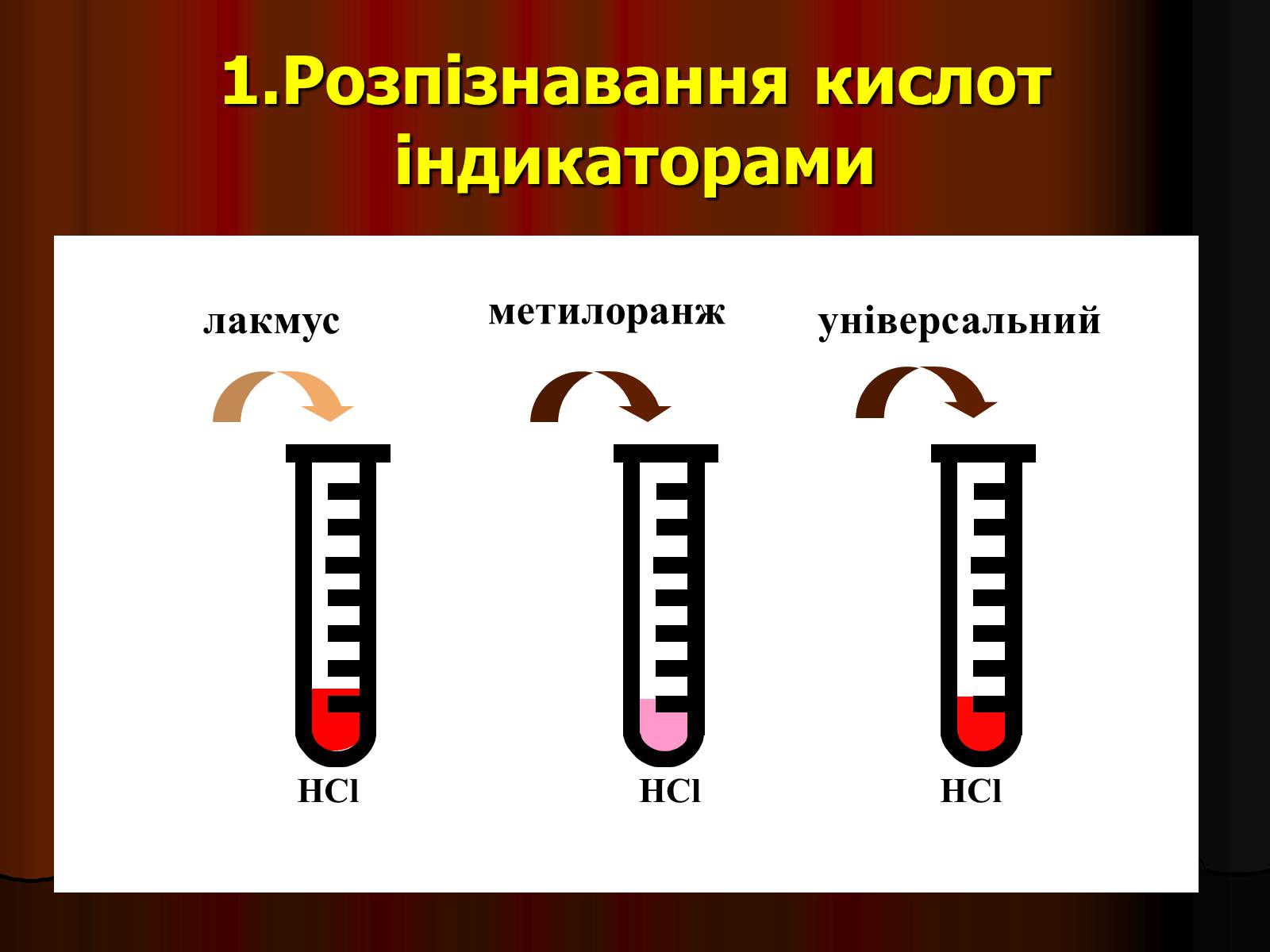
1.Розпізнавання кислот індикаторами
лакмус
метилоранж
універсальний
HCl
HCl
HCl
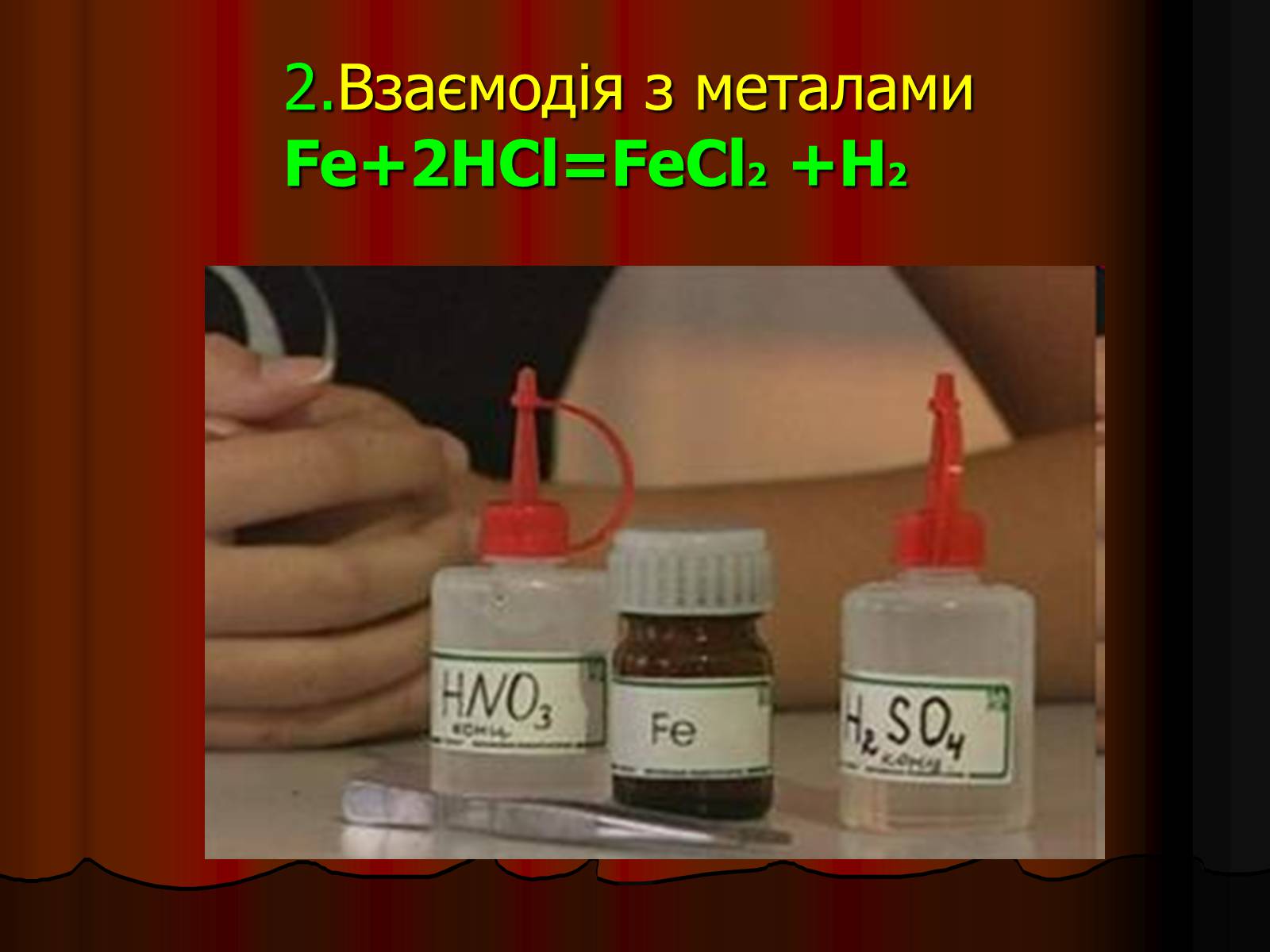
2.Взаємодія з металамиFe+2HCl=FeCl2 +H2

3. Взаємодія з оксидами металів
CuO+2HCl= CuCl2+H2O

4.Взаємодія з основами(реакція нейтралізації)
HCl+KOH=KCl+H2O

5. Взаємодія кислот з солямиNa2CO3+H2SO4=Na2SO4+H2O+CO2
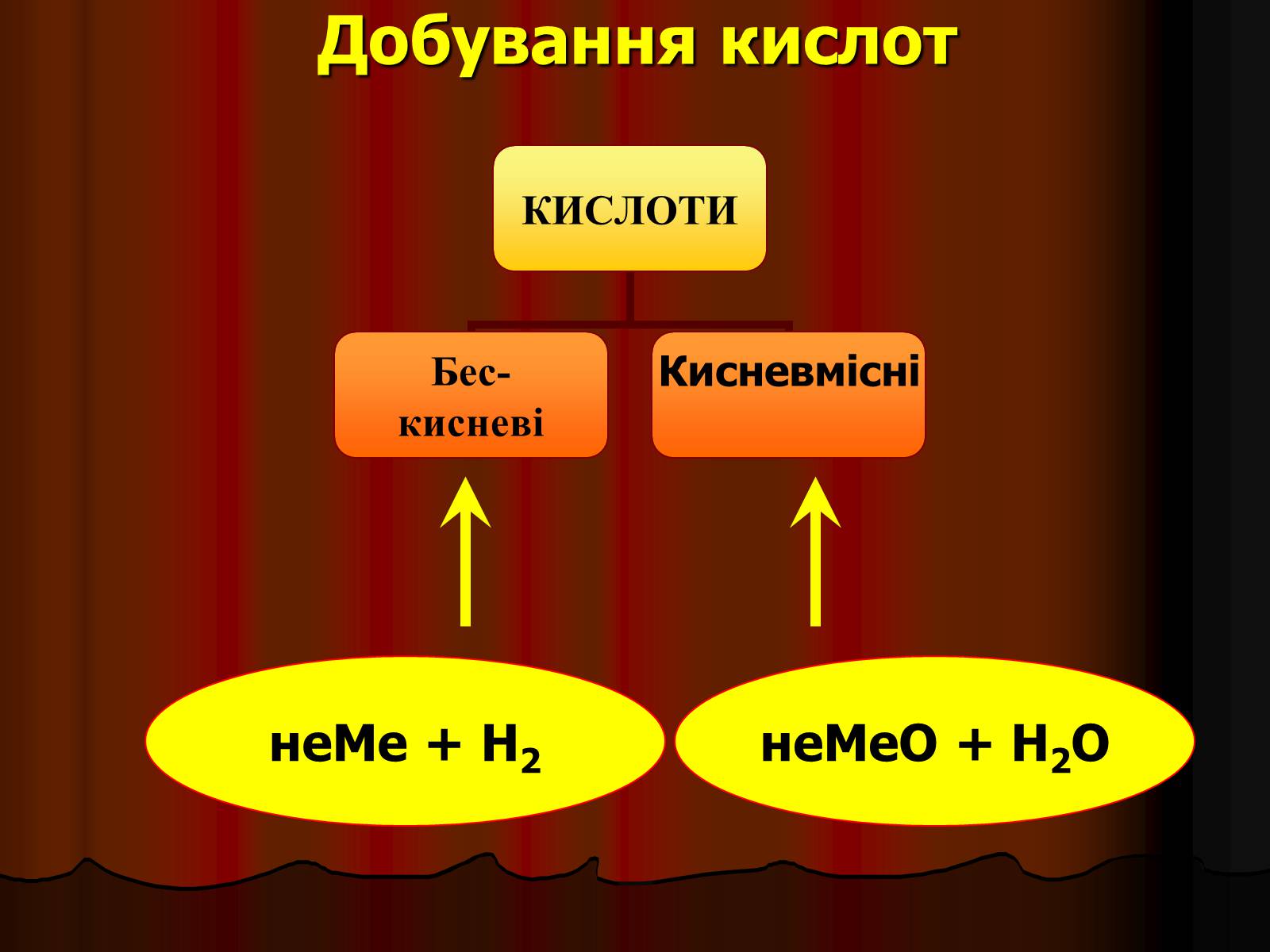
Добування кислот
неМе + Н2
неМеО + Н2О

Хлоридна кислота знаходиться у шлунку, допомога перетравлювати їжу.
Молочна кислота утворюється у м'язах при физичному навантаженні.
КИСЛОТИ МІСТЯТЬСЯ В ОРГАНІЗМАХ ТВАРИН

КИСЛОТИ В МЕДИЦИНІ
Аскорбінова,
ацетилсаліцилова
Та ін.

КИСЛОТИ В ХАРЧОВІЙ ПРОМИСЛОВОСТІ
Оцтова, лимонна
Та ін.

Поводження з кислотами
Опік кислотою

Що запам'ятав?

Що мене здивувало?

Про що я довідався вперше?

1. Де написані тільки кислоти:
а) NH3 HCl H2 SO4 б) H2S HNO3 HBr в) HCl KCl H3PO4
Закріплення
2. Яка речовина лишня:
а) HCl H2SO4 K2O
б) HNO3 H2O H2CO3
в) H2S H2SO4 NaOH

CuO, NaOH, H3PO4, CO2, CaCO3, HCl, Cu(OH)2, HNO3, BaO, H2S, K2SO3, H2SO4, Al(OH)3, AgNO3, H2CO3, NaSiO3, SO3, Al2(SO4)3
Виберіть кислоти;
Прокласифікуйте їх
Визначте валентність кислотних залишків
Домашнє завдання
§ 34, 36