Презентація на тему «Химические свойства и применение алкенов»

Химические свойства и применение алкенов
«Границ научному познанию и предсказанию предвидеть не возможно»
Д. И. Менделеев

Химические свойства алкенов
ПрисоединениеtГидрированиеtГалогенированиеtГидрогалогенированиеtГидратация
Полимеризация
Окисление
Горение
Каталитическое окисление
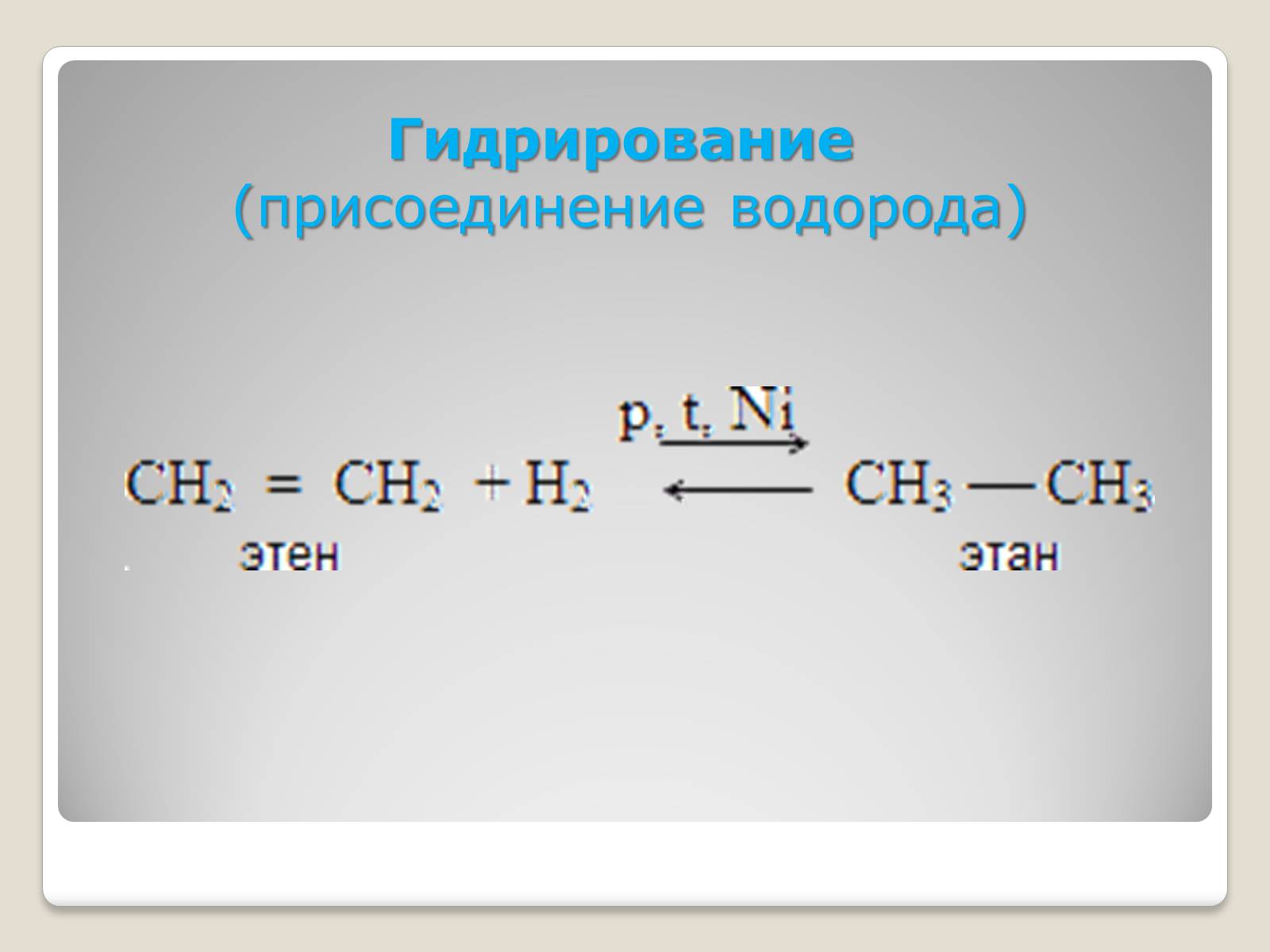
Гидрирование
(присоединение водорода)

Гидрогалогенирование
(присоединение галогеноводородов)

Галогенирование
(присоединение хлора, брома)
При использовании раствора брома в воде (бромной воды), имеющей желтовато-коричневую окраску, происходит ее обесцвечивание, что вы и наблюдали в ранее проведенном опыте.
В случае гомологов этилена важно выполнять условия проведения реакции галогенирования.
Например, при обычной температуре пропен вступает в реакцию присоединения хлора:
А при t 500oС идет замещение атомов водорода в метильной группе на атомы хлора:

Рассмотрим механизм электрофильного присоединениябромоводорода к этену.
Реакция начинается с процесса диссоциации бромоводорода:
HBr → H+ + Br–
Катион водорода H+ атакует π-связь (как бы натыкается на выступающую из плоскости молекулы электронную плотность π-связи) и присоединяется к ней, образуя π-комплекс:
CH2 = CH2 + H+ → CH2 CH2
За счет π-электронной пары происходит образование ковалентной связи протона H+ с одним из атомов углерода по донорно-акцепторному механизму:
CH2 CH2 → +CH2 – CH3
Образовавшийся карбкатион +CH2 – CH3 присоединяет анион Br– :
+CH2 – CH3 + Br– → CH2Br – CH3
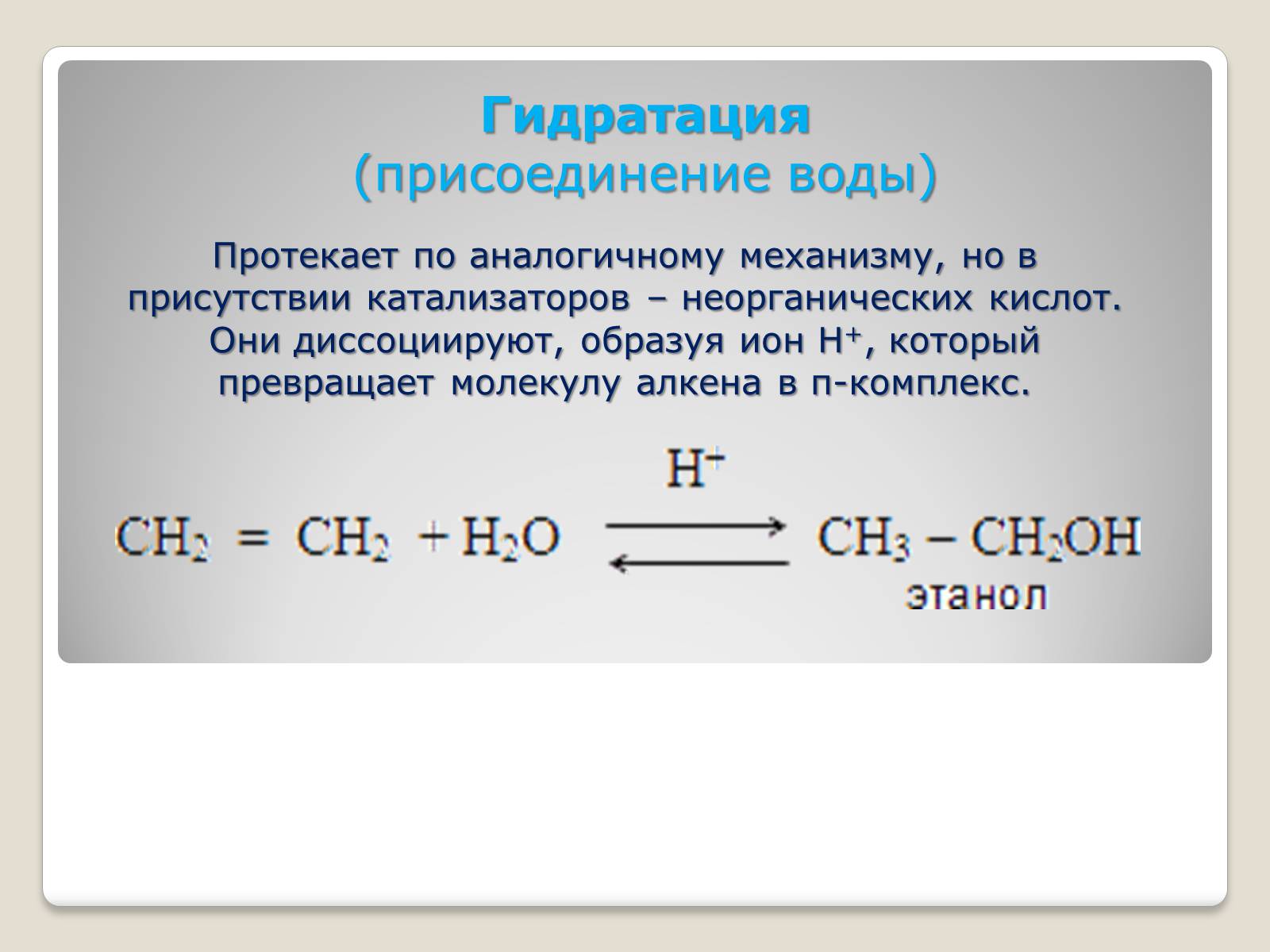
Гидратация
(присоединение воды)
Протекает по аналогичному механизму, но в присутствии катализаторов – неорганических кислот. Они диссоциируют, образуя ион Н+, который превращает молекулу алкена в π-комплекс.
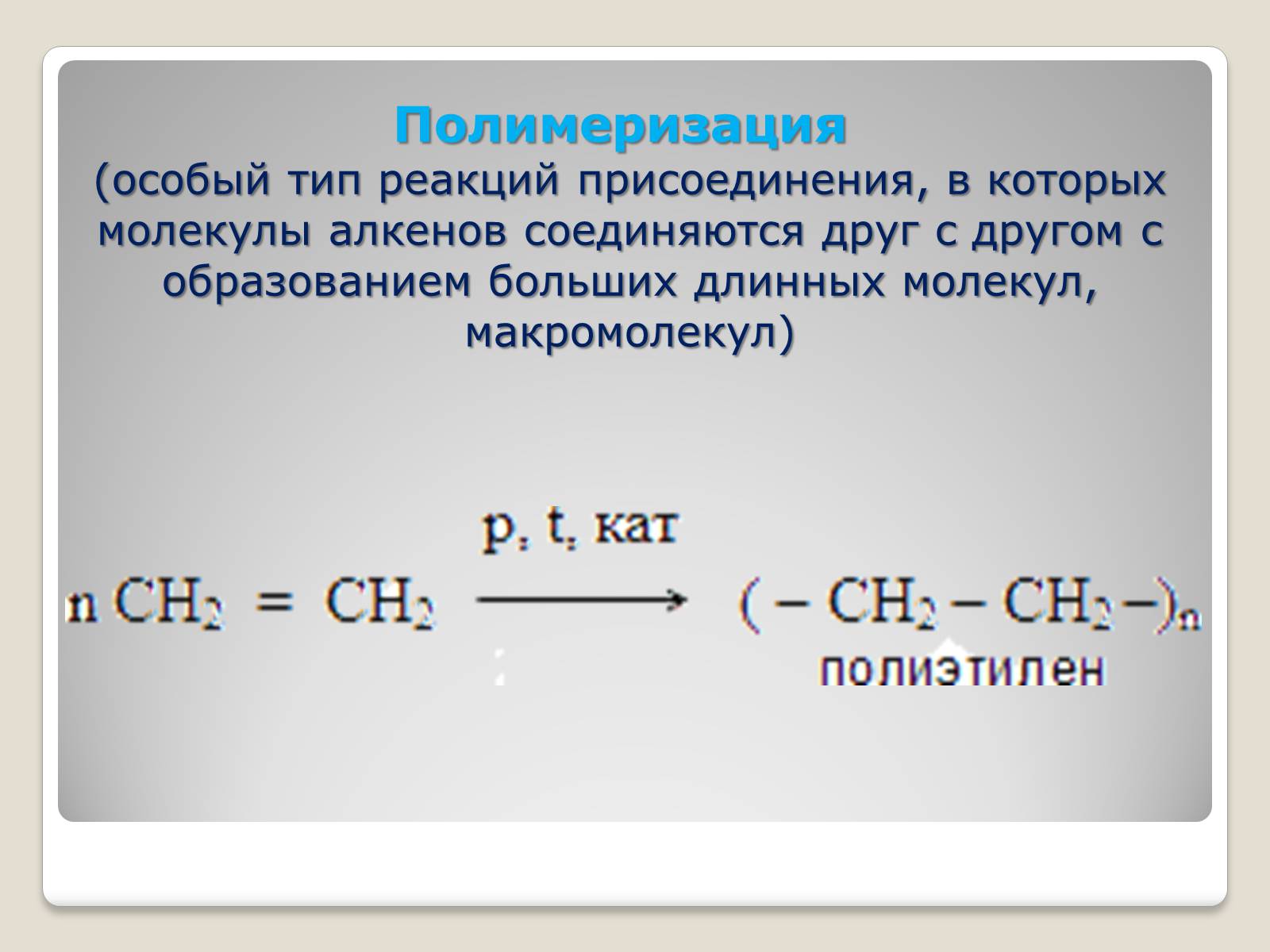
Полимеризация
(особый тип реакций присоединения, в которых молекулы алкенов соединяются друг с другом с образованием больших длинных молекул, макромолекул)

Горение
Поскольку элементный состав алкенов тот же, что и у предельных углеводородов, то они имеют общее свойство – горючесть. При поджигании алкены горят.
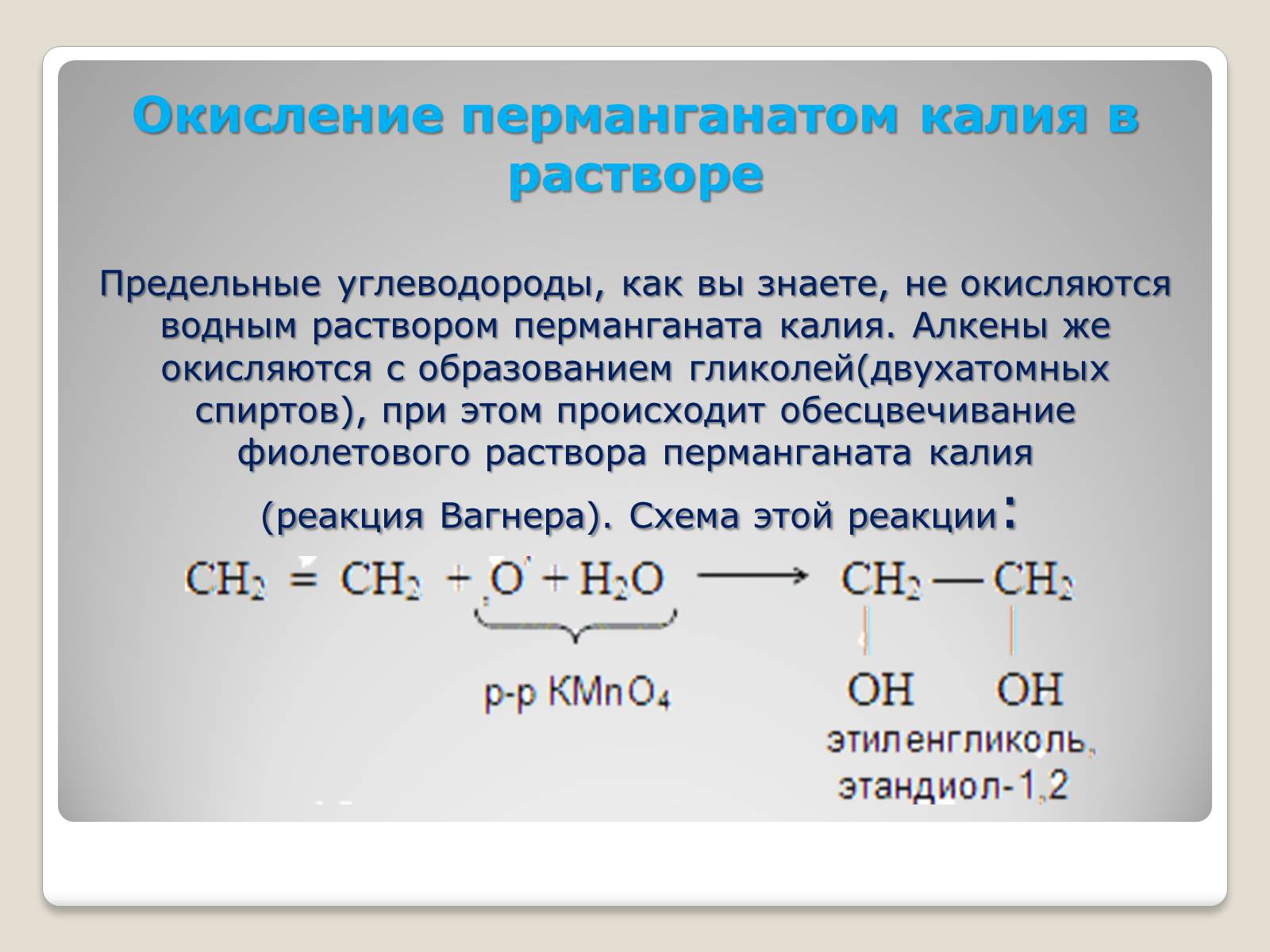
Окисление перманганатом калия в растворе
Предельные углеводороды, как вы знаете, не окисляются водным раствором перманганата калия. Алкены же окисляются с образованием гликолей(двухатомных спиртов), при этом происходит обесцвечивание фиолетового раствора перманганата калия
(реакция Вагнера). Схема этой реакции:
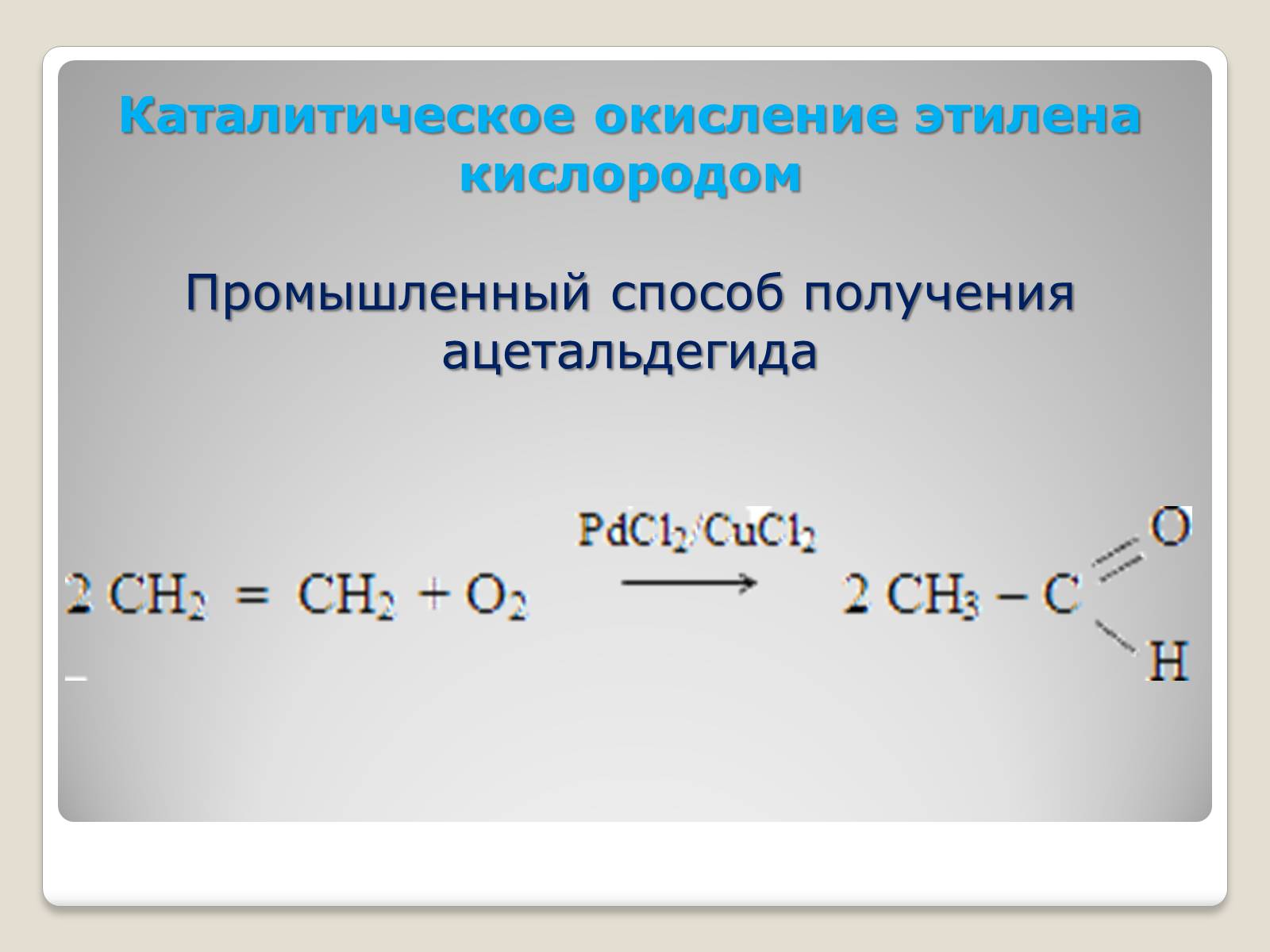
Каталитическое окисление этилена кислородом
Промышленный способ получения ацетальдегида
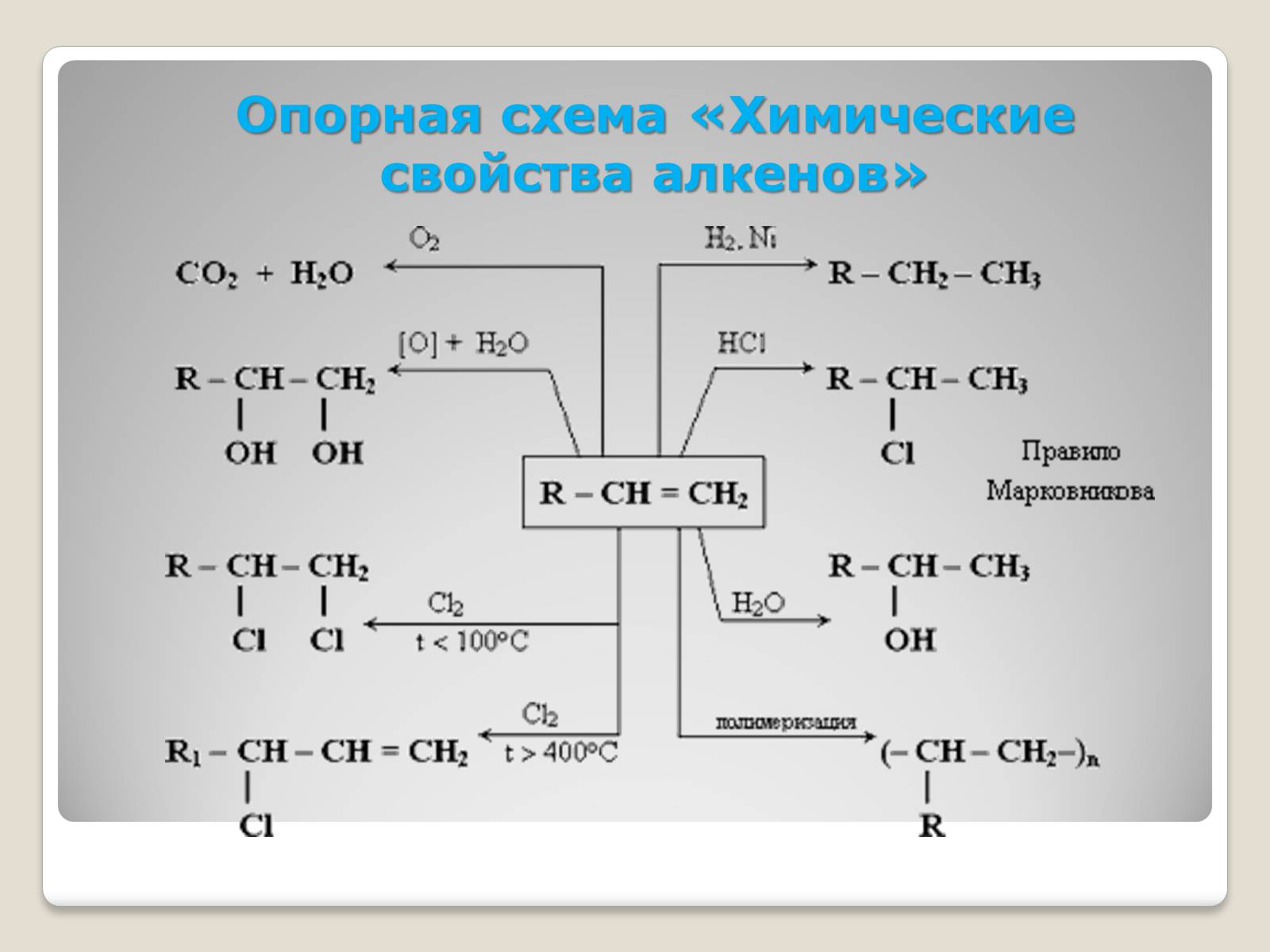
Опорная схема «Химические свойства алкенов»

Применение алкенов
Изучая химические свойства алкенов, вы, очевидно, поняли, что благодаря высокой реакционной способности они являются ценным сырьем для химической промышленности. На их основе получают сотни практически важных продуктов и материалов.

Выполнил:Строкань Владислав 11-В

Литература:
http://alhimikov.net/organikbook/alcen_01.html
http://old.internet-school.ru/demo/530384?page=1
http://ru.wikipedia.org/wiki/%D0%90%D0%BB%D0%BA%D0%B5%D0%BD%D1%8B
http://images.yandex.ua/?uinfo=ww-1263-wh-917-fw-0-fh-598-pd-1