Презентація на тему «Фосфор» (варіант 3)

Фосфор
Підготувала:
Ліцеїстка II курсу
Біолого – хімічного профілю
Нетішинського НВК
Пацаловська Лілія

Основні відомості
Фосфор (від грец. Phosphoros - світлоносний ; лат. Phosphorus) P, хімічний елемент V групи періодичної системи.
Відомо 10 модифікацій фосфору, з них найважливіші - білий , червоний і чорний фосфор (технічний білий фосфор називають жовтим фосфором ).
Один з найпоширеніших елементів земної кори: 0,08-0,09% її маси. Концентрація у морській воді 0,07 мг/л.
У вільному стані не зустрічається через високу хімічну активність.
Утворює близько 190 мінералів, найважливішими з яких є апатит Ca5(PO4)3(F, Cl, OH), фосфорит та інші.

Алотропні модифікації
Білий фосфор - м'яка, безбарвна кристалічна речовина, схожа на віск.
Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули P4. Летка, легкоплавка речовина, має характерний запах часнику.
Не розчиняється у воді, але добре розчиняється у сірковуглеці CS2 і бензині. Легкозаймиста речовина, тому зберігають її під водою.
Білий фосфор у темряві на повітрі світиться зеленкувато-жовтим світлом. Це явище називається люмінесценція. Воно спричиняється повільним окисненням білого фосфору. Білий фосфор - надзвичайно отруйна речовина, навіть у малих дозах. 50 мг білого фосфору - смертельні!
При тривалому слабкому нагріванні білий фосфор переходить у червоний.

Алотропні модифікації
Червоний фосфор - порошок червоно-бурого кольору, неотруйний. Має атомні кристалічні ґратки. Не розчиняється у воді і сірковуглеці.
Без запаху, у темряві не світиться.
Встановлено, що червоний фосфор є сумішшю кількох алотропних модифікацій, які відрізняються одна від одної кольором - від яскраво-червоного до фіолетового.
Червоний фосфор легко вбирає вологу, тобто є гігроскопічним.
При нагріванні без доступу повітря випаровується, а при охолодженні його пара перетворюється на білий фосфор.

Алотропні модифікації
Чорний фосфор - речовина, схожа на графіт, масна на дотик, має металічний блиск, не отруйний, виявляє властивості напівпровідників.
Добувають чорний фосфор тривалим нагріванням білого фосфору під великим тиском.
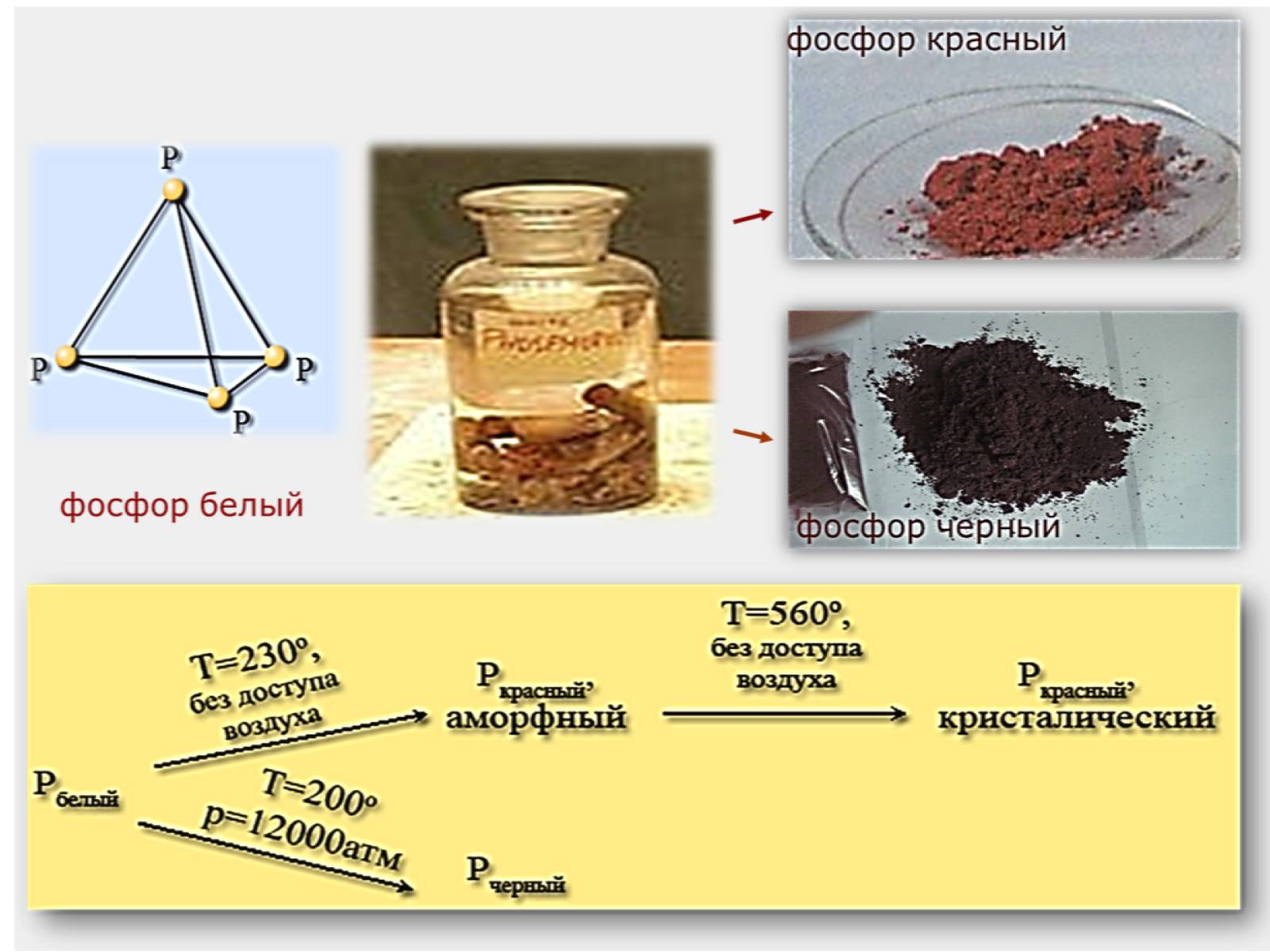
Алотропні модифікації
Чорний фосфор - речовина, схожа на графіт, масна на дотик, має металічний блиск, не отруйний, виявляє властивості напівпровідників.
Добувають чорний фосфор тривалим нагріванням білого фосфору під великим тиском.

Фосфор
p
31
+15
2
8
5
P = 15
e = 15
N = 16
−
1s²
2p⁶
3p
3
2s²
3s²
3d

Характеристика
1.
Відкрито у 1669 році Хеннінгом Брандтом.
2.
У Періодичній системі знаходиться в 3 періоді, V група, головна підгрупа.
3.
У природі зустрічається тільки у зв'язаному стані.
4.
Утворює кілька простих речовин, які помітно різняться за властивостями: білий, червоний, чорний фосфор.
5.
Найнижчий ступінь окислення –3, найвищий ступінь окислення +5.

Поширення у природі
Фосфати
Фосфорити

Застосування фосфору
Для виробництва добрив та миючих засобів
Червоний фосфор:
у виробництві сірників
Білий фосфор
як димоутворювальний і запальний засіб
Чорний фосфор
в металургії

Фізичні властивості
Білий фосфор
біла речовина (через домішки може мати жовтуватий відтінок)
легко ріжеться ножем і деформується від невеликих зусиль
має молекулярну будову, формула P 4.
легкорозчинний в органічних розчинниках щільність становить близько 1823 кг / м .
плавиться при 44,1 C.
надзвичайно активний.
отруйний (викликає ураження кісток, кісткового мозку, некроз щелеп, летальна доза білого фосфору для дорослого чоловіка становить 0,05-0,1 м.
Жовтий фосфор
вогненебезпечна кристалічна речовина від світло-жовтого до темно-бурого кольору.
плавиться при +34 C, кипить при +280 C.
у воді не розчиняється, на повітрі легко окислюється і займається
горить сліпучим яскраво-зеленим полум'ям з виділенням густого білого

Фізичні властивості
Червоний фосфор
більш термодинамічно стабільна модифікація елементарного фосфору
має формулу Р n і являє собою полімер зі складною структурою
має відтінки від пурпурно-червоного до фіолетового, а в литому стані - темно-фіолетовий з мідним відтінком металевий блиск
малорозчинний
на повітрі не самозаймається, аж до температури 240-250 С (при переході в білу форму під час сублімації)
розчиняється у воді, а також в бензолі, сірковуглеці й інших
щільність досягає 2400 кг / м
Чорний фосфор
найменш активна форма
має високу (2690 кг / м ) щільність
чорна речовина з металевим блиском, жирна на дотик і дуже схоже на графіт, і з повністю відсутньою розчинністю у воді або органічних розчинниках
проводить електричний струм і має властивості напівпровідника
температура плавлення чорного фосфору 1000 С

Добування
Вільний фосфор отримують з природних фосфатів, прожарюючи їх з коксом і піском:
Ca3(PO4)2 +3SiO2 +5C = 2P +3CaSiO3 +5CO

Хімічні властивості
Для фосфору характерні відновні властивості, які він виявляє у реакціях з неметалами:
4P+3O2 (нестача) = 2P2O3
4P+5O2 (надлишок) = 2P2O5
2P+5Cl2 (надлишок) = 2PCl5
В реакціях з активними металами фосфор виступає в ролі окисника:
3Mg+2P = Mg3P.

Хімічні властивості
Суміш червоного фосфору з бертолетовою сіллю КСl03 займається з вибухом навіть від найменшого тертя або натискання:Суміш червоного фосфору з бертолетовою сіллю КСl03 займається з вибухом навіть від найменшого тертя або натискання:
10KClO3 + 12P(черв.) = 10KCl + 3P4O10
До молекул оксиду вмить приєднуються молекули води й утворюється метафосфорна кислота:
P2O5+H2O=2HPO3

Хімічні властивості
Фосфор реагує з деякими неметалами-окисниками, при цьому можуть утворюватися похідні Фосфору з різним ступенем окиснення:
2P + 3S = P2S3
2P + 5S = P2S5
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
Фосфор вступає у взаємодію з багатьма активними металами:
3Ca + 2P = Ca3P2
Відходи фосфору знищують за допомогою розчину купрум(ІІ) сульфату:
2P + 5CuSO4 + 8H2O = 2H3PO4 + 5Cu + 5H2SO4
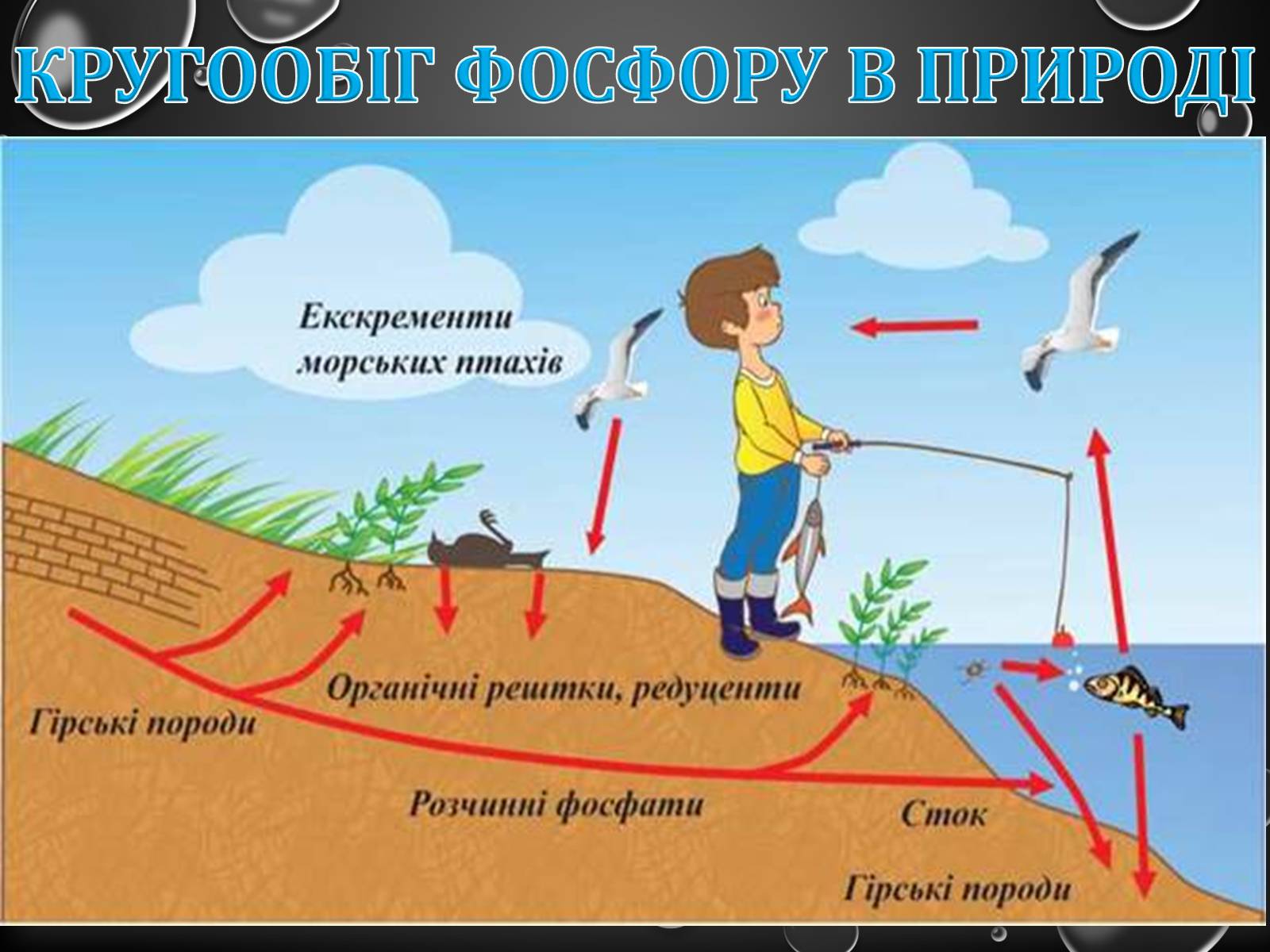
Кругообіг фосфору в природі
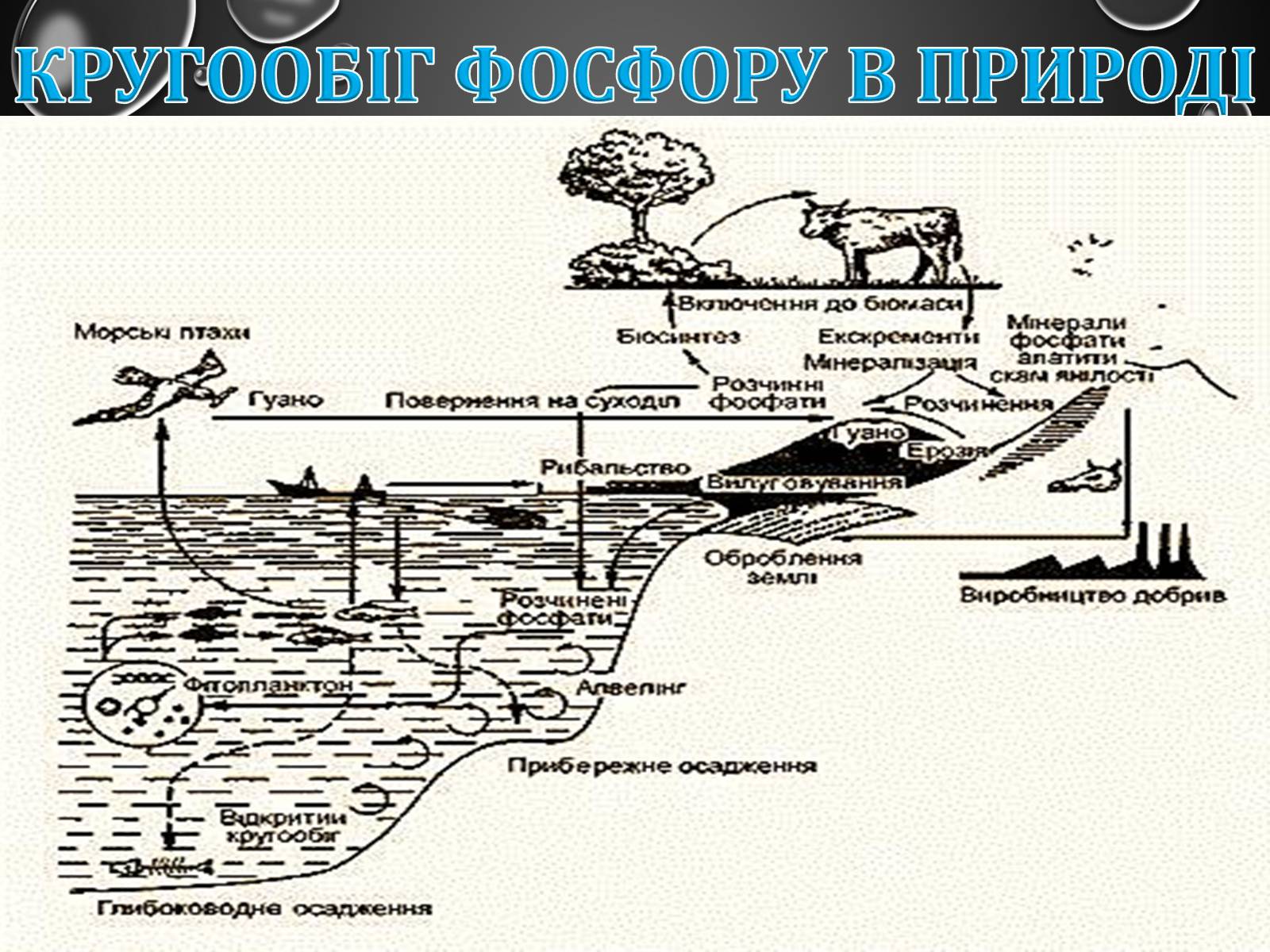
Кругообіг фосфору в природі