Презентація на тему «Фенол» (варіант 1)

Презентация на тему:Фенол
Выполнила ученица 11-б класса:
Зануда Татьяна
Проверила: учитель химии:
Тисленко.Л.А

ФЕНОЛ
Понятие о фенолах
Физические свойства фенола – простейшего представителя из фенолов
Состав и структура фенола
Физиологическое действие фенола на живые организмы
Электронное строение фенола
Химические свойства фенола
7. Применение фенола
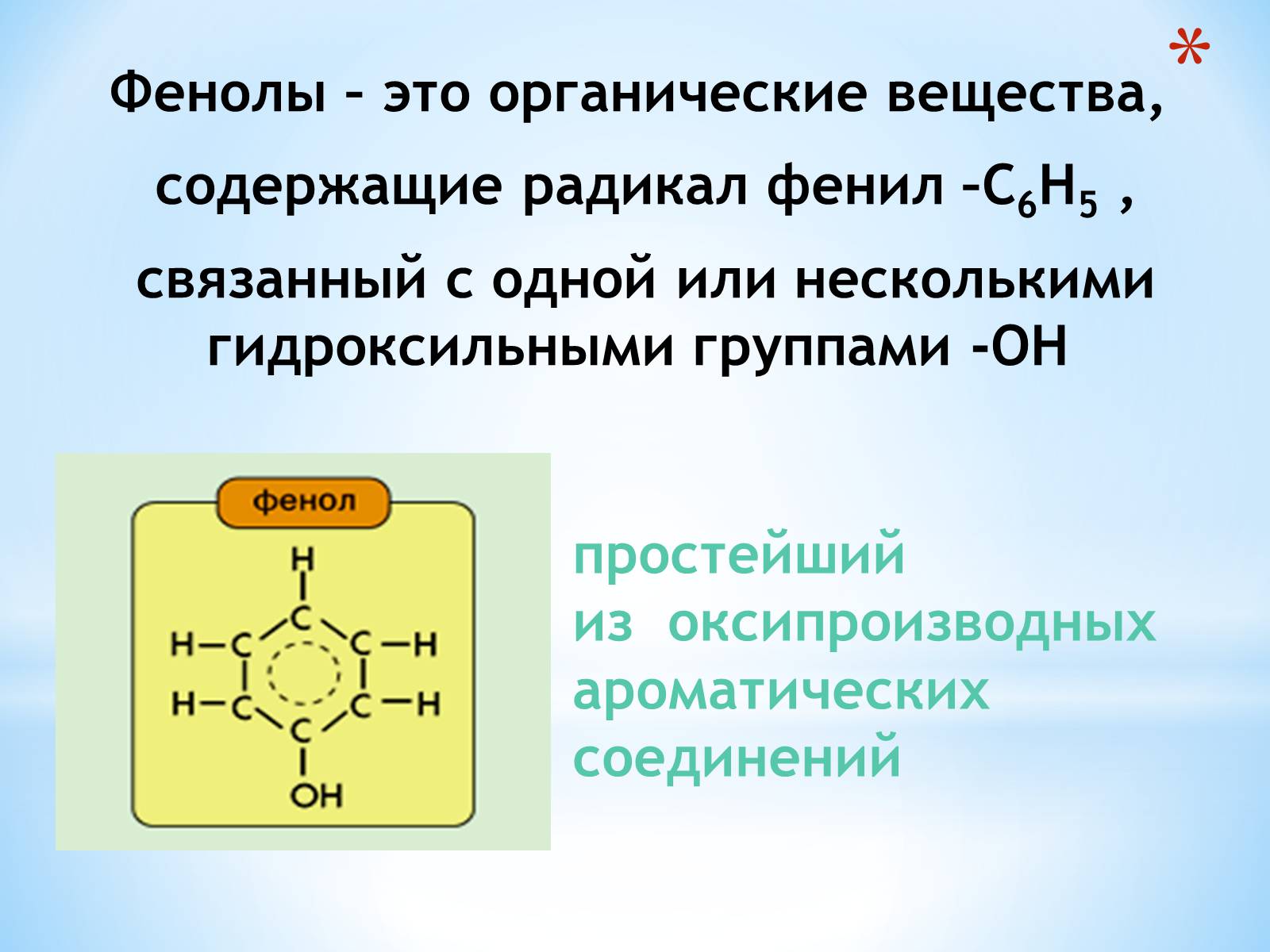
Фенолы – это органические вещества,
содержащие радикал фенил –C6H5 ,
связанный с одной или несколькими
гидроксильными группами -OH
простейший
из oксипроизводных
aроматических
соединений

Фенол
монооксибензол,
карболовая кислота
-бесцветные кристаллы
-с характерным запахом
-розовеющие при хранении
-умеренно растворим в воде
-хорошо - в спирте, эфире, ацетоне
Фенол ядовит !!!
вызывает нарушение функций н.с.
пыль, пары и раствор фенола раздражают слизистые оболочки глаз,
дыхательных путей, кожу
C6H5OH-физические свойства

Бесцветное кристаллическое вещество с характерным запахом.
tпл = 41ºС , tкип = 182 ºС
При хранении приобретает розоватый оттенок.
В холодной воде плохо растворим, но при нагревании до 70 ºС растворяется полностью.
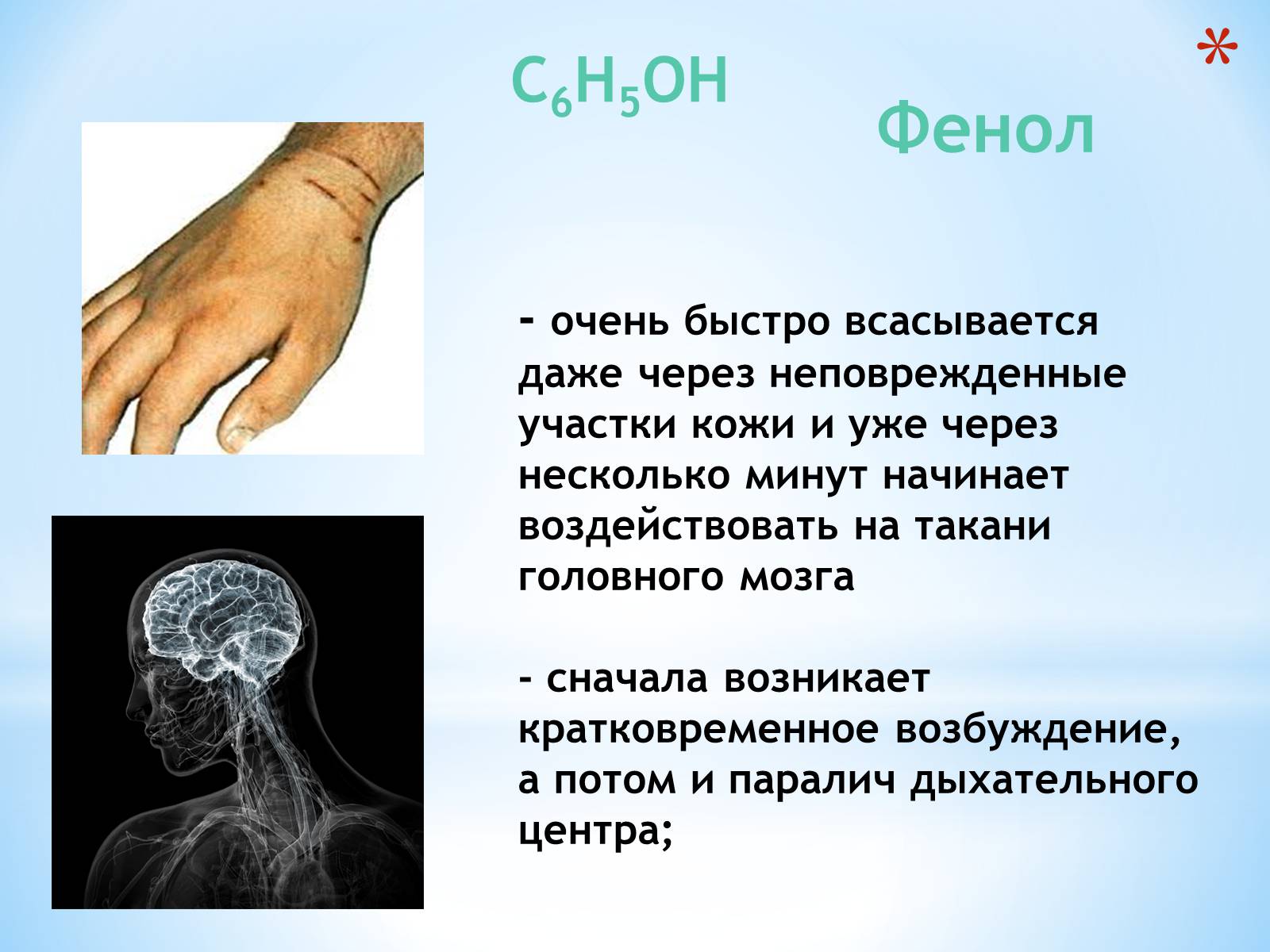
Фенол
- очень быстро всасывается
даже через неповрежденные
участки кожи и уже через несколько минут начинает воздействовать на такани головного мозга
- сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра;
С6H5OH

- даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил;
- тяжелые случаи отравления характеризуются бессознательным состоянием, затруднением дыхания, нечувствительностью роговицы, едва ощутимым пульсом, нередко судорогами;
- зачастую фенол является причиной онкозаболеваний.

Химические свойства. Реакция гидроксильной группы
Фенол проявляет свойства слабой кислоты :
Взаимодействует с щелочными металлами и щелочами с образованием солей – фенолятов :
Фенол ( как кислота ) слабее угольной кислоты :
последняя вытесняет фенол из солей :
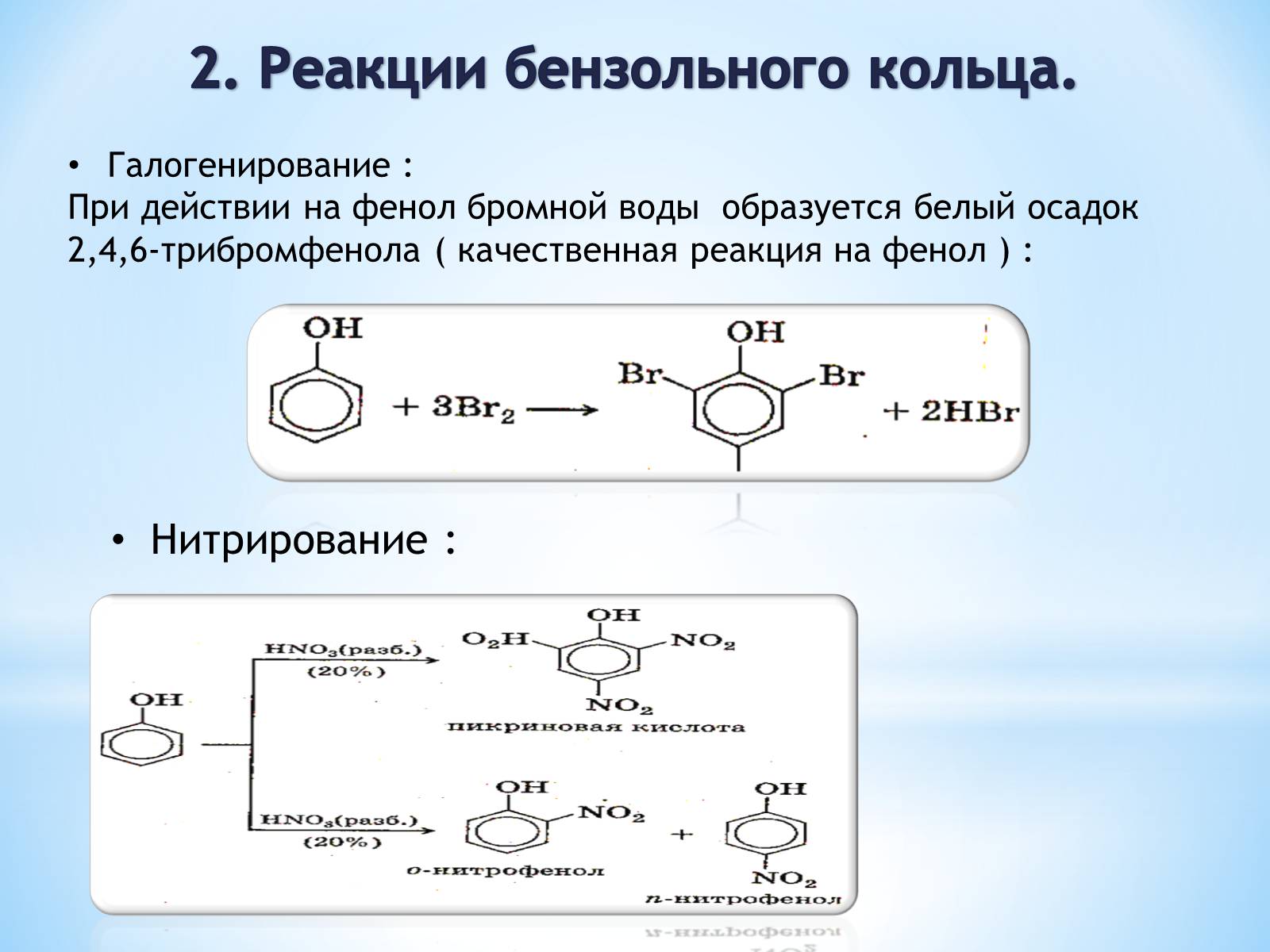
2. Реакции бензольного кольца.
Галогенирование :
При действии на фенол бромной воды образуется белый осадок 2,4,6-трибромфенола ( качественная реакция на фенол ) :
Нитрирование :
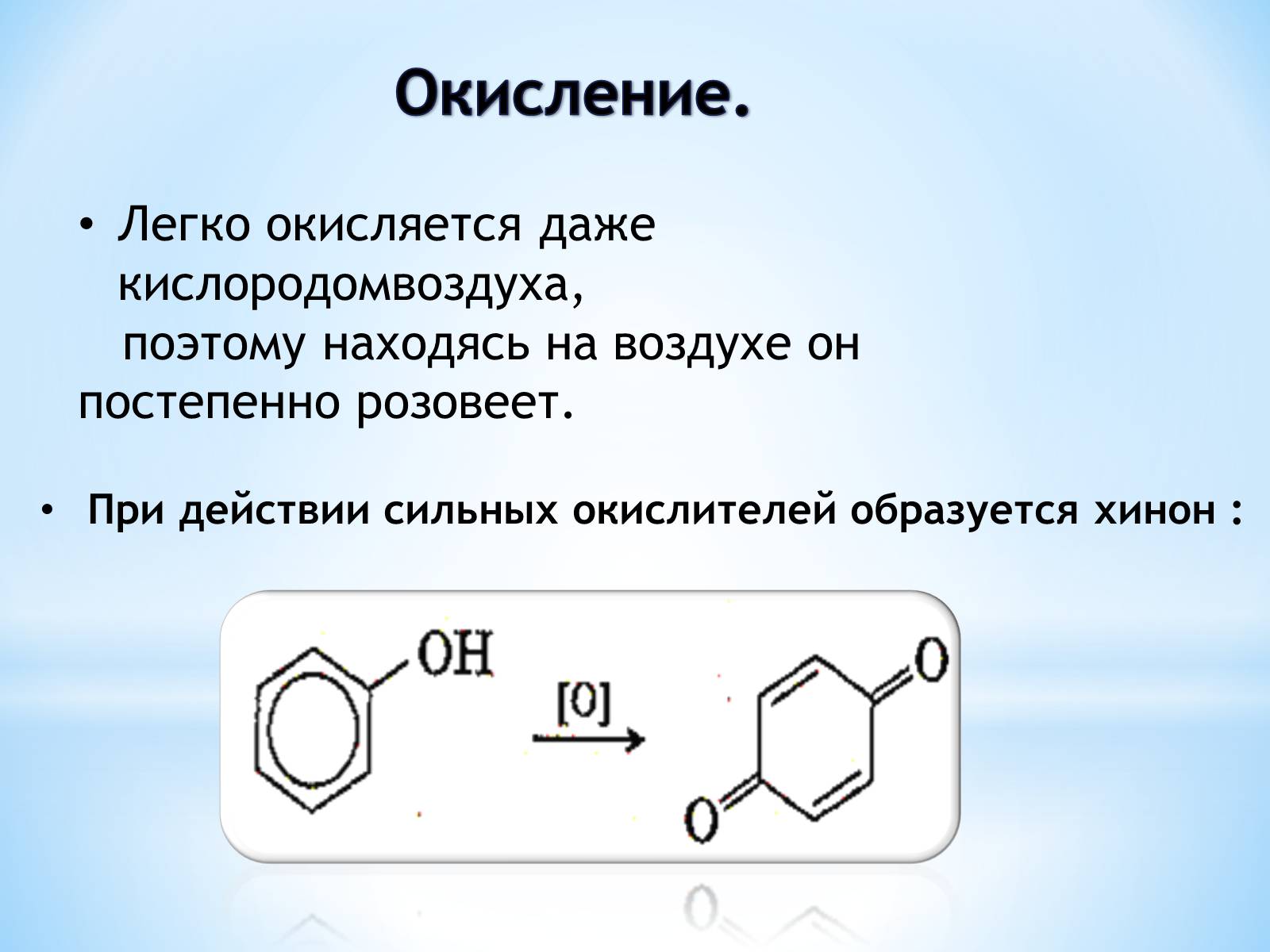
Окисление.
Легко окисляется даже кислородомвоздуха,
поэтому находясь на воздухе он постепенно розовеет.
При действии сильных окислителей образуется хинон :
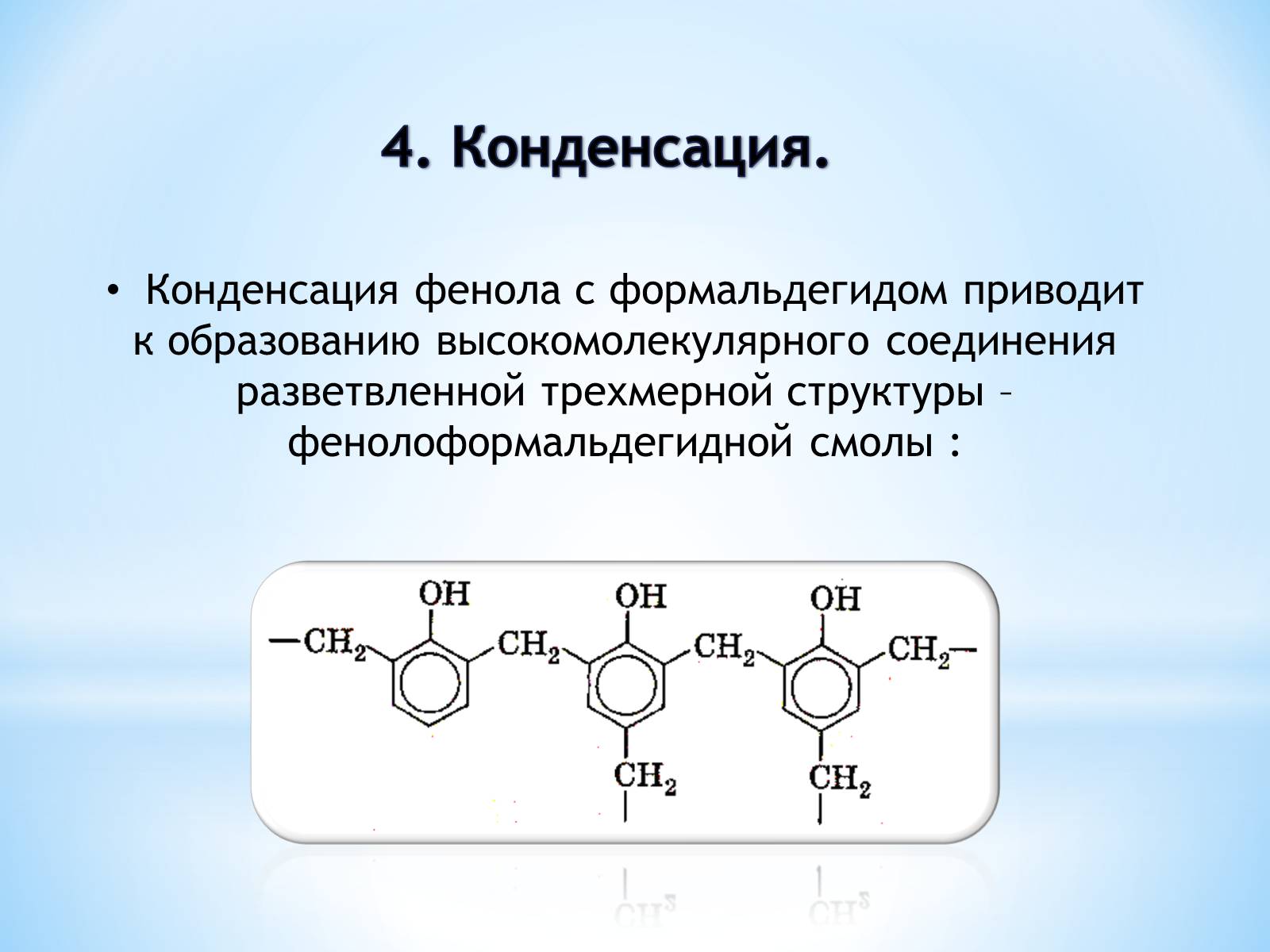
4. Конденсация.
Конденсация фенола с формальдегидом приводит
к образованию высокомолекулярного соединения разветвленной трехмерной структуры – фенолоформальдегидной смолы :
