Презентація на тему «Етилен і ацетилен – ненасичені вуглеводні»

Етилен і ацетилен – ненасичені вуглеводні
Ткаченко Ірина Іванівна,
вчитель хімії
Черкаської загальноосвітньої
школи I-III ступенів № 21

Щоб пізнати –
треба навчитися спостерігати

М е т а
ознайомитися із основними фізико-хімічними властивостями, будовою та застосуванням етилену і ацетилену;
навчитися складати рівняння реакцій, що характеризують хімічні властивості ненасичених вуглеводнів;
навчитися встановлювати причинно-наслідкові зв'язки між будовою і властивостями

План
1. Поняття про ненасичені вуглеводні. Номенклатура.
2. Будова молекул етену та етину.
3. Фізичні властивості, добування.
4. Хімічні властивості етену та етину.
5. Застосування ненасичених вуглеводнів.

Ненасичені вуглеводні – органічні сполуки, що мають кратні зв'язки між атомами Карбону (подвійні – С = С – або потрійні – С Ξ С – )
Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв'язок між атомами Карбону.
Загальна формула СnH2n
С2Н4 - етен (етилен)
С3Н6 - пропен
С4Н8 - бутен
Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв'язок між атомами Карбону.
Загальна формула - СnH2n - 2
С2Н2 - етин (ацетилен)
С3Н4 - пропін
С4Н6 - бутин
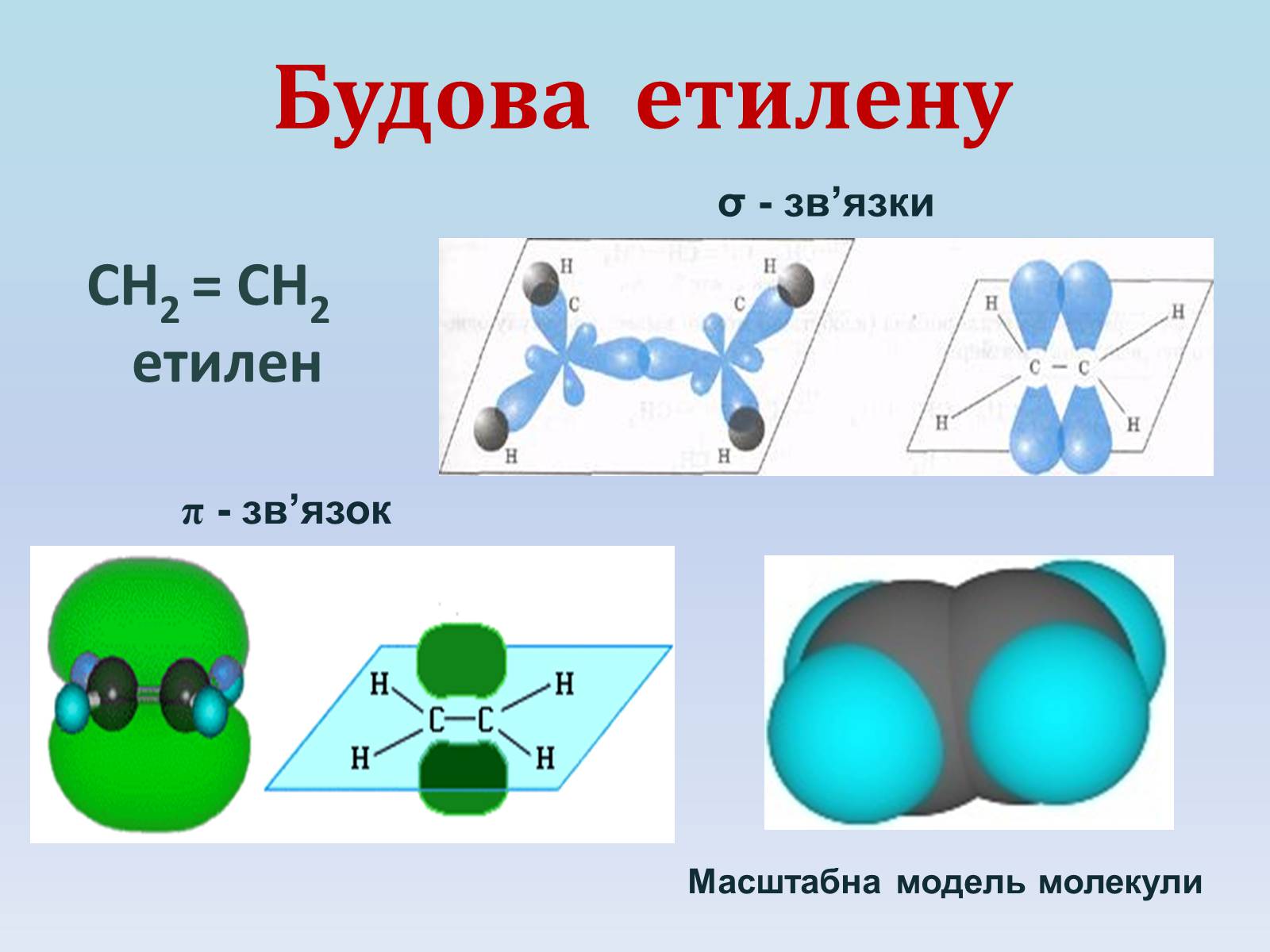
Будова етилену
СН2 = СН2
етилен
σ - зв'язки
π - зв'язок
Масштабна модель молекули
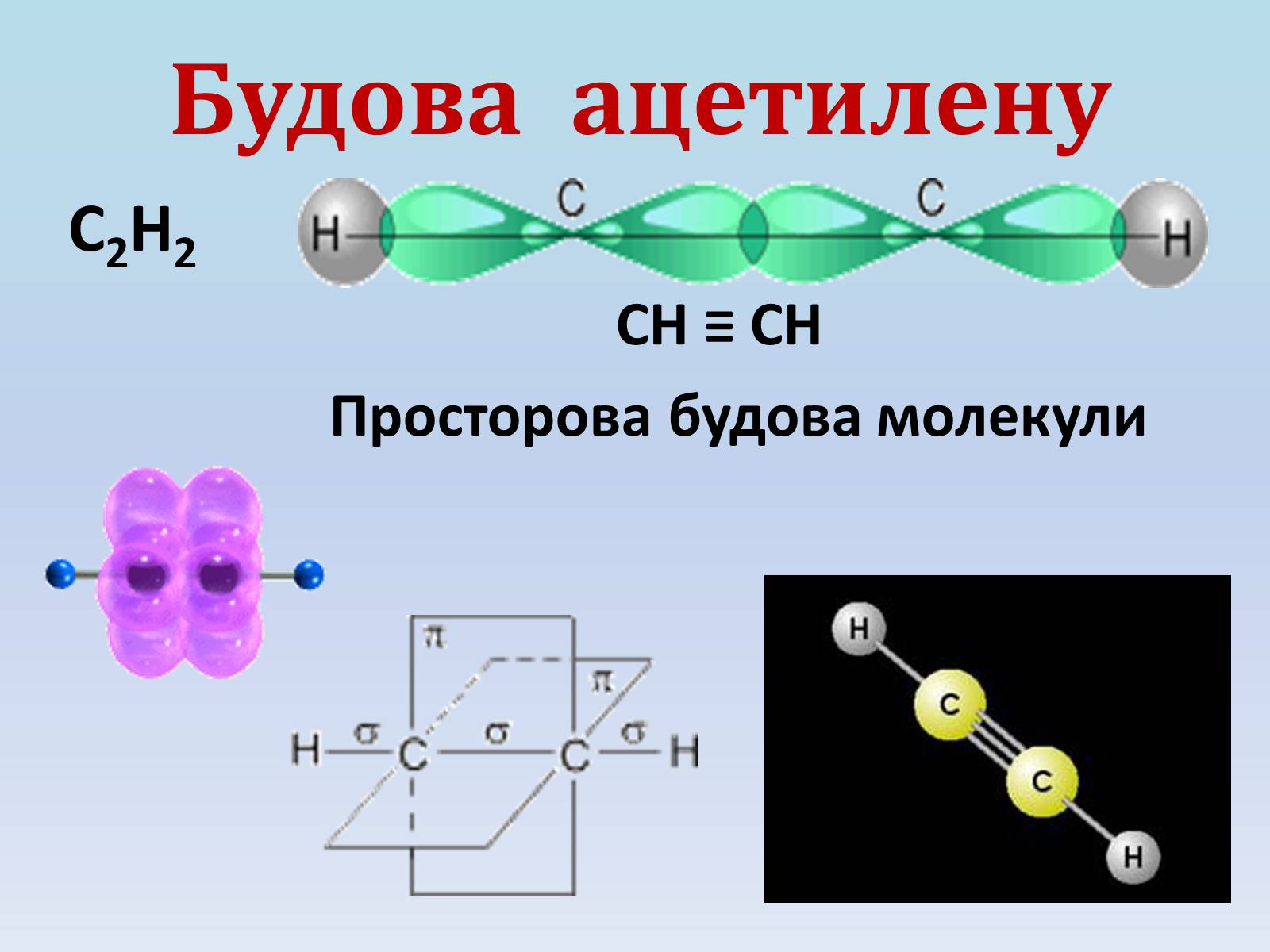
Будова ацетилену
С2Н2
СН ≡ СН
Просторова будова молекули

Фізичні властивості етилену
С2Н4
безбарвний газ;
добре розчинний в органічних розчинниках;
tплавл = - 169,2 ̊С;
вибухонебезпечний
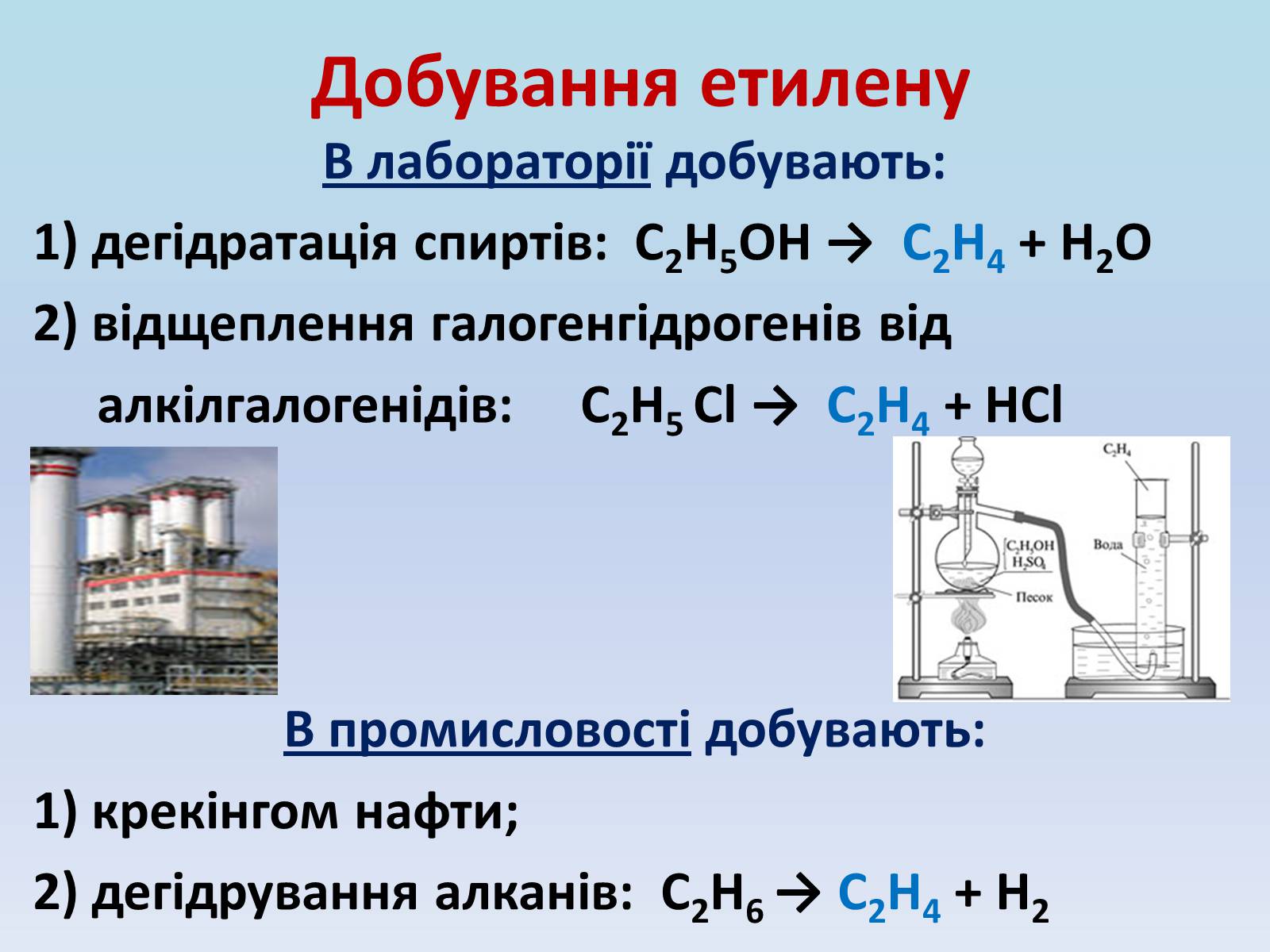
Добування етилену
В лабораторії добувають:
1) дегідратація спиртів: С2Н5ОН → С2Н4 + Н2О
2) відщеплення галогенгідрогенів від
алкілгалогенідів: С2Н5 Cl → С2Н4 + НCl
В промисловості добувають:
1) крекінгом нафти;
2) дегідрування алканів: С2Н6 → С2Н4 + Н2

Фізичні властивості
С2Н2
безбарвний газ;
майже без запаху;
малорозчинний у воді, але під тиском добре розчиняється у ацетоні;
tкип = - 84 ̊С;
легший за повітря;
вибухонебезпечний

Добування ацетилену
1836р. - відкритий Е. Деві при розкладанні
водою калій карбіду.
1862р. - М. Бертло (франц.) вперше синтезув
із вуглецю і водню: 2С + Н2 → С2Н2
1. Карбідний метод: СаС2 + 2Н2О → С2Н2 + Са(ОН)2
2. Піроліз метану: t=1500ºС
2 СН4 → C2H2 + 3H2
Добування в лабораторії
C2H2 ацетилен

Хімічні властивості етилену
Горіння (з виділенням великої кількості теплоти): tС2Н4 + 3O2 → 2СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв'язку: СН2 = СН2
а) гідрування - приєднання водню: С2Н4 + Н2→ С2Н6
б) галогенування - приєднання галогенів:
С2Н4 + Br2 →С2Н4Br2
Якісне визначення ненасичених
вуглеводнів - знебарвлення розчину
калій перманганату і бромної води
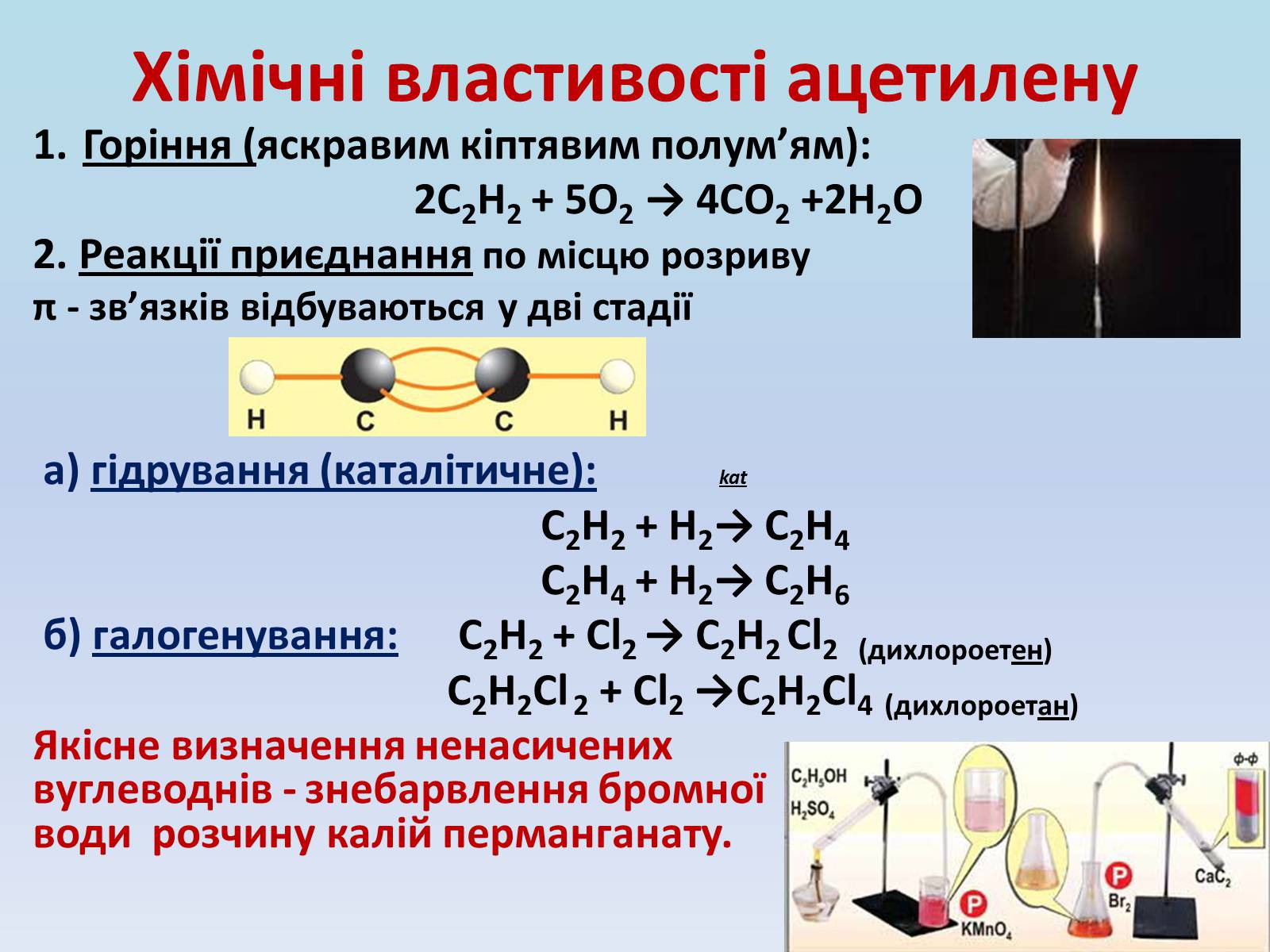
Хімічні властивості ацетилену
Горіння (яскравим кіптявим полум'ям):
2С2Н2 + 5O2 → 4СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв'язків відбуваються у дві стадії
а) гідрування (каталітичне): kat
С2Н2 + Н2→ С2Н4
С2Н4 + Н2→ С2Н6
б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен)
С2Н2Cl 2 + Cl2 →С2Н2Cl4 (дихлороетан)
Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води розчину калій перманганату.

Застосування
Етилен
Ацетилен
Висока реакційна здатність зумовлює використання в хімічній промисловості для добування етанолу та етиленгліколю
Використовують для дозрівання плодів
Використовують для добування полімеру поліетилену
70% ацетилену використовується для потреб органічного синтезу: виробництво етанолу, ацетальдегіду, оцтової кислоти, полімерів, синтетичних каучуків, органічних розчинників
30% ацетилену використовується для автогенного зварювання і різання металів

Дайте відповіді на питання
1. Ацетилен у лабораторії добувають взаємодією:
а) кальцій силікату і води; tб) кальцій карбонату і воду;
в) кальцій карбіду і води; tг) етену та води.
2. Скільки спільних ковалентних електронних пар є між атомами Карбону в молекулі етилену ?
а) одна; t б) дві; t tв) три; tг) чотири
3. Яка загальна формула ненасичених вуглеводнів ряду ацетилену?
а) СnH2n; tб) СnH2n+2; tв) СnH2n+4; tг) СnH2n-2
4. Яка речовина належить до ненасичених вуглеводнів ряду етилену?
а) С2Н2; tб) С4Н10; tв) С2Н6; tг) С3Н6
5. Ненасичені вуглеводні можуть приєднувати:
а) галогени; б) галоген гідрогени;
в) лише водень; г) натрій хлорид
6. Вкажіть продукти реакції, що утворюються при гідруванні ацетилену:
а) етан; tб) пропан; tв) етен; tг) метан
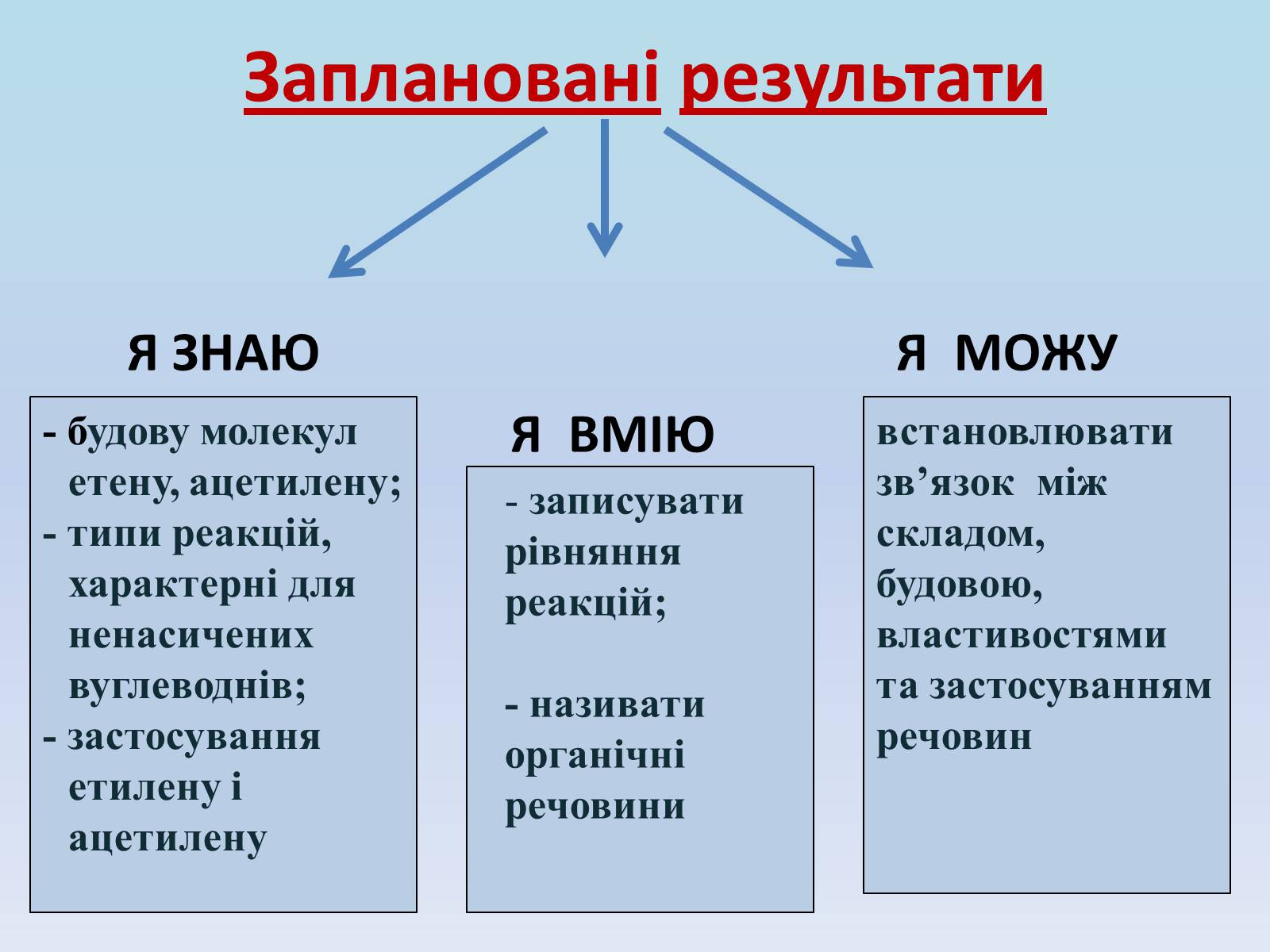
Заплановані результати
Я ЗНАЮ Я МОЖУ
Я ВМІЮ
- будову молекул етену, ацетилену;
- типи реакцій, характерні для ненасичених вуглеводнів;
- застосування етилену і ацетилену
записувати рівняння реакцій;
- називати органічні речовини
встановлювати зв'язок між складом, будовою, властивостями та застосуванням речовин

Домашнє завдання
Вивчити відповідний матеріал підручника.
Вивчити основні поняття теми.
Виконати письмове завдання.