Презентація на тему «Будова атома» (варіант 1)

Будова атома: ядро й електронна оболонка. Склад атомних ядер
1

Цілі уроку
Продовжити знайомство з періодичною системою хімічних елементів Д.І.Менделєєва;
Розкрити зміст порядкового номера елемента на основі знань про будову атома;
Розширити знання про радіоактивність;
Сформувати поняття сучасного періодичного закону;
Формувати уміння обчислювати кількість протонів, нейтронів і електронів у атомі.
2
Хімічна фортуна
3
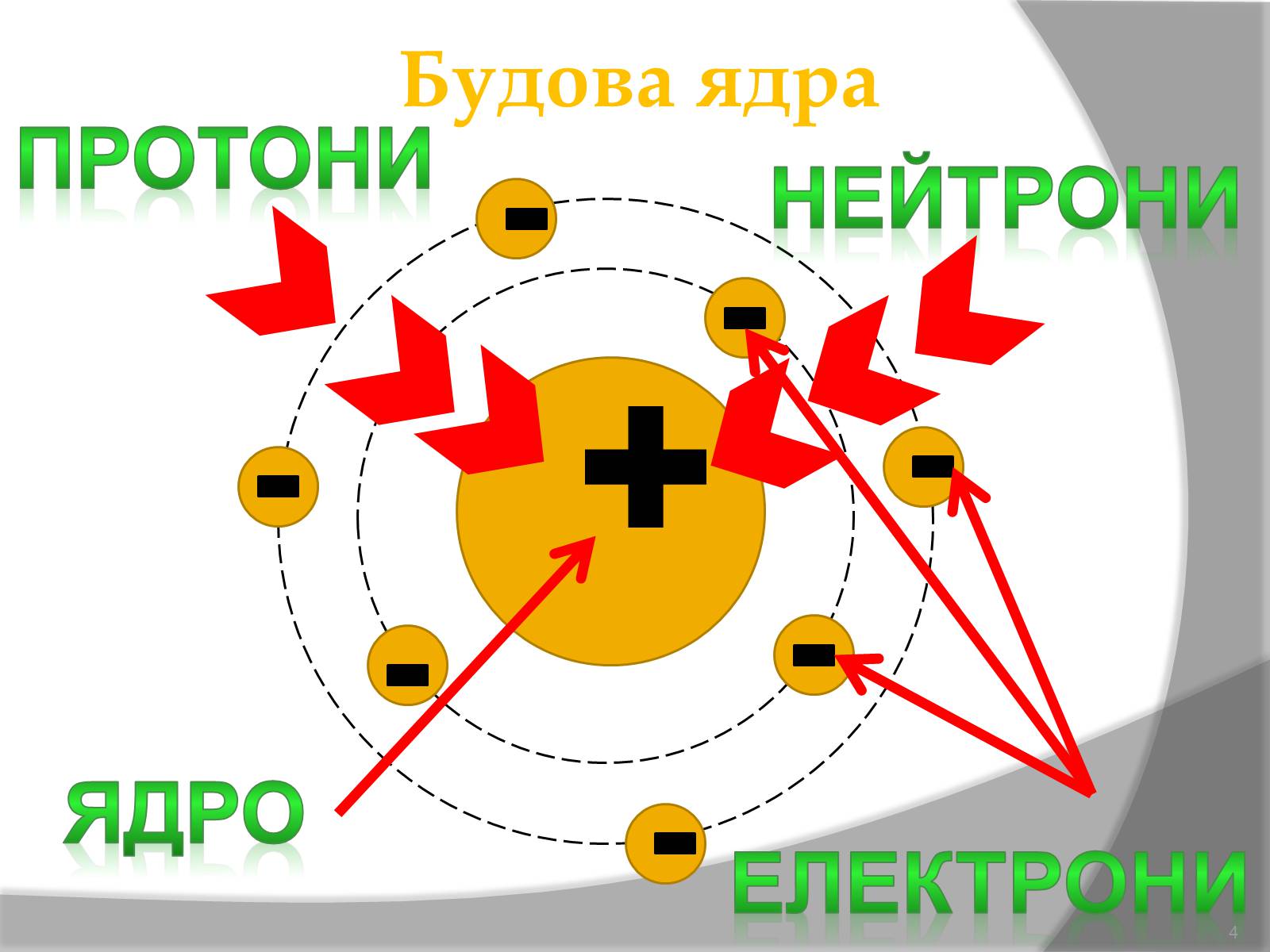
Будова ядра
протони
нейтрони
електрони
ядро
4
5

Нейтрон – нейтральна частинка, що не має електричного заряду
Протон – позитивно заряджена частинка
Електрон – негативно заряджена частинка
Порядковий номер = заряд ядра = кількість протонів = кількість електронів
n
p
e
n = Ar - p
6

Наприклад
Складіть схему будови атома Карбону, обчисліть число, протонів і нейтронів
С +6)) 6 е, ne = 6, np = 6, nn = 6
12
6
Р
31
15
Символ елемента
Протонне число (заряд ядра, порядковий номер)
Нуклонне
число
7

Основні терміни
Нуклони – загальна кількість протонів і нейтронів
Протонне число – загальне число протонів
Нуклонне число – загальне число протонів і нейтронів
Хімічний елемент – вид атомів із певним протонним числом
8

Сторінками історії
А.Беккерель у 1896 році виявив, що матеріали, які містять Уран, засвідчують у темряві фотопластинку, спричиняють світіння речовин. Надалі з”ясувалось, що цю здатність має не лише Уран.
9

П”єр і Марія Склодовська-Кюрі відкрили два нові радіоактивні елементи – Полоній і Радій. І у 1903 році одержали Нобелівську премію з фізики за відкриття радіоактивності.
У 1911 році після смерті чоловіка Марія була удосконалена Нобелівської премії у галузі хімії за відкриття нею Радію.
10

Радіоактивність
Це здатність деяких елементів випромінювати.
Радіоактивний розпад
Процес розпадання ядер на менші ядра, окремі частинки – α, β, γ.
11