Презентація на тему «Амінокислоти. Пептиди. Білки»
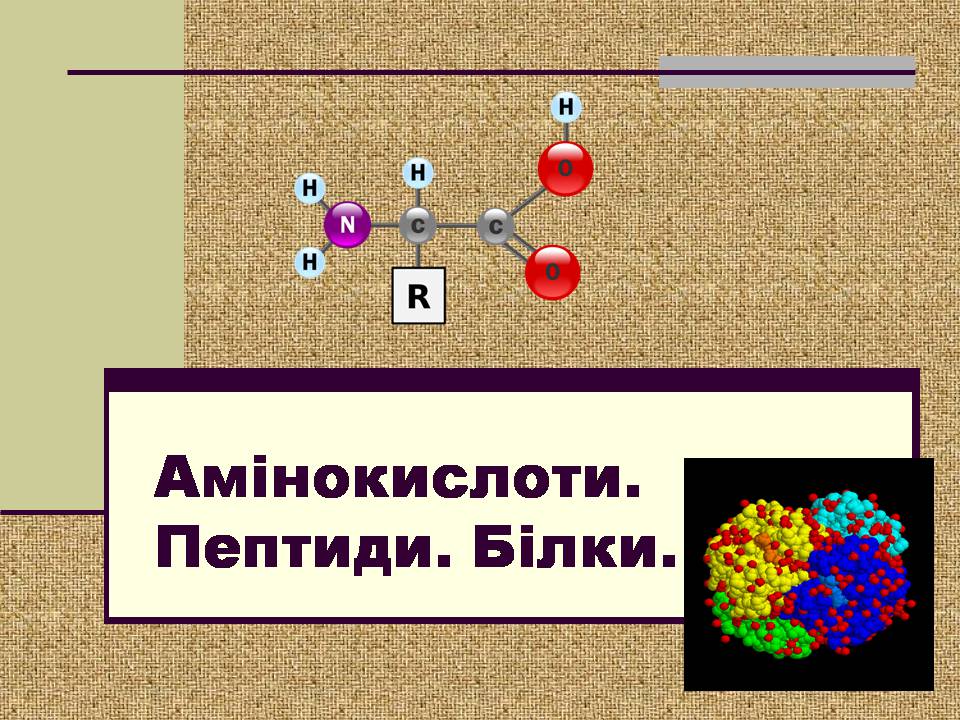
Амінокислоти. Пептиди. Білки.
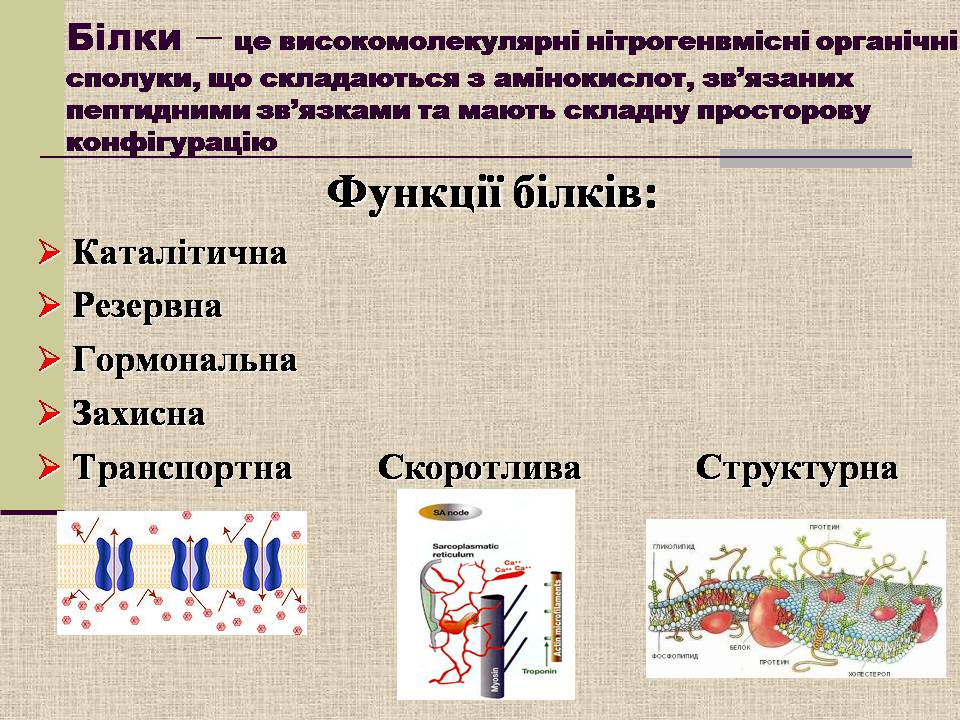
Білки – це високомолекулярні нітрогенвмісні органічні сполуки, що складаються з амінокислот, зв'язаних пептидними зв'язками та мають складну просторову конфігурацію
Функції білків:
Каталітична
Резервна
Гормональна
Захисна
Транспортна Скоротлива Структурна

Класифікації білків:
І. За молекулярною масою:
200-1000 Да - пептиди
1000-5000 Да - поліпептиди
> 5000 Да - білки
ІІ. За структурою:
Прості – складаються тільки з амінокислот
Складні – складаються з амінокислот та іншої небілкової частини

Амінокислоти – гетерофункціональні сполуки, похідні карбонових кислот, у яких один атом гідрогену заміщений на аміногрупу
Амінокислоти поділяють на:
Незамінні: валін, лейцин,ізолейцин, лізин, треонін, метіонін, фенілаланін, триптофан –поступають ззовні.
Замінні – синтезуються в організмі людини
За хімічною природою радикалу:
аліфатичні
ароматичні
гетероциклічні
За кількістю карбоксильних та аміногруп:
Нейтральні (моноаміномонокарбонові)
Основні (диаміномонокарбонові)
Кислі (моноамінодикарбонові)
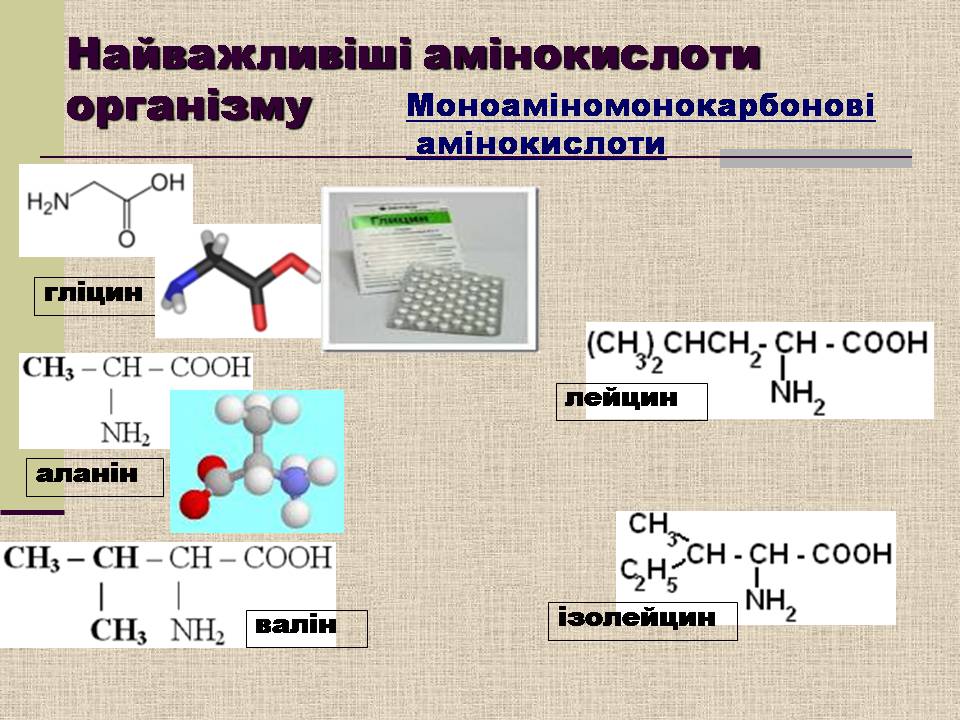
Найважливіші амінокислоти організму
гліцин
аланін
валін
лейцин
ізолейцин
Моноаміномонокарбонові
амінокислоти
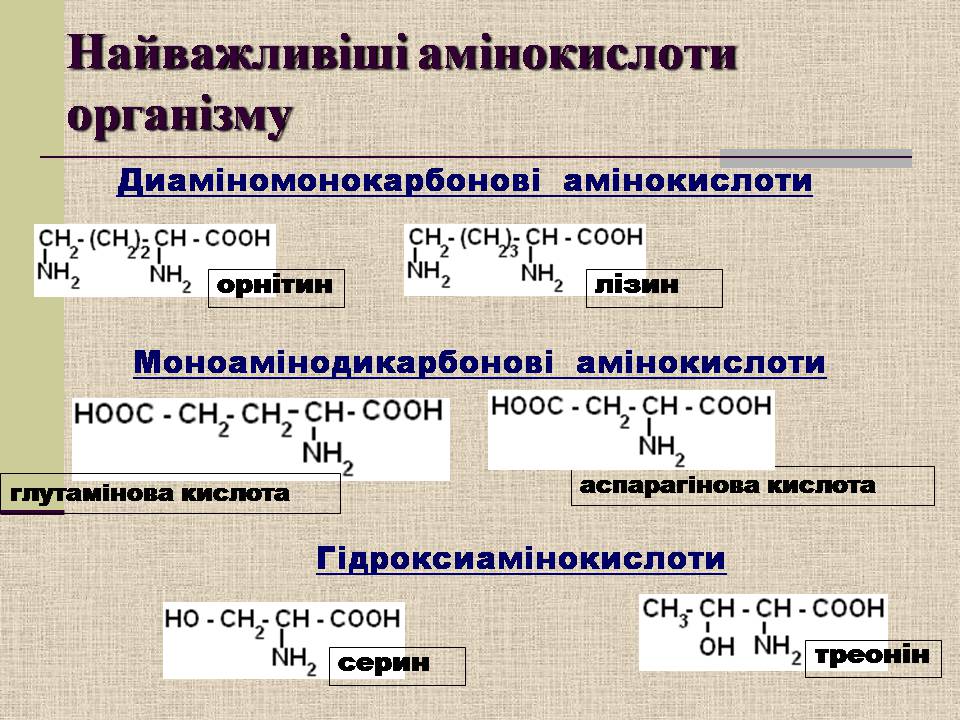
Найважливіші амінокислоти організму
орнітин
лізин
треонін
Диаміномонокарбонові амінокислоти
Моноамінодикарбонові амінокислоти
глутамінова кислота
аспарагінова кислота
серин
Гідроксиамінокислоти
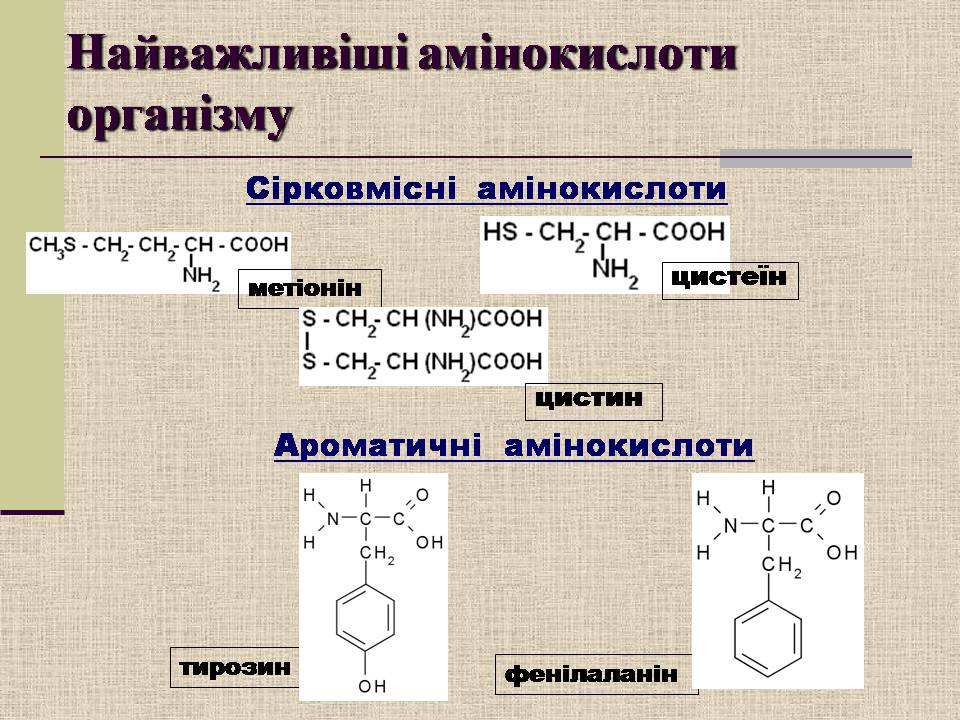
тирозин
фенілаланін
метіонін
цистин
цистеїн
Найважливіші амінокислоти організму
Сірковмісні амінокислоти
Ароматичні амінокислоти
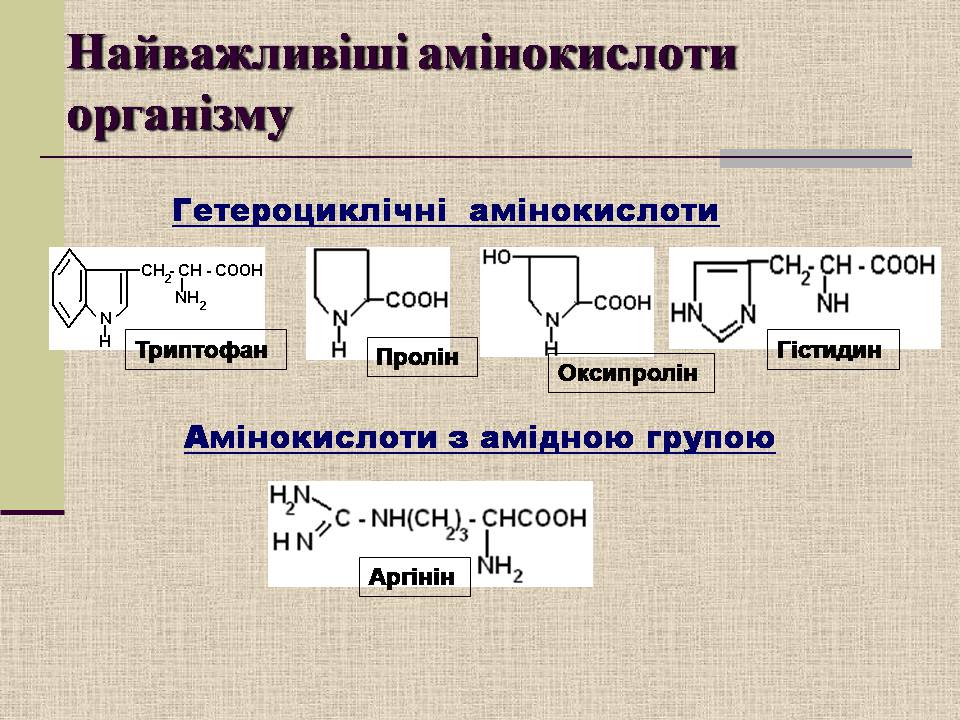
Найважливіші амінокислоти організму
Гетероциклічні амінокислоти
Триптофан
Пролін
Оксипролін
Гістидин
Амінокислоти з амідною групою
Аргінін
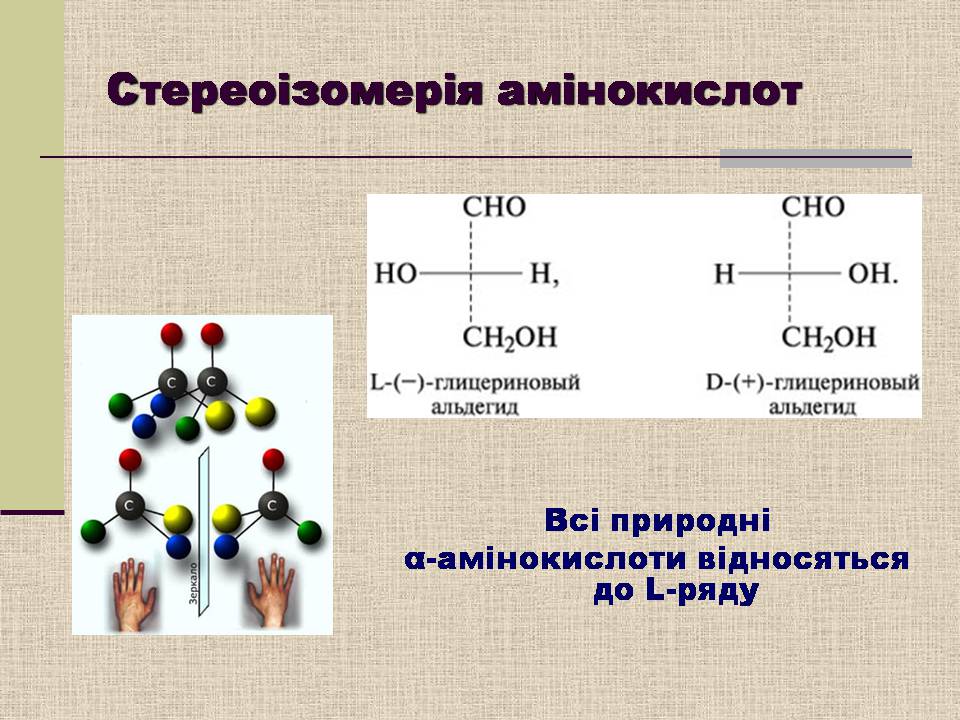
Стереоізомерія амінокислот
Всі природні
α-амінокислоти відносяться до L-ряду

Кислотно-основні властивості амінокислот
Амінокислоти проявляють амфотерні властивості оскільки вміщують як основну групу -NH2, так і кислотну групу -СООН. Амфотерність амінокислот проявляється, наприклад, при утворенні внутрішніх солей, так званих біполярних іонів
H2N-CH2-COOH → H3N+-CH2-COO-
Амінокислоти реагують як з лугами, так і з кислотами

Реакції поліконденсації
α-Амінокислоти при взаємодії між собою утворюють аміди, які називають пептидами. Зв'язок називається
пептидним
При взаємодії гліцину і аланіну утворюється дипептид гліцилаланін

Фізико-хімічні властивості амінокислот
Ізоелектрична точка – значення
рН, при якому білок набуває
нульового заряду і випадає в осад
Денатурація – незворотнє осадження білків
під впливом:
Високої температури
Високого тиску
Концентрованих мінеральних кислот
Алкалоїдних реактивів
Висолювання – зворотнє осадження білків, яке відбувається
під впливом солей лужних та лужно-земельних металів

Хімічні властивості амінокислот
І. За карбоксильною групою:
Утворення солей
Утворення ефірів
Утворення галогенангідридів
Декарбоксилювання
ІІ. За аміногрупою:
Утворення N-ацилпохідних
Дезамінування: окисне, відновне, гідролітичне та внутрішньомолекулярне
Утворення основ Шиффа (заміщені іміни)
Взаємодія з 2,4-динітрофторбензолом (реакція Сенгера)
Взаємодія з фенілізотіоціанатом (реакція Едмана)

Якісні реакції на амінокислоти
Нінгідринова – реакція на α-амінокислоти (синьо-фіолетове забарвлення)
2. Ксантопротеїнова – реакція на ароматичні амінокислоти (жовто-оранжове забарвлення)
3. Реакція Адамкевича – на триптофан (червоно-фіолетове забарвлення)
4. Реакція Фоля – на сірковмісні амінокислоти (утворення чорного осаду)
5. Біуретова реакція – реакція на пептидні зв'язки (синьо-фіолетове забарвлення)
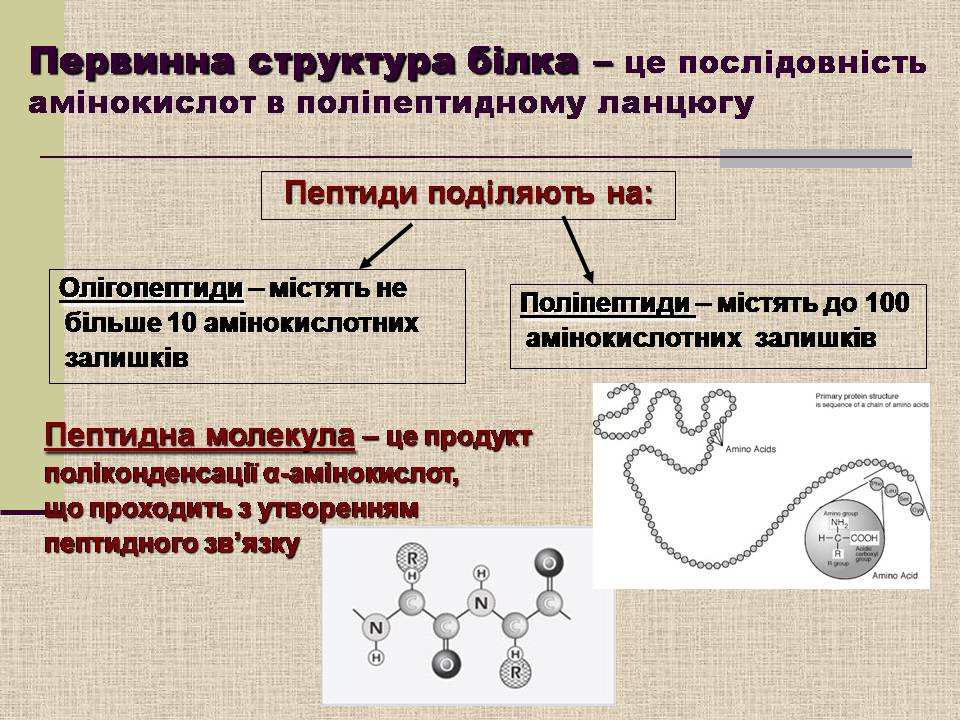
Первинна структура білка – це послідовність амінокислот в поліпептидному ланцюгу
Пептиди поділяють на:
Олігопептиди – містять не
більше 10 амінокислотних
залишків
Поліпептиди – містять до 100
амінокислотних залишків
Пептидна молекула – це продукт
поліконденсації α-амінокислот,
що проходить з утворенням
пептидного зв'язку
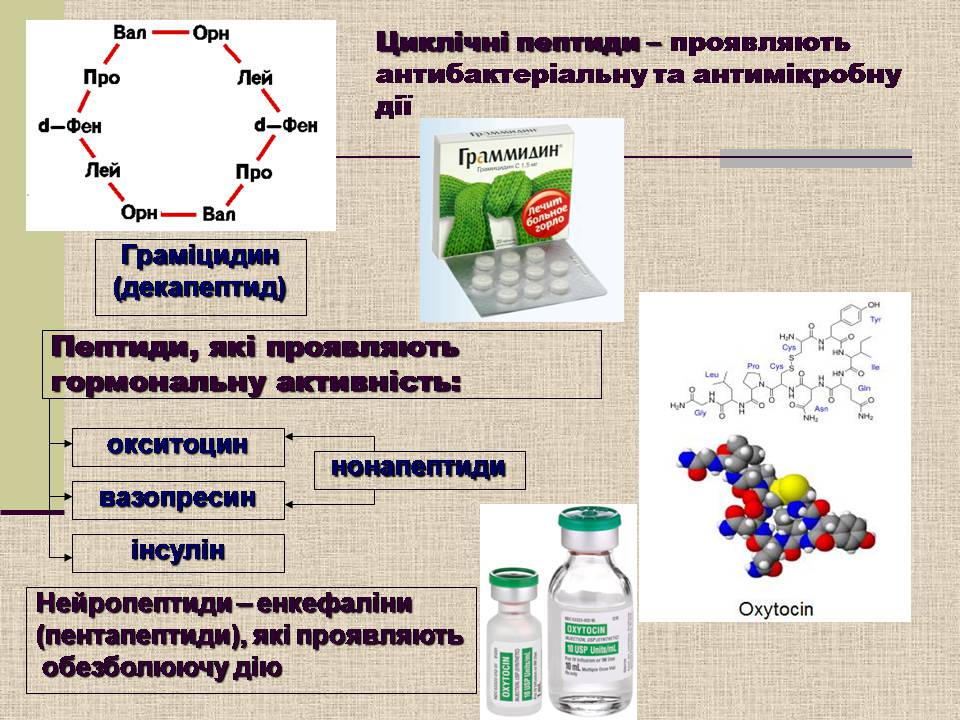
Циклічні пептиди – проявляють антибактеріальну та антимікробну дії
Граміцидин
(декапептид)
Пептиди, які проявляють
гормональну активність:
окситоцин
вазопресин
інсулін
нонапептиди
Нейропептиди – енкефаліни
(пентапептиди), які проявляють
обезболюючу дію
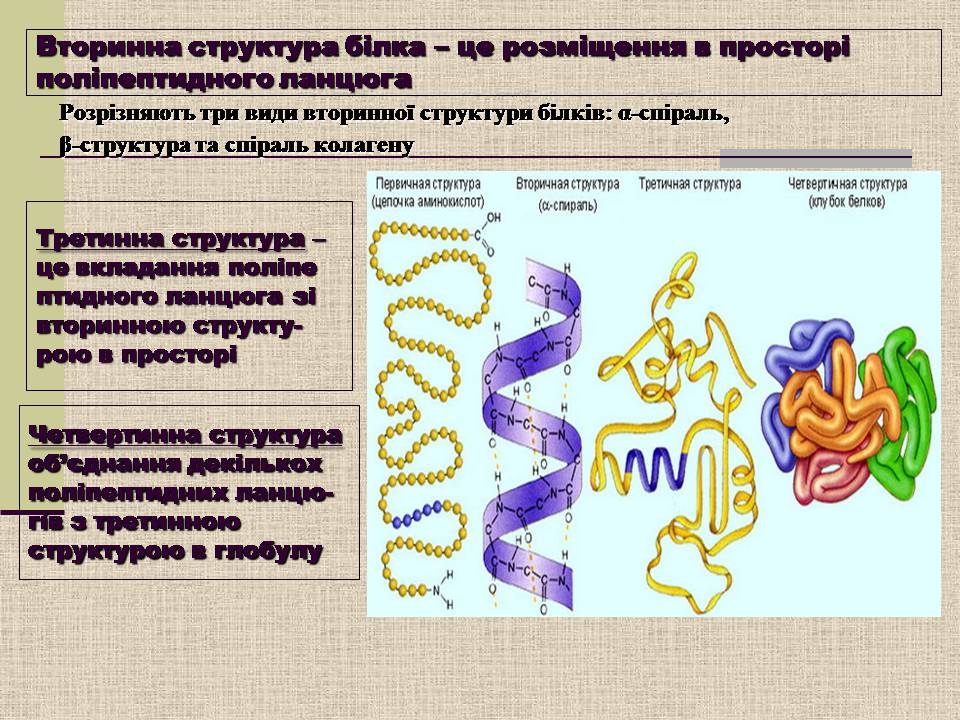
Вторинна структура білка – це розміщення в просторі поліпептидного ланцюга
Розрізняють три види вторинної структури білків: α-спіраль,
β-структура та спіраль колагену
Третинна структура – це вкладання поліпептидного ланцюга зі вторинною структу-рою в просторі
Четвертинна структура об'єднання декількох поліпептидних ланцю-гів з третинною структурою в глобулу
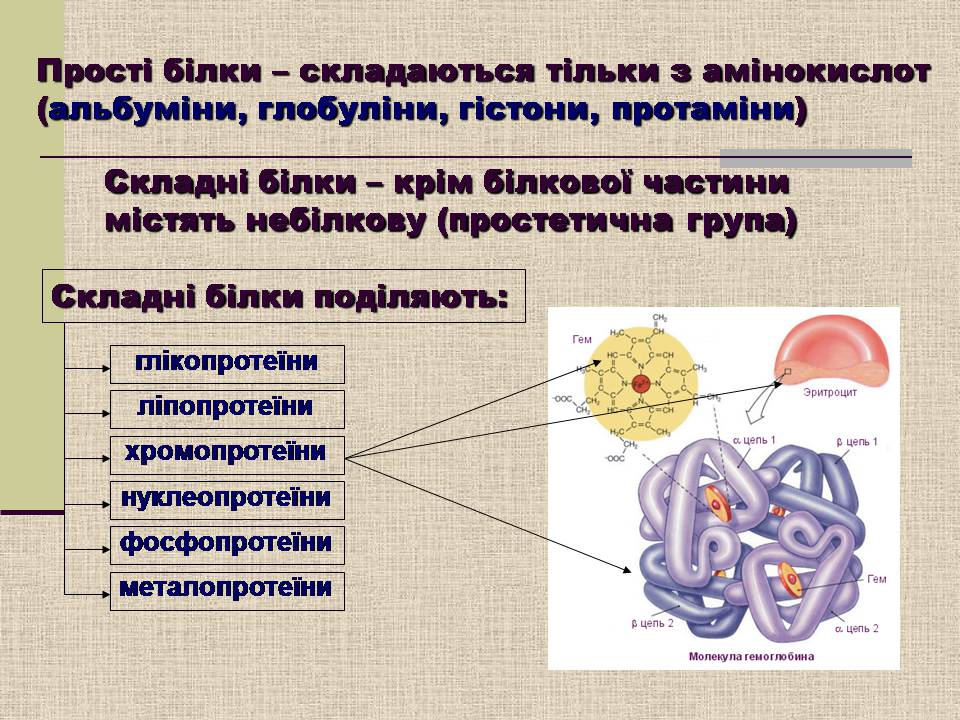
Прості білки – складаються тільки з амінокислот (альбуміни, глобуліни, гістони, протаміни)
Складні білки – крім білкової частини містять небілкову (простетична група)
Складні білки поділяють:
глікопротеїни
ліпопротеїни
хромопротеїни
нуклеопротеїни
фосфопротеїни
металопротеїни