Презентація на тему «Аміак» (варіант 1)

1
2
Склад речовин
Будова
Властивості
Використання
Отримання
3
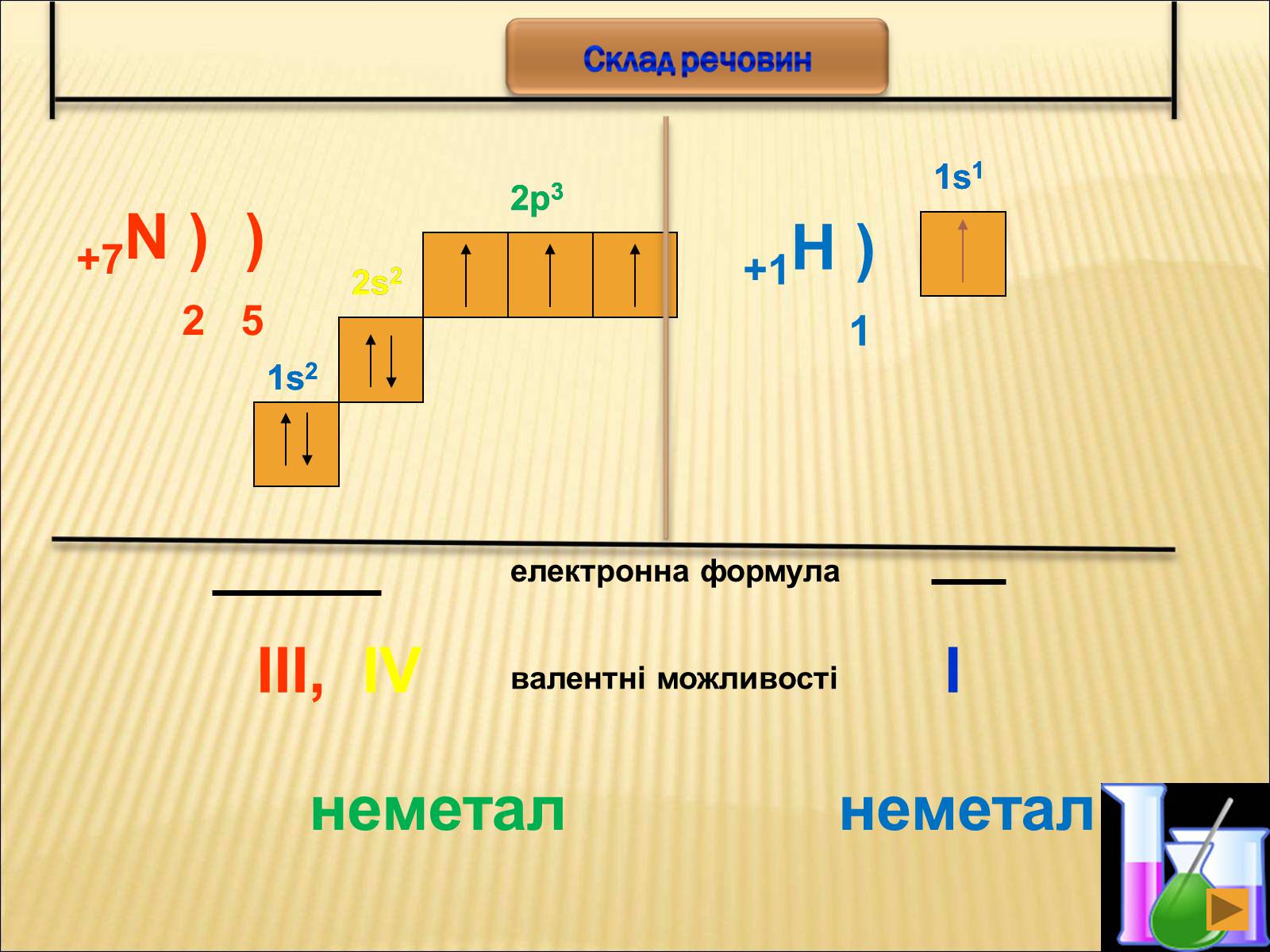
+7N ) )
2 5
2s2
2p3
електронна формула
2s2
1s2
1s2
2p3
валентні можливості
III,
IV
+1H )
1
1s1
1s1
I
неметал
неметал
4
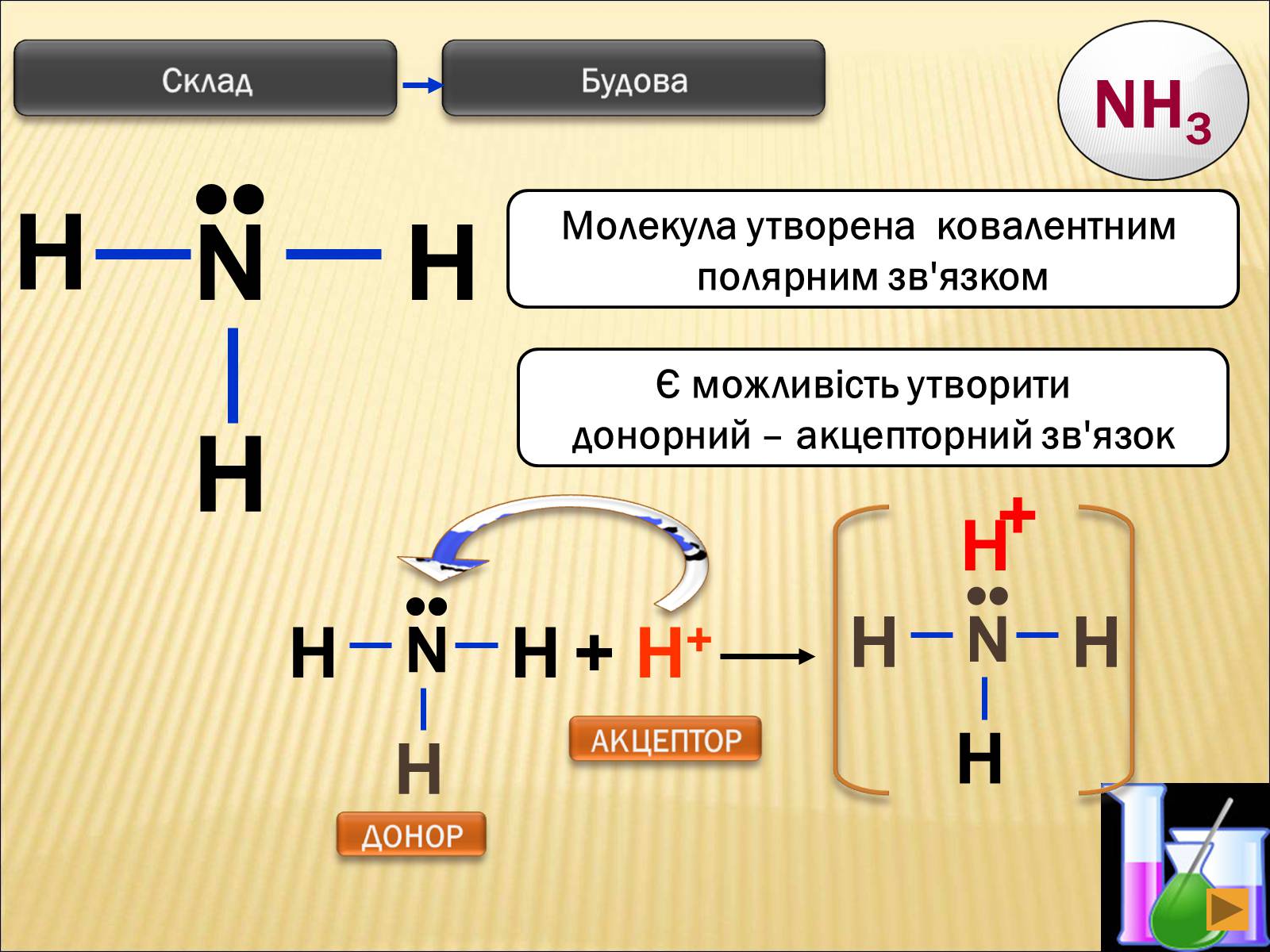
H
N
H
H
••
Є можливість утворити
донорний – акцепторний зв'язок
Молекула утворена ковалентним
полярним зв'язком
N
H
H
H
••
+ H+
N
H
H
H
••
H
+
NH3
5
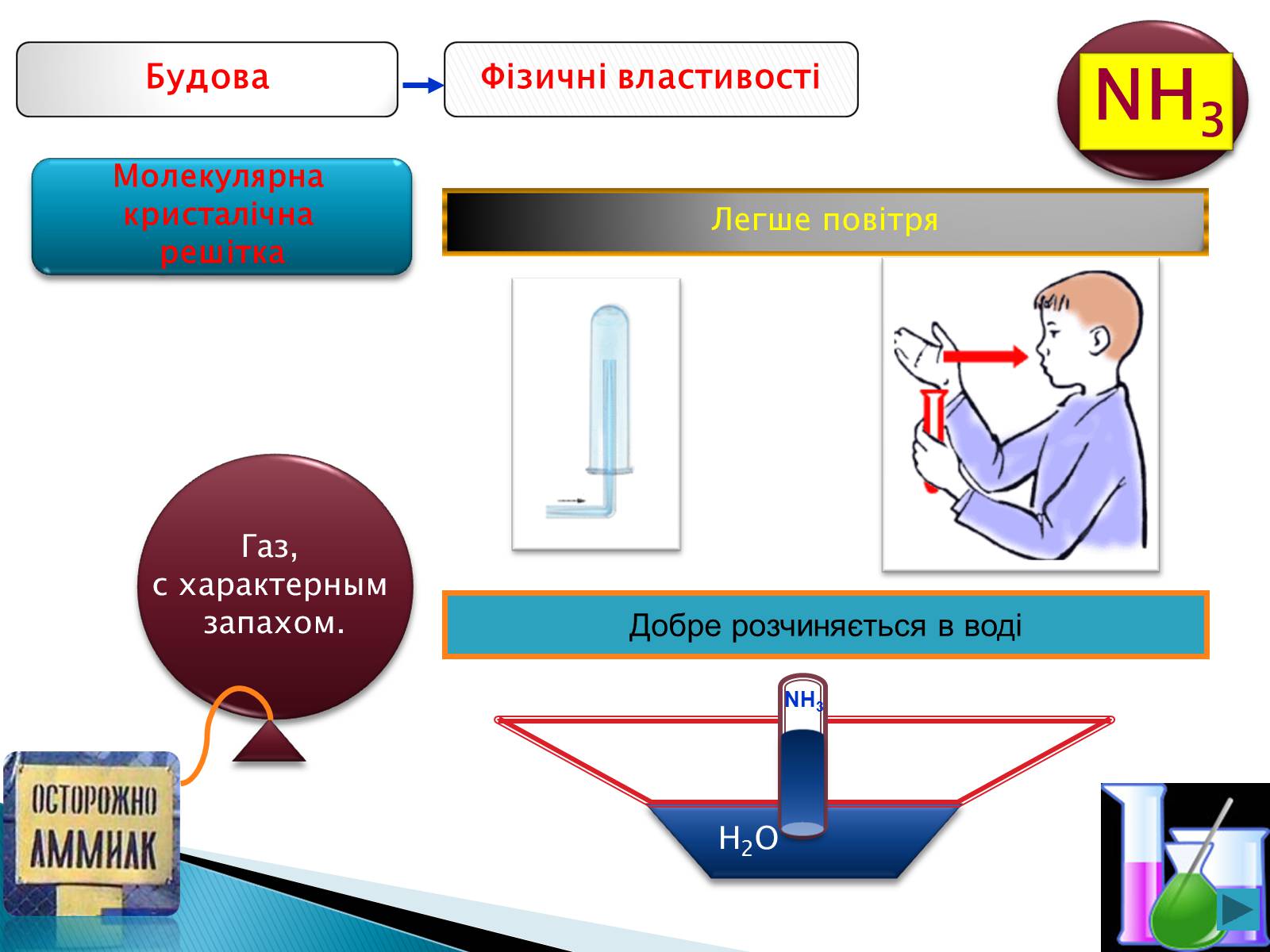
Фізичні властивості
Будова
Газ,
с характерным
запахом.
Легше повітря
Добре розчиняється в воді
H2O
NH3
NH3
Молекулярна
кристалічна
решітка
6
Хімічні властивості
Будова
NH3
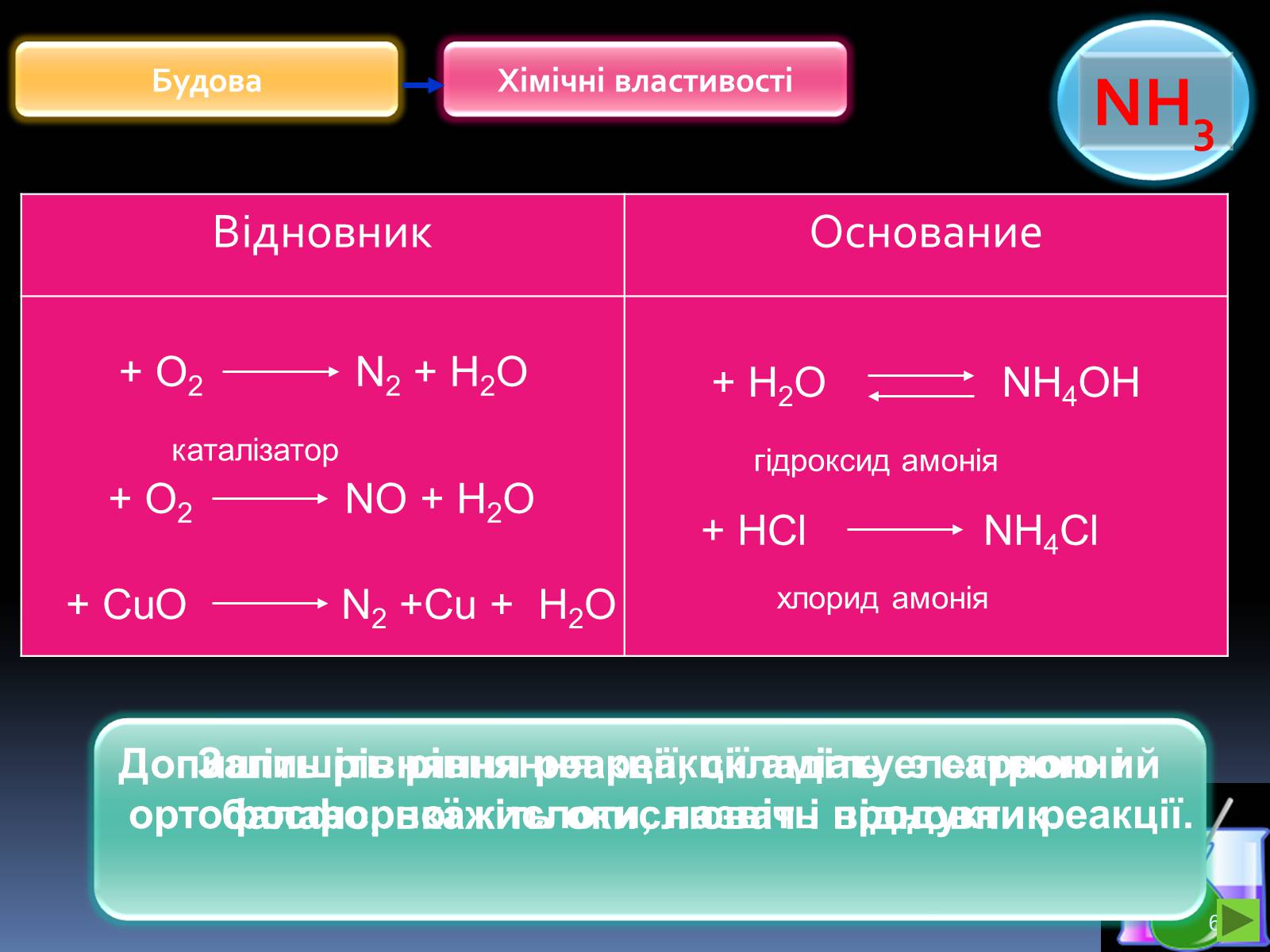
Відновник
Основание
+ О2 N2 + Н2О
+ О2 NО + Н2О
каталізатор
+ CuО N2 +Cu + Н2О
Допишіть рівняння реакції, складіть електронний баланс, вкажіть окислювач і відновник.
+ HCl NH4Cl
+ H2O NH4OH
гідроксид амонія
хлорид амонія
Запишіть рівняння реакції аміаку з сарною і ортофосфорної кислоти, назвіть продукти реакції.
7
Використання
Вживання
NH3
Рассчитайте массовую долю азота в аммиачной селитре
Запишите уравнение реакции разложения гидрокарбоната аммония
Рассчитайте объем аммиака для приготовления 50г 5% - ного нашатырного спирта (при н.у.)
Как осуществить превращения?
NH3 → NO → NO2 HNO3
Составьте окислительно-восстановительную реакцию взаимодействия хлорида аммония с оксидом меди.
Какой объем при нормальных условиях будет занимать 1 кг жидкого аммиака.
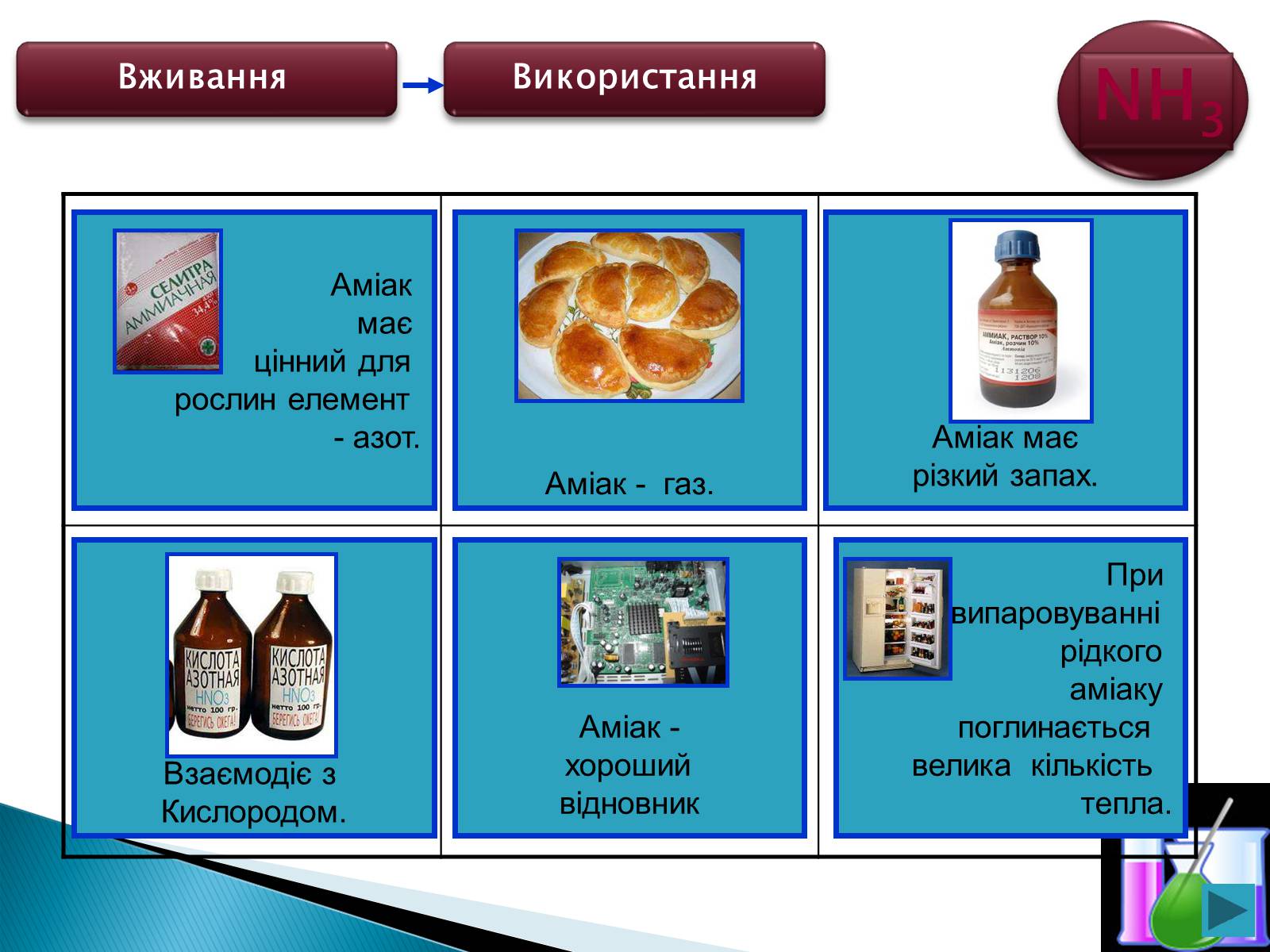
Аміак
має
цінний для
рослин елемент
- азот.
Аміак - газ.
Аміак має
різкий запах.
Взаємодіє з
Кислородом.
Аміак -
хороший
відновник
При
випаровуванні
рідкого
аміаку
поглинається
велика кількість
тепла.
8
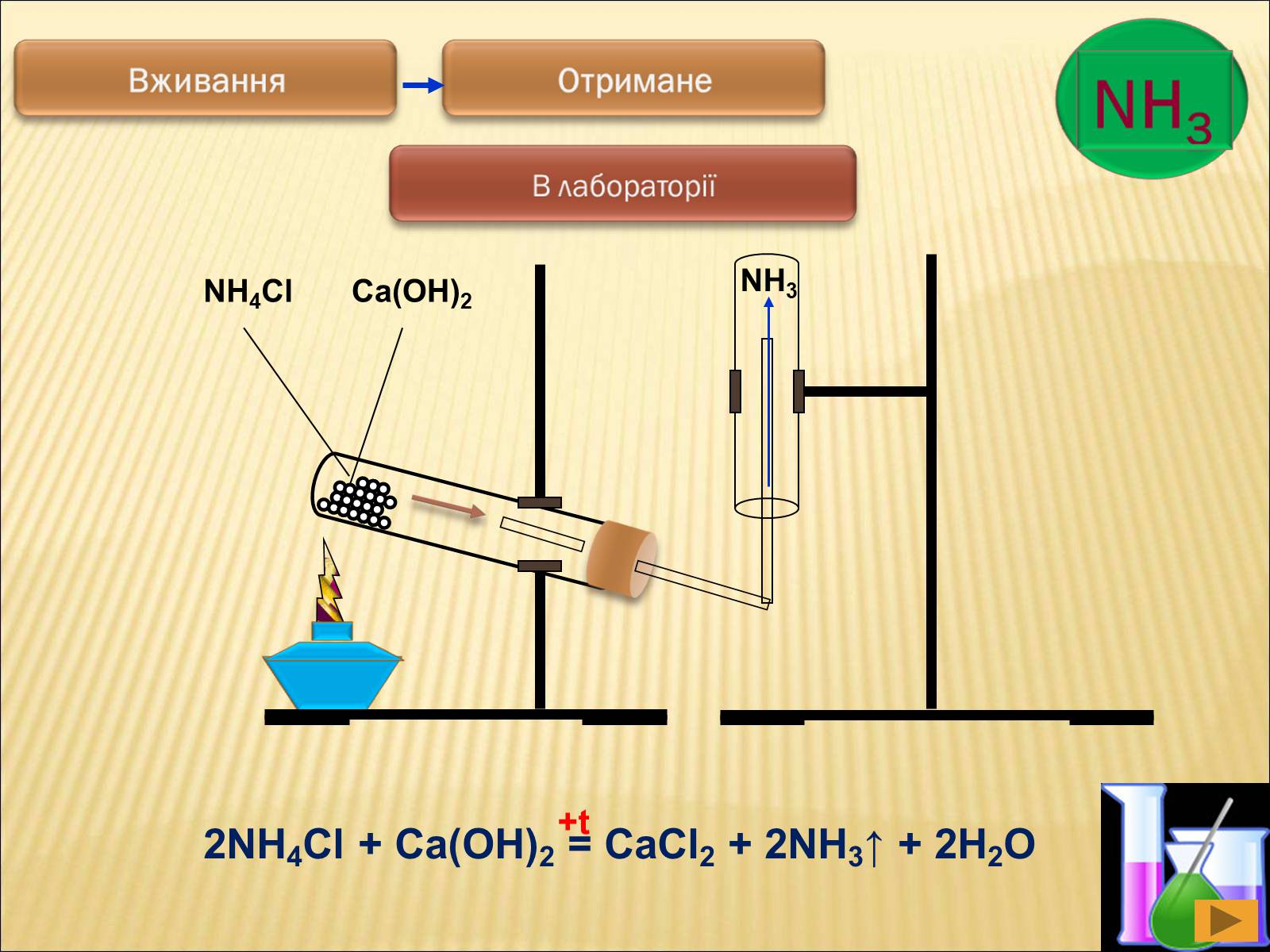
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
+t
NH4Cl
Ca(OH)2
NH3
9
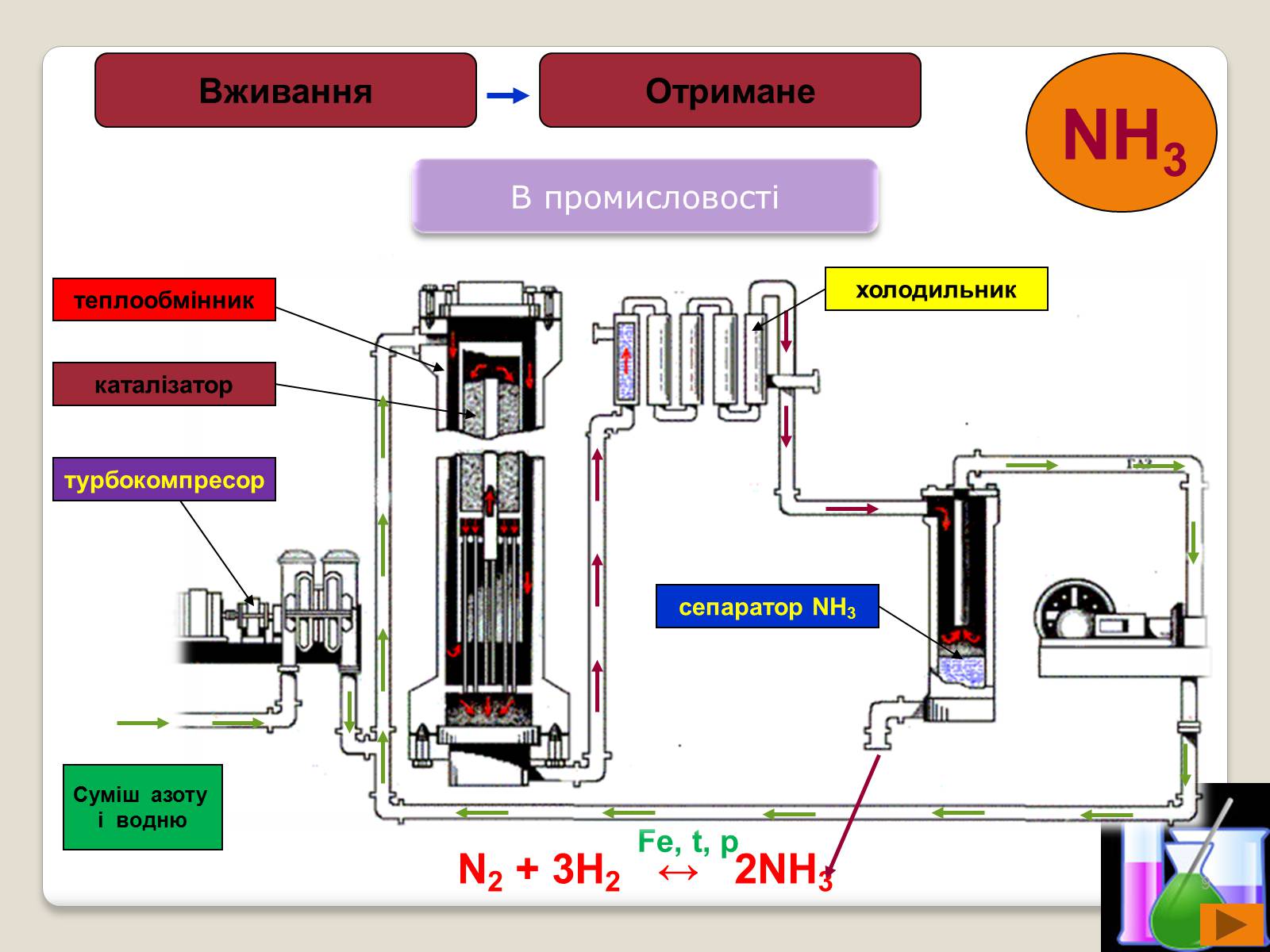
В промисловості
N2 + 3H2 ↔ 2NH3
Fe, t, p
Отримане
Вживання
NH3
Суміш азоту
і водню
турбокомпресор
каталізатор
теплообмінник
холодильник
сепаратор NH3