Презентація на тему «Алкіни»

Алкіни

Поняття та відомості про алкіни
Алкіни – вуглеводні, що містять в молекулі один або кілька потрійних зв'язків і відповідають загальній формулі.
СnН2n – 2 , де n ≥ 2.
Алкіни відносяться до ненасичених вуглеводнів, так як їх молекули містять меншу кількість атомів гідрогену, ніж насичені вуглеводні.
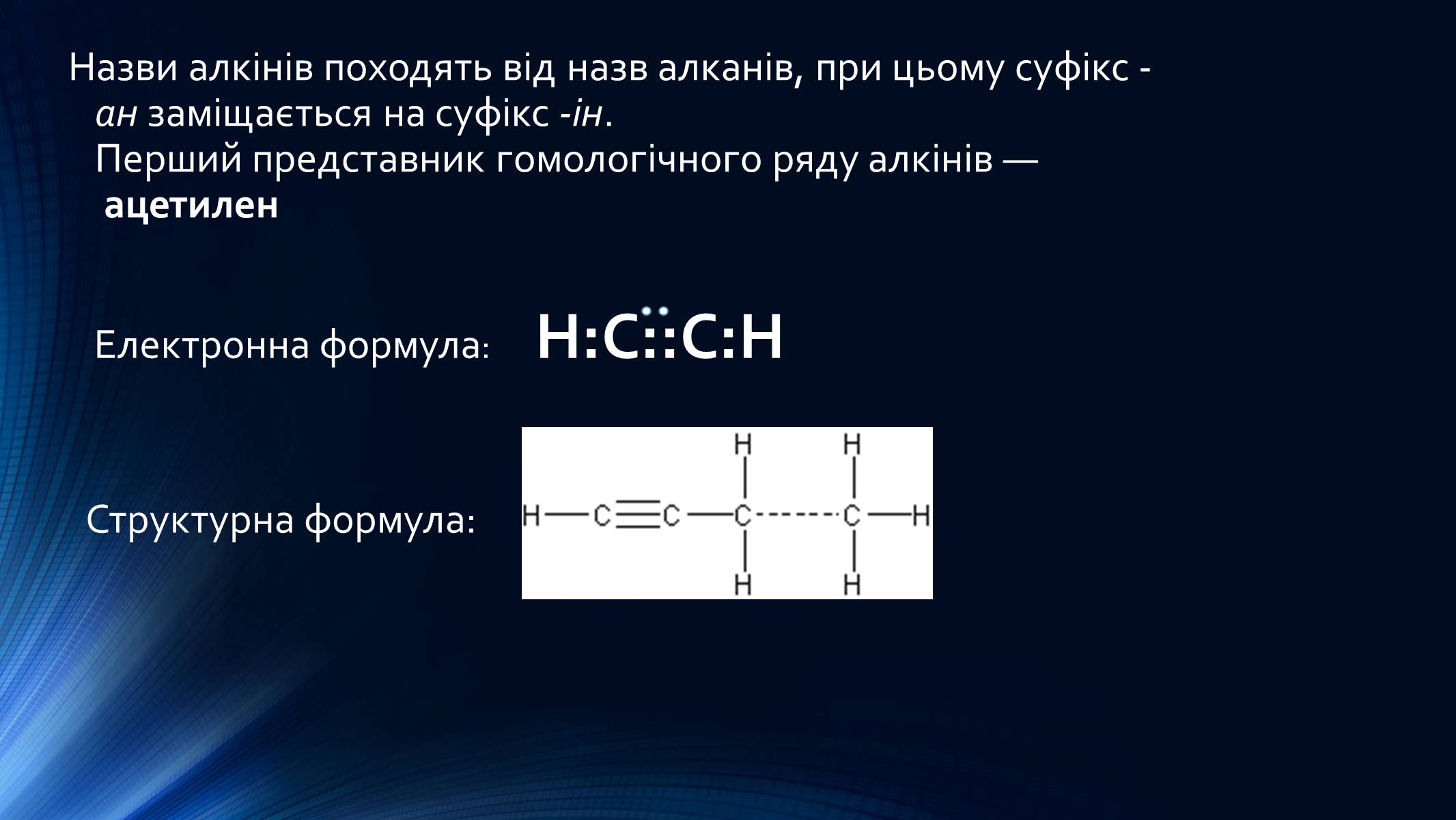
Назви алкінів походять від назв алканів, при цьому суфікс -ан заміщається на суфікс -ін.Перший представник гомологічного ряду алкінів — ацетилен
Електронна формула: Н:С::С:Н
Структурна формула:

Ацетилен:
3D модель найпростішого алкіну(ацетилену) ненасичений вуглеводень з одним потрійним зв'язком

Характеристика потрійного зв'язку:
Вид гібридизації – sp
Валентний кут – 180°
Довжина зв'язку С = С – 0,12 нм
Будова ─ лінійна
Вид зв'язку – ковалентний полярний
За типом перекриття хмар – δ і 2 π

Схема утворення sp -гібридних орбіталей:

Гомологічний ряд алкінів:
C2H2
C3H4
C4H6C5H8
C6H10
C7H12
C8H14
Етин Пропин
Бутин
Пентин
Гексин
Гептин

Структурна ізомерія алканів:
1. Ізомерія положення потрійного зв'язку (починаючи з С4Н6):
СН ССН2СН3 t СН3СССН3
бутин-1 бутин-2
2. Ізомерія карбонового скелету (починаючи з С5Н8):
СН ССН2СН2СН3tСН ССНСН3
СН3 пентин-1t 3-метилбутин-1
3. Міжкласова ізомерія з алкадієнами і циклоалкенами, (починаючи з С4Н8):
СН = СН
СН С–СН2–СН3t СН2=СН–СН=СН2t t
СН2 –СН2
бутин-1t бутадієн-1,3t циклобутен

Фізичні властивості
Фізичні властивості алкінів схожі на властивості алканів та алкенів. При звичайних умовах (С2-С4) — гази, (С5-С16) — рідини, починаючи із С17 — тверді речовини. Температури кипіння алкінів вищі, ніж у відповідних алкенів. Так, етилен має температуру кипіння -103 °С, ацетилен кипить при -83,6 °С; пропен і пропін відповідно при -47 СС і -23 °С.
Розчинність нижчих алкінів у воді трохи вища, ніж алкенів та алканів, однак усе-таки вона дуже мала. Алкіни добре розчиняються в різних органічних розчинниках.

Хімічні властивості
Хімічні властивості ацетилену і його гомологів визначаються наявністю в їх молекулах потрійного зв'язку. Найбільш характерні для алкінів реакціїї приєднання.

Реакції приєднання:
1. Галогенування
Знебарвлення бромної води є якісною реакцією на всі ненасичені вуглеводні.

2. Гідрогалогенування.
3. Гідрування.
4. Гідратація.
HgSO4
НCCH + H2O [HC=CH] CH3CH
t
H OHt O

Окиснення
Ацетилен і його гомологи окиснюються перманганатом калію з розщепленням потрійного зв'язку і утворенням карбонових кислот.
RCCR' + 3[O] + H2O RCOOH + R'COOH
Алкіни знебарвлюють розчин KMnO4, дана властивість використовується для їх якісного визначення.

Горіння ацетилену
При спалюванні (повному окисненні) ацетилену виділяється велика кількість тепла:HCCH + 2О2 2СО2 + Н2О + Q
Реакція заміщення
При взаємодії ацетилену (або RCCH) з аміачним
розчином оксиду срібла утворюються осади нерозчинних ацетиленідів:
HCCH + 2[Ag(NH3)2]OH AgCCAg + 4NH3 + 2H2O

Реакція полімеризації
1. Димеризація під дією водного розчину CuCl2 і NH4Cl:
НCCH + НCCH Н2C=CHCCH
(вінілацетилен)
2. Тримеризація ацетилену над активованим
вугіллям призводить до утворення бензолу (реакція Зелінського):
С, 600 С
3НCCH С6H6 (бензол)

Добування алкінів
Ацетилен добувають в промисловості двома способами:
1. Термічний крекінг метану:
1500С
2СН4 С2Н2 + 3Н2
2. Гідроліз карбіду кальцію:
CaC2 + 2H2O C2H2 + Ca(OH)2

Хімічні властивості ацетиленових вуглеводнів обумовлені природою потрійного зв'язку, хімічною поведінкою карбонових атомів у стані sp-гібридизації. Для них характерні реакції електрофільного приєднання, заміщення кінцевого атома Гідрогену, окиснення та відновлення, полімеризації.
Хімічні реакції алкінів
Реакція галогенування:
Реакція карболінірування:
Реакція ізомеризіції:
Реакція окиснювального приєднання:
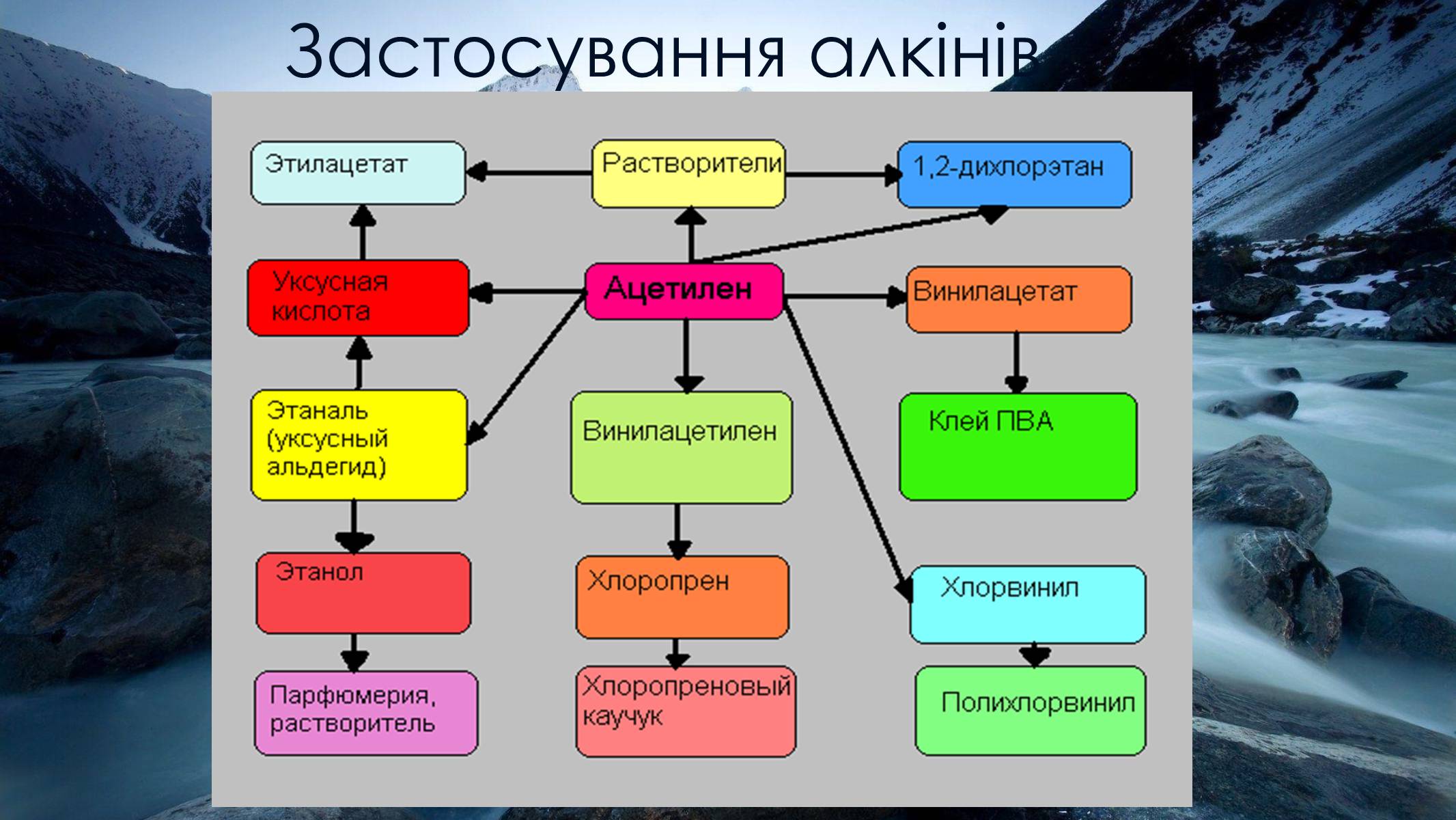
Застосування алкінів