Презентація на тему «Алкены»

Алкены
Презентация
по химии
Выполнила : ученица 9-Б класса
Луганской СОШ №20 Гуделайтис Анна

Алкены
Алкены - ациклические углеводороды, в молекуле которых кроме одинарных связей содержится одна двойная связь между атомами углерода.
CnH2n
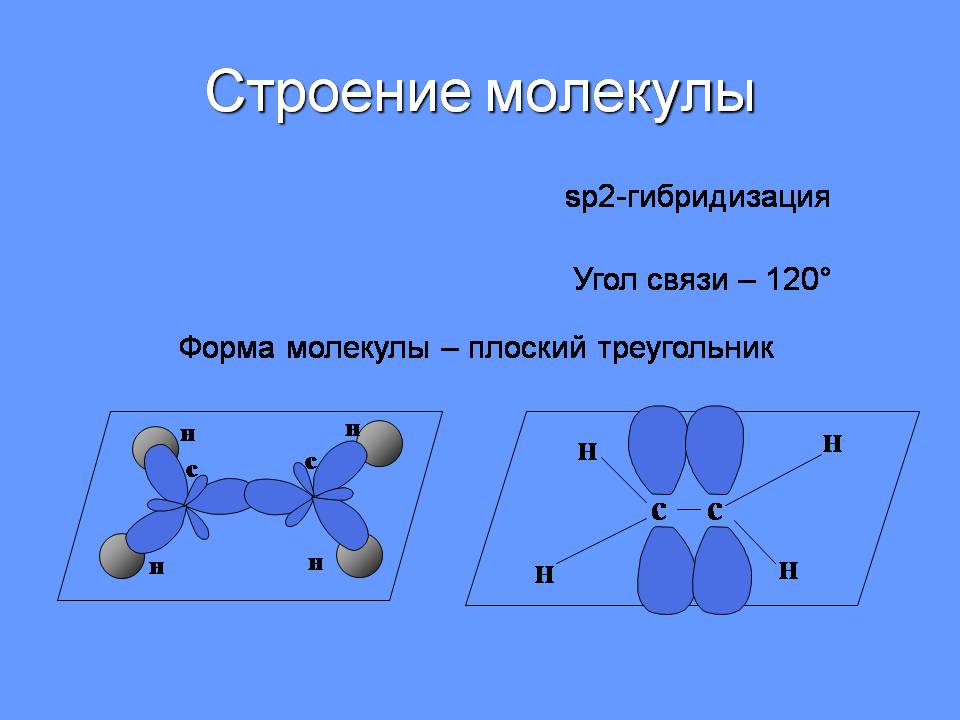
Строение молекулы
sp2-гибридизация
Угол связи – 120°
Форма молекулы – плоский треугольник
н
н
н
н
с
с
с
с
н
н
н
н

Физические свойства
Температуры плавления и кипения алкенов увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела.
Алкены не растворяются в воде, но хорошо растворимы в органических растворителях.

Химические свойства
Активные, благодаря способности двойной связи между атомами Карбона легко разрушаться и превращаться в простую связь
Галогенирование
Гидратация
Алкилирование
Гидрирование
Окисление неорганическими окислителями в мягких условиях
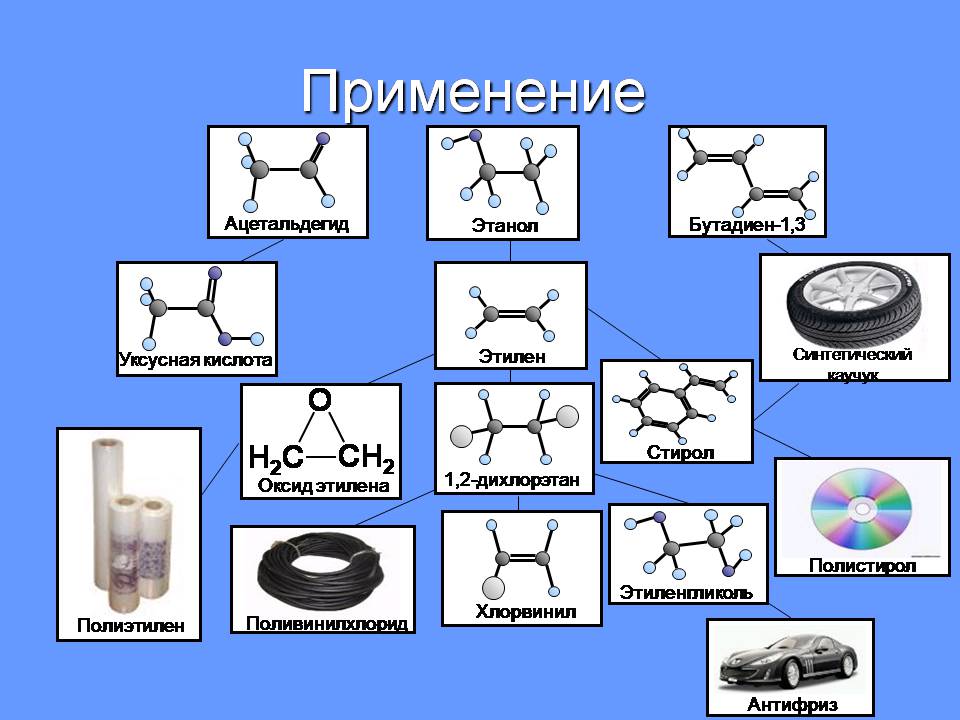
Применение
Ацетальдегид
Этанол
Бутадиен-1,3
Этилен
Синтетический каучук
Уксусная кислота
Стирол
Полистирол
О
СН2
Н2С
Оксид этилена
Полиэтилен
1,2-дихлорэтан
Хлорвинил
Поливинилхлорид
Этиленгликоль
Антифриз

Получение алкенов
• Дегидрирование алканов
• Дегидратация спиртов
• Реакция Виттига
• Реакция Чугаева

Нахождение в природе
•В природе ациклические алкены практически не встречаются.
•Простейший представитель этого класса органических соединений — этилен — является гормоном для растений и в незначительном количестве в них синтезируется.

История открытия
Впервые этилен был получен в 1669 г. немецким химиком и врачом Бехером действием серной кислоты на этиловый спирт. Ученый установил, что его «воздух» более химически активен, чем метан, однако, идентифицировать полученный газ он не смог и названия ему не присвоил.
Вторично и тем же способом «воздух Бехера» был получен и описан голландскими химиками Дейманом, Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795 г. Они назвали его «маслородным газом» так как при взаимодействии с хлором, он образовывал маслянистую жидкость — дихлорэтан. Французский химик Антуан Фуркруа ввёл этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало общим для всего класса олефинов (или, по современной номенклатуре, алкенов).
В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из «маслородного» газа и воды. Этот же газ он обнаружил и в хлористом этиле. В 1828 г. Ж.Дюма и П. Буллей предположили, что этилен представляет собой основание, способное давать соли подобно аммиаку. Я.Берцелиус принял эту идею, назвав соединение «этерином» и обозначив буквой E.
Определив, что этилен состоит из водорода и углерода, долгое время химики не могли выписать его настоящую формулу. В 1848 г. Кольбе писал формулу этилена как С4Н4, этого же мнения придерживался и Либих. Ж.Дюма правильно определил состав вещества, но его структура по-прежнему была описана неверно: С2НН3.
В 1862 г. немецкий химик-органик Э.Эрленмейер предположил наличие в молекуле этилена двойной связи, а в 1870 г. известный российский ученый А. Бутлеров признал эту точку зрения правильной, подтвердив её природу экспериментально