Презентація на тему «Алкани, алкени, алкіни»

Алкани, алкени, алкіни
Презентацію підготувала
учениця 11-А класу
Трачук Олеся

Алкани – це насичені вуглеводні з відкритим карбоновим ланцюгом.
Вони утворюють гомологічний ряд із загальною формулою:
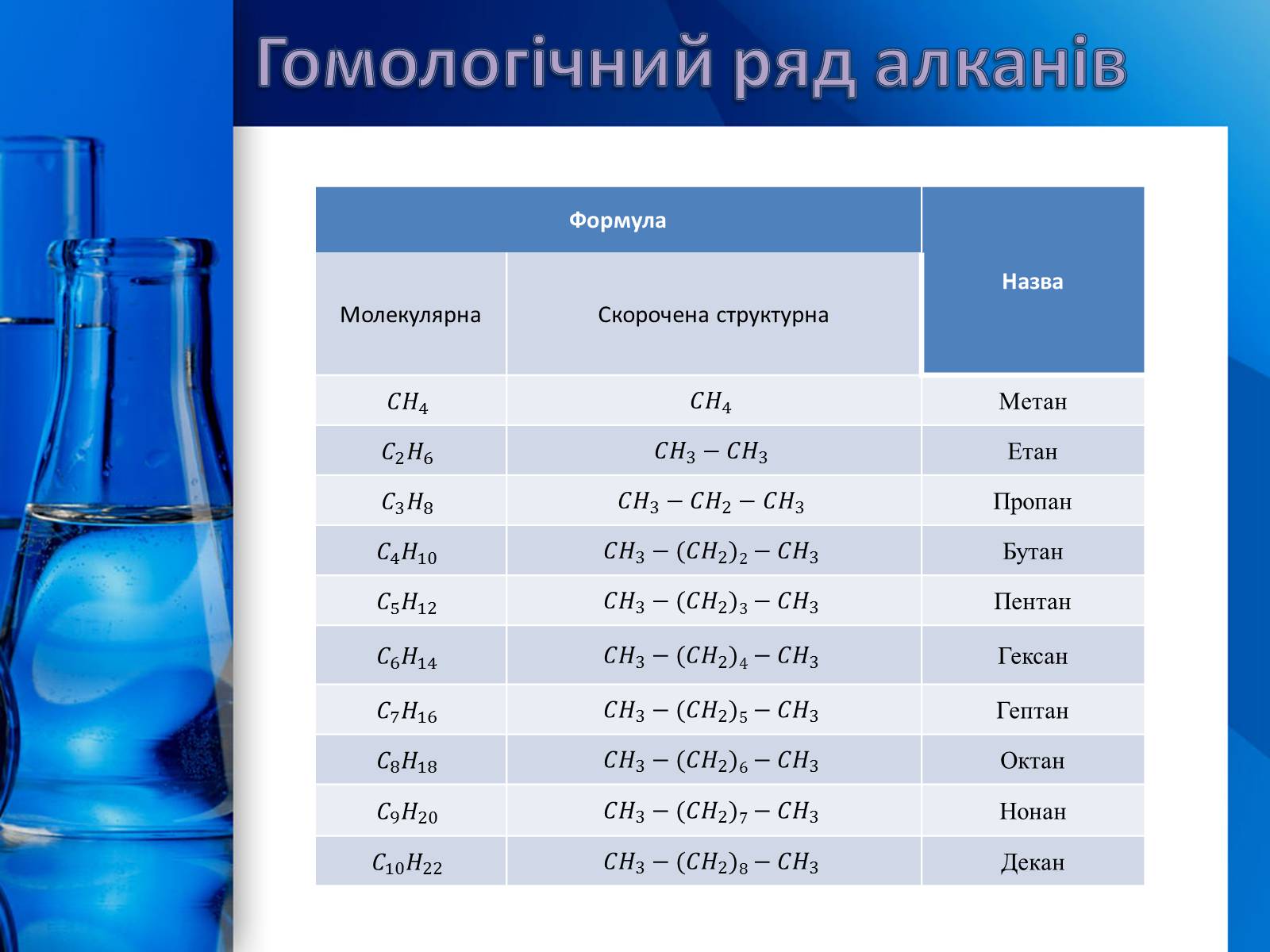
Гомологічний ряд алканів
Формула
Назва
Молекулярна
Скорочена структурна
Метан
Етан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Нонан
Декан
Формула
Назва
Молекулярна
Скорочена структурна
Метан
Етан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Нонан
Декан

Вибір головного ланцюга:
І
2. Нумерація атомів головного ланцюга:
1 2 3
І
3. Дати назву головному ланцюгу за кількістю атомів Карбону.
Номенклатура алканів

4. Дати назву замісникам в алфавітному порядку та вказати їх знаходження в головному ланцюзі:
1 2 3
І
- метил
5. Формування назви:
1 2 3
І
2-метилпропан

Усі атоми Карбону в молекулах алканів знаходяться у стані - гібридизації. Молекула метану має форму тетраедра.
Кути між осями симетрії σ-зв'язків, які утворює атом Карбону в стані - гібридизації, дорівнюють . Молекули алканів нерозгалудженої будови мають не лінійну, а зигзагоподібну форму:
Будова молекул алканів
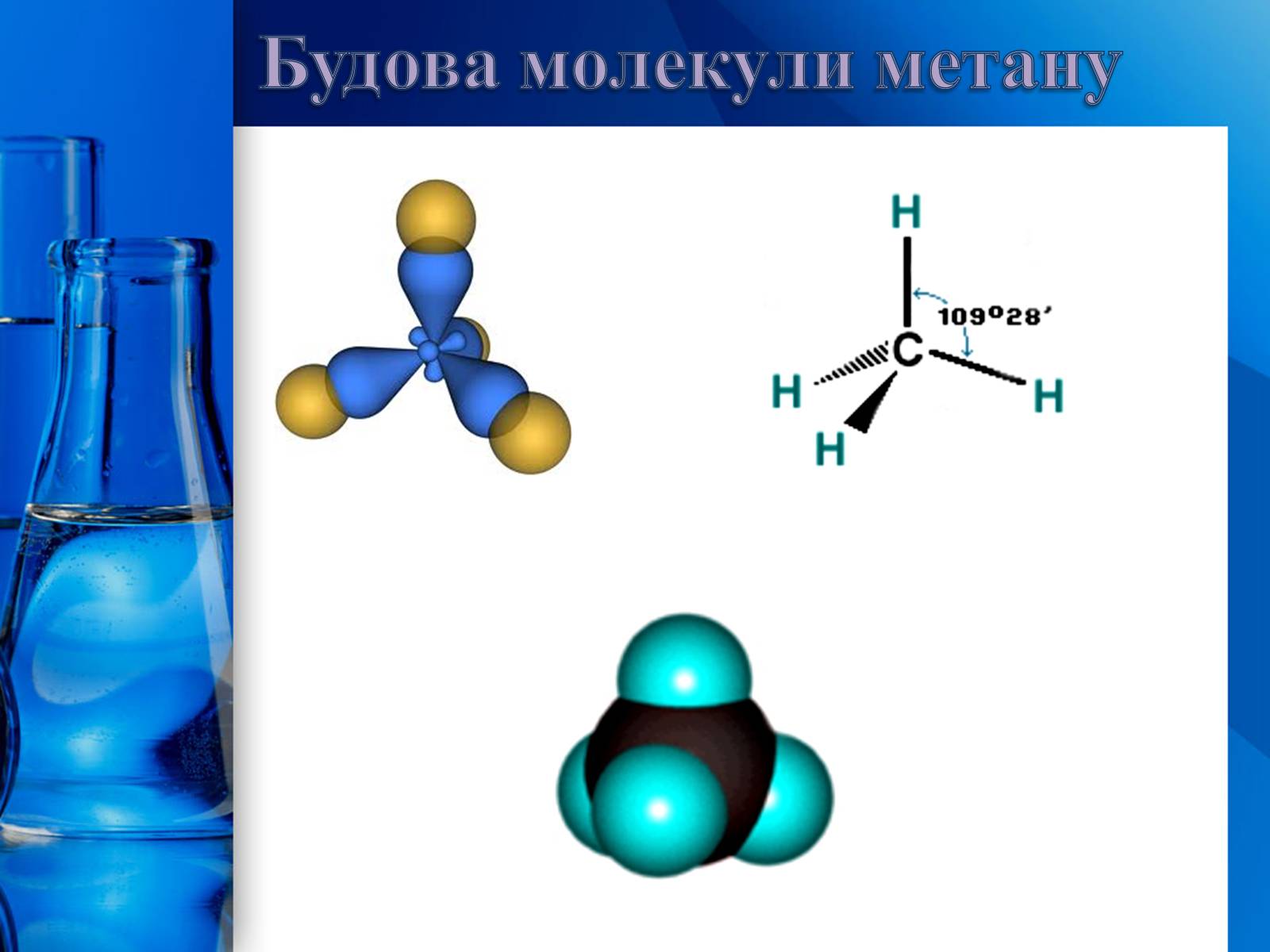
Будова молекули метану

Для алканів здебільшого характерні структурні ізомери. Перші три члени гомологічного ряду алканів мають тільки по одному ізомеру. Тим часом бутан має вже два ізомери:
Пентан має вже три ізомери:
Ізомери алканів
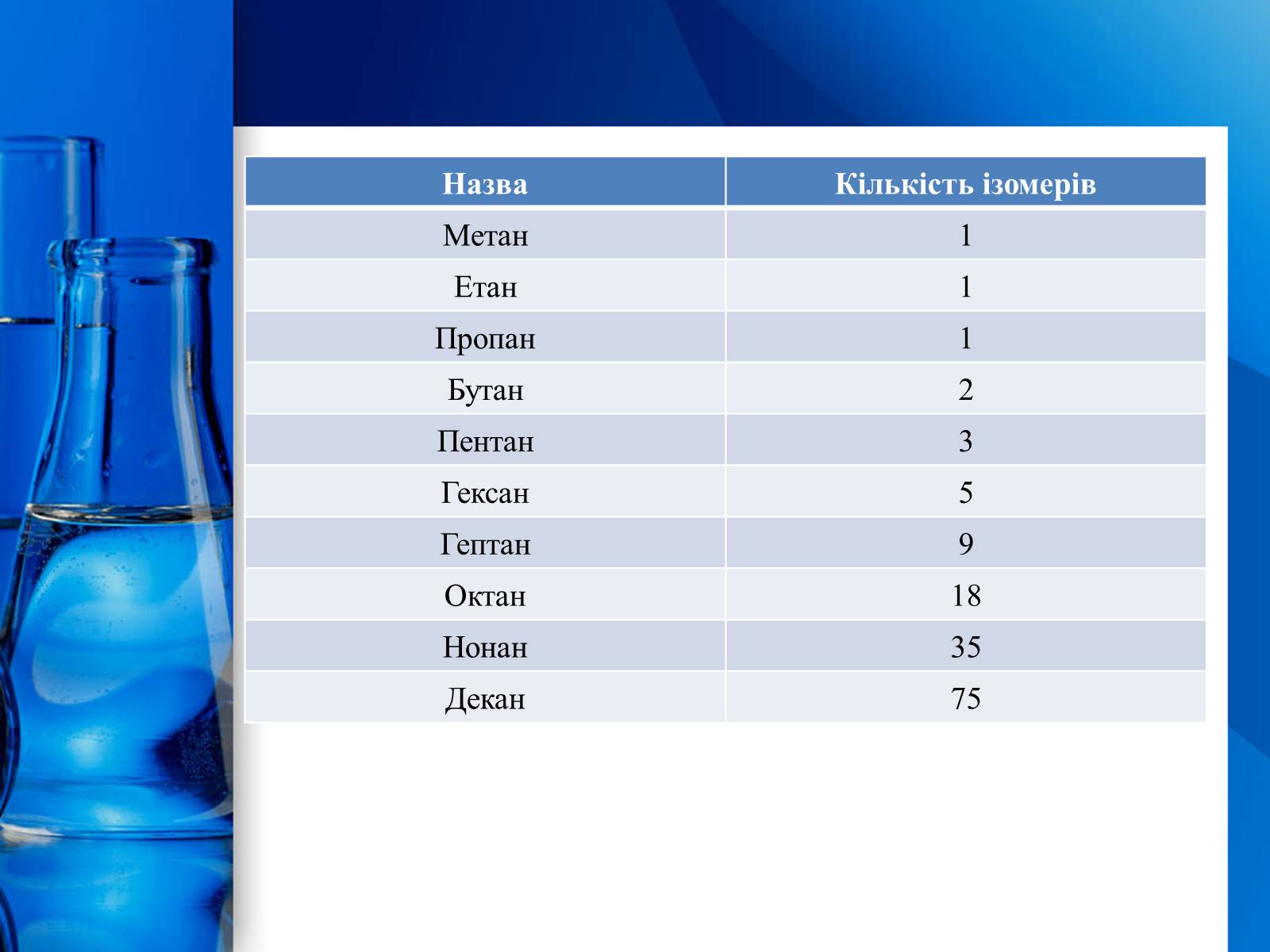
Назва
Кількість ізомерів
Метан
1
Етан
1
Пропан
1
Бутан
2
Пентан
3
Гексан
5
Гептан
9
Октан
18
Нонан
35
Декан
75

Алкани доволі поширені в природі.
У промисловості переважну більшість алканів добувають фракційною перегонкою нафтопродуктів і газового конденсату, який утворюється під час очищення природного газу. Метан у промисловості можна отримати також за реакцією між воднем і графітом при 500оС за наявності каталізатора (нікелю):
C CH4
Синтезом із водню і карбон (ІІ) оксиду, які входять до складу водяного газу:
Способи добування алканів
Ni
t

У лабораторних умовах метан добувають взаємодією алюміній карбіду з водою (а) або нагріванням суміші натрій ацетату з натрій гідроксидом (б):
Al4C3 + 12H2O 4Al(OH)3 + 3CH4 (а)
CH3COONa + NaOH Na2CO3 + CH4 (б)
Інші алкани можна отримати взаємодією металічного натрію з моногалогенпохідними алканів (реакція Вюрца):
2H3C–CH2–Br +2Na H3C–CH2–CH2–CH3 + 2NaBr
t
t

У молекулах алканів є лише неполярні й доволі міцні σ-зв'язки C – C і C – H. Тому сполуки малоактивні в хімічних реакціях. Однак за жорстких умов (висока температура, підвищений тиск, ультрафіолетове опромінення тощо) ці сполуки можуть вступати в деякі реакції:
повне окиснення (горіння):
2H3C–CH3 + 7O2 4CO2 + 6H2O
2. часткове окиснення (каталітичне окиснення):
H3C–(CH2)n–CH3 суміш оксигеновмісних сполук
3. розкладання:
H3C – CH3 2C + 3H2
Хімічні властивості алканів
t

4. заміщення:
CH4 + Cl2 CH3 – Cl + HCl
CH4 + HONO2 CH3–NO2 + H2O
5. ізомеризація:
H3C – CH2 – CH2 – CH3 H3C – CH – CH3
I
CH3
t/AlCl3
t
hv
Формула
Назва
Температура, оС
Агрегатний стан
Моле-кулярна
Скорочена структурна
Плавле-ння
кипіння
Метан
-182
-162
газ
Етан
-183
-89
газ
Пропан
-187
-42
газ
Бутан
-138
-0,5
газ
Пентан
-130
+36
рідина
Гексан
-95
+69
рідина
Гептан
-91
+98
рідина
Октан
-57
+126
рідина
Нонан
-54
+151
рідина
Декан
-30
+174
рідина
Формула
Назва
Температура, оС
Агрегатний стан
Моле-кулярна
Скорочена структурна
Плавле-ння
кипіння
Метан
-182
-162
газ
Етан
-183
-89
газ
Пропан
-187
-42
газ
Бутан
-138
-0,5
газ
Пентан
-130
+36
рідина
Гексан
-95
+69
рідина
Гептан
-91
+98
рідина
Октан
-57
+126
рідина
Нонан
-54
+151
рідина
Декан
-30
+174
рідина
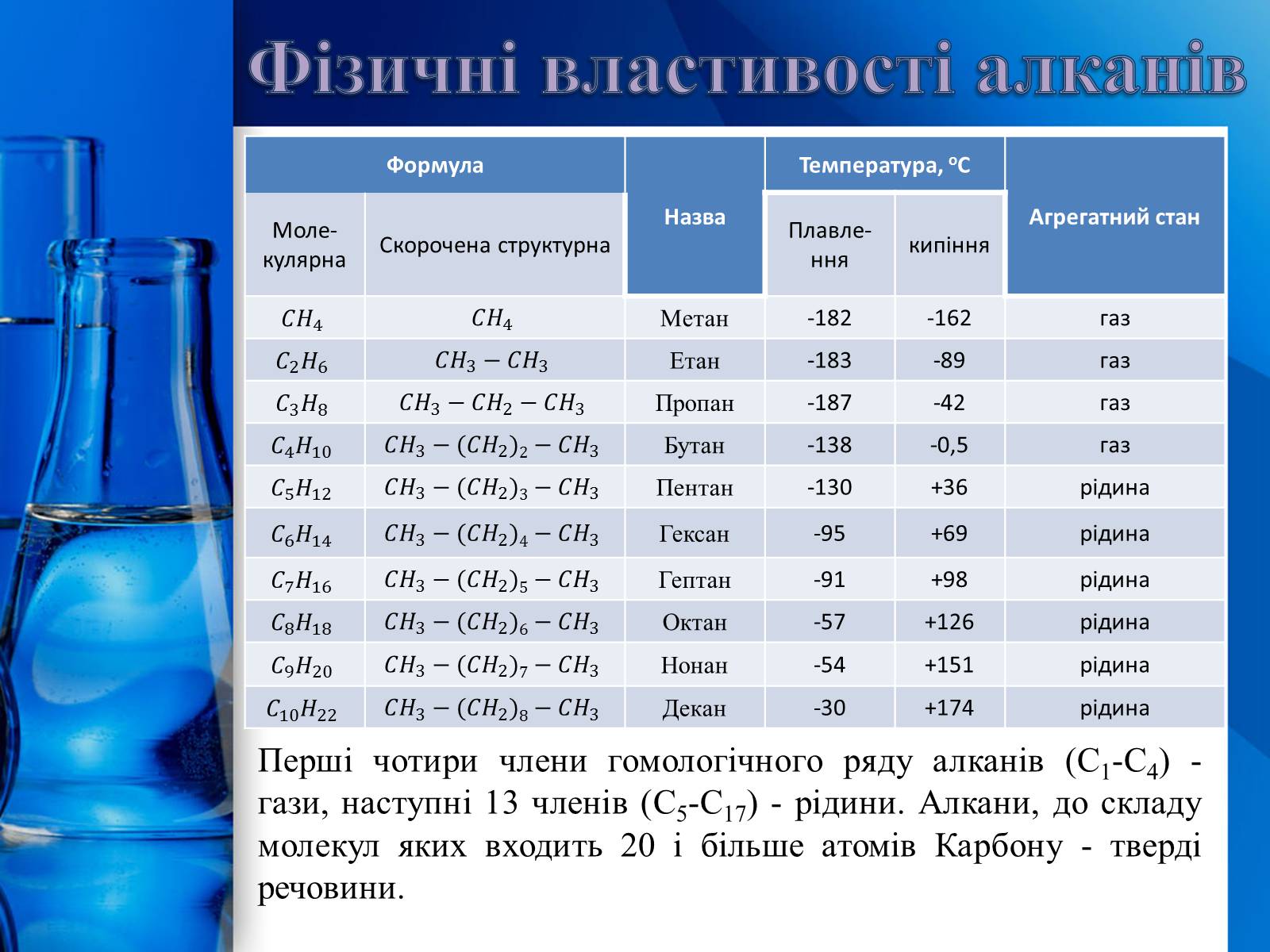
Фізичні властивості алканів
Перші чотири члени гомологічного ряду алканів (С1-С4) - гази, наступні 13 членів (С5-С17) - рідини. Алкани, до складу молекул яких входить 20 і більше атомів Карбону - тверді речовини.

Застосування алканів
Алкани широко використовують у різних галузях промисловості і сільського господарства. Метан є сировиною для отримання багатьох хімічних продуктів, паливом на підприємствах і в побуті. З вищих алканів добувають ароматичні вуглеводні, застосовують як паливо для двигунів внутрішнього згорання (бензини), для дизельних двигунів (солярові масла), реактивних двигунів (гас). Насичені вуглеводні – добрі розчинники жирів і деяких інших органічних речовин.

Алкени – це ненасичені вуглеводні, в молекулах яких є один подвійний зв'язок. Гомологічний ряд алкенів має загальну формулу:
Алкени
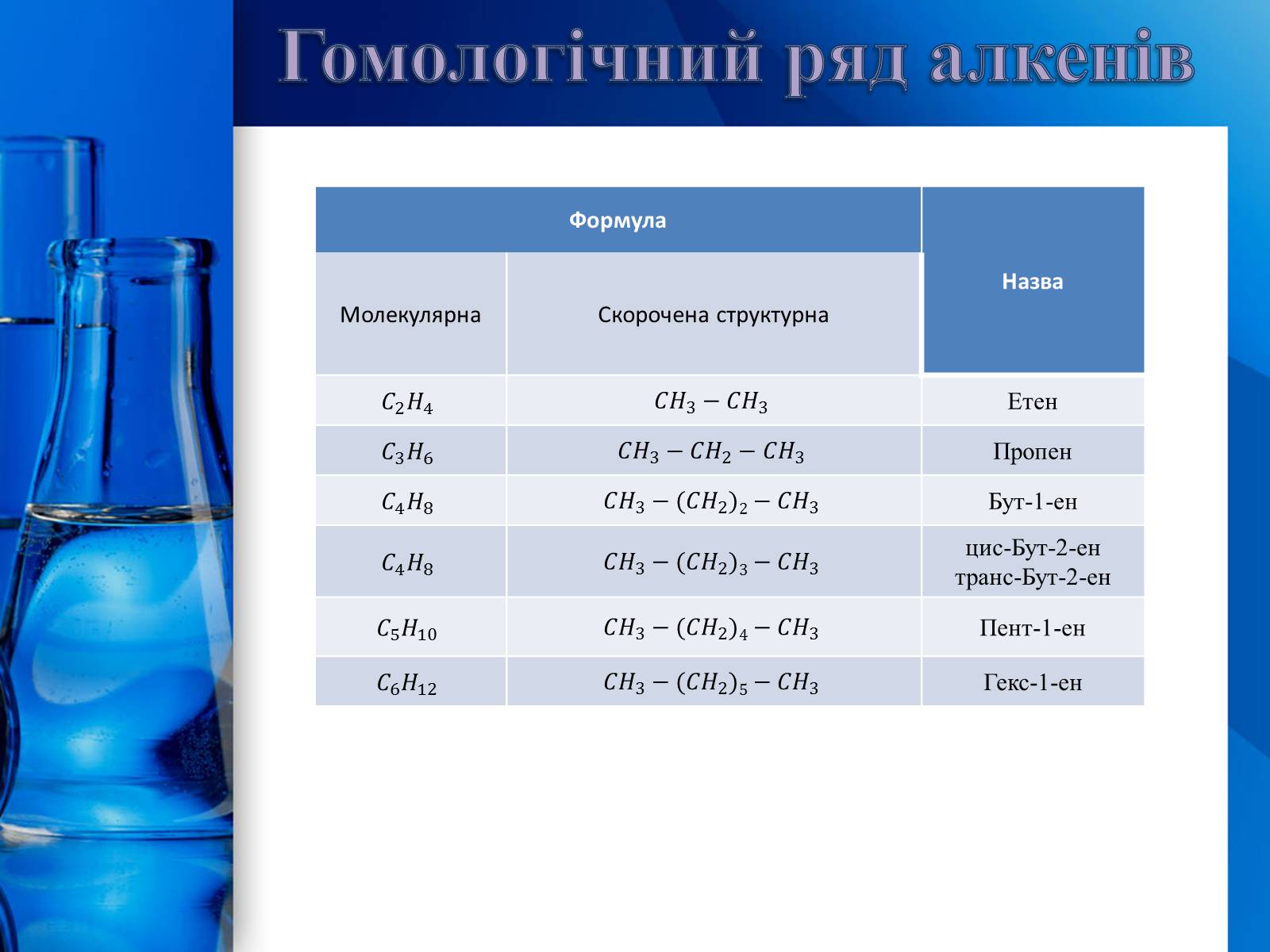
Гомологічний ряд алкенів
Формула
Назва
Молекулярна
Скорочена структурна
Етен
Пропен
Бут-1-ен
цис-Бут-2-ен
транс-Бут-2-ен
Пент-1-ен
Гекс-1-ен
Формула
Назва
Молекулярна
Скорочена структурна
Етен
Пропен
Бут-1-ен
цис-Бут-2-ен
транс-Бут-2-ен
Пент-1-ен
Гекс-1-ен

У алкенах з нерозгалуженим карбоновим ланцюгом нумерацію атомів Карбону починають із того кінця, до якого ближче перебуває подвійний зв'язок. У назві відповідного алкану закінчення -ан замінюється на -ін (-ин). У розгалужених алкенах головний ланцюг вибирають так, щоб він містив подвійний зв'язок, навіть якщо він при цьому й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення подвійного зв'язку, наприклад:
Номенклатура алкенів

Будова молекул алкенів
Характерна риса будови алкенів – наявність в молекулі одного подвійного карбон-карбонового зв'язку. Подвійний зв'язок утвориться за допомогою двох пар узагальнених електронів (чьотирьох-електронний зв'язок). Карбонові атоми, зв'язані подвійним зв'язком, знаходяться в стані sр2-гібридизації, кожний з них утворює три -зв'язки, що лежать в одній площині під кутом 120°. Негібридизовані орбіталі р-електронів розташовані перпендикулярно до площини -зв'язків і паралельно один одному і внаслідок «бічного» перекривання утворюють другий зв'язок, який називається -зв'язком. Електронна хмара -зв'язку частково розташована над площиною, а частково під площиною, у якій лежать атоми. Таким чином, подвійний зв'язок являє собою сполучення - і -зв'язків. Бічне перекривання негібридизованних р-орбіталей, що утворюють -зв'язок, зближує атоми Карбону і відстань між ними стає коротшою – довжина подвійного С=С-зв'язку 0,133 нм (довжина простого С-С-зв'язку 0,154 нм). Схема розташування атомів і зв'язків у молекулі етилену:
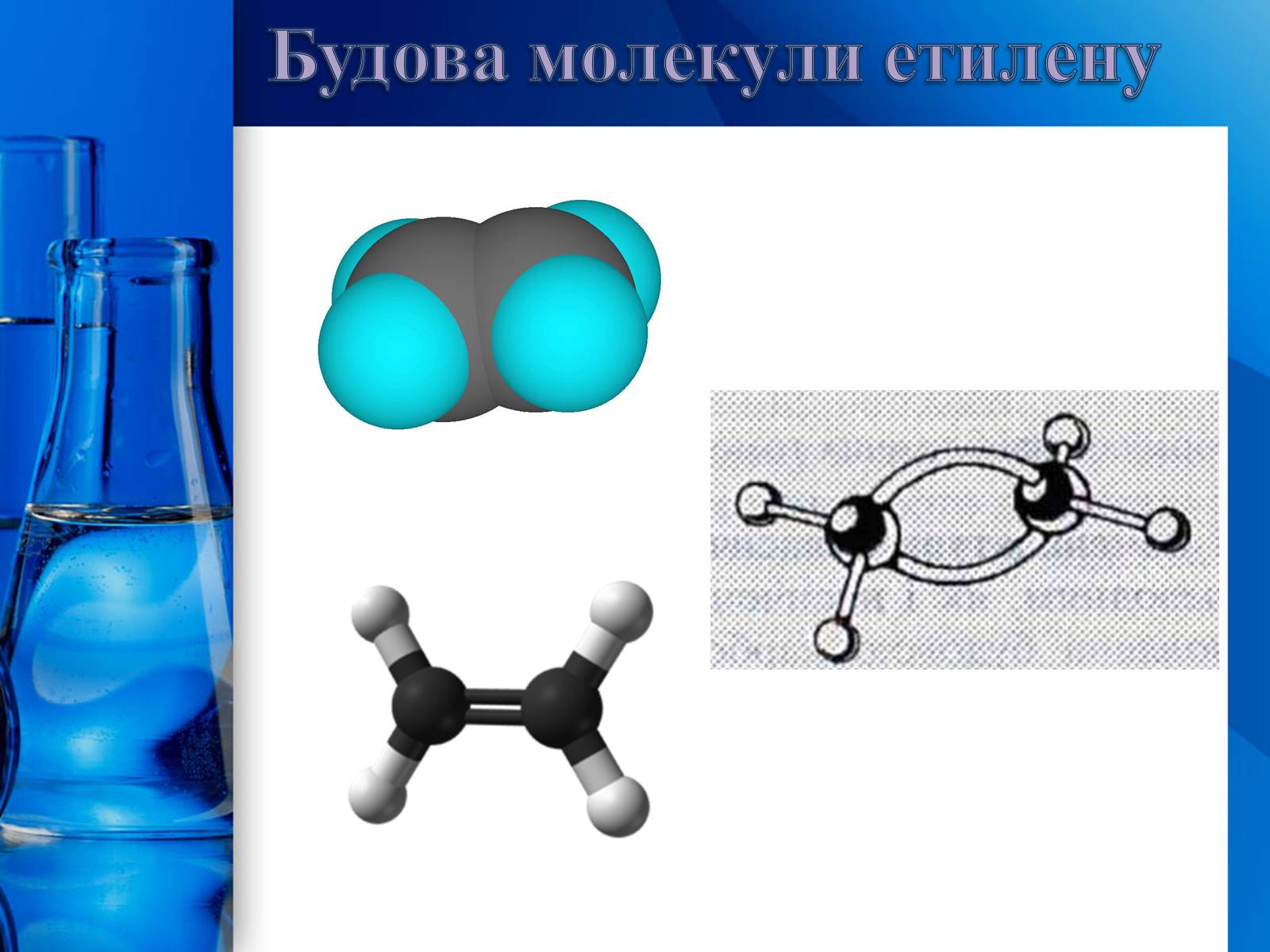
Будова молекули етилену

Ізомери алкенів
Структурні ізомери алкенів можуть відрізнятися будовою карбонового ланцюга і положенням подвійного зв'язку. Так, для бутену С4Н8 відомі три ізомери:
СН2 = СН – СН2 – СН3 (бут-1-ен)
СН3 – СН = СН – СН3 (бут-2-ен)
СН2=С–СН3 (метил-пропен)
СН3
Цей приклад показує, що число ізомерів у алкенів вище, ніж у алканів.
Для етиленових сполук можлива просторова ізомерія, що пов'язана з розташуванням замісників стосовно площини подвійного зв'язку. Ця ізомерія спостерігається в тих випадках, коли кожний з атомів Карбону, зв'язаних подвійним зв'язком, витрачає інші дві одиниці валентності на зв'язок із двома різними замісниками. Розташування пари однакових замісників по одну сторону площини подвійного зв'язку дає цис-ізомер, по різні сторони — транс-ізомер, наприклад:

(цис-бут-2-ен (tпл = –139,3°С, tкип = +3,7°С))
(транс-бут-2-ен(tпл= –105,8°С, tкип= +0,96°С))
Перетворення цих ізомерів один в одного вимагає обертання навколо подвійного зв'язку, тобто необхідно порушити перекривання р-орбіталей і розірвати -зв'язок. На це потрібно затратити понад 250 кДж/моль енергії. Такий енергетичний бар'єр утруднює обертання й обумовлює існування цис-транс-ізомерів як стійких індивідуальних речовин. Природа цієї ізомерії така ж, як у заміщених циклах.
Як правило, транс-ізомери більш стійкі, мають більш високу температуру плавлення. При нагріванні цис-транс-ізомери можуть переходити один в одний: між ними встановлюється рівновага.

Способи добування алкенів
Подвійний C=C-зв'язок утворюється внаслідок відщеплення двох замісників від сусідніх атомів Карбону насичених сполук. Зокрема, алкени є продуктами таких реакцій:
1. відщеплення галогеноводню від моногалогенпохідних алкану:
HC3 – CH – CH2 + NaOH H3C – CH=CH2 + NaCl + H2O
H Cl
2. відщеплення галогену від дигалогенпохідних алканів, у яких атоми галогену зв'язані з сусідніми атомами Карбону:
H3C – CH – CH – CH3 + Zn H3C – CH = CH – CH3 + ZnCl2
Cl Cl
3. відщеплення води від спиртів:
H2C – CH2 H2C = CH2 + H2O
H OH
4. відщеплення водню від алканів (дегідрогенізація):
H2C – CH2 H2C = CH2 + H2O
H H
Спирт
t
H2SO4, >140
5

У промисловості значні кількості алкенів отримують крекінгом нафтопродуктів. Внаслідок крекінгу алканів утворюється 50% алканів і 50% алкенів.
Під час крекінгу С – С зв'язок може розриватися у будь-якому положенні, тому утворюється складна суміш насичених і ненасичених сполук.

Хімічні властивості алкенів
Через наявність подвійного С = С-зв'язку алкени хімічно значно активніші за алкани. Більшість хімічних реакцій алкенів пов'язана з розриванням зв'язку.
Реакції приєднання:приєднання водню (гідрогенізація):H3C – CH = CH2 +H2 H3C – CH2 – CH3 приєднання галогенів:H2С = CH2 + Cl2 ClH2C – CH2Clприєднання галогеноводнів:H3C – CH = CH – CH2 + HCl H3C – CHCl – CH3 приєднання води (гідратація):H3C – CH = CH2 + H2O H3C – CH – CH3 OH
Реакції окиснення:часткове окиснення:H2С = CH2 + 2KMnO4 + 4H2O 3H2C – CH2 + 2MnO4 + 2KOHповне окиснення (горіння):H2С = CH2 + 3O2 2CO2 + 2H2O
кат.
H2SO4 (конц.), t
[OH-]

3. Реакції полімеризації:
Алкени, як й інші ненасичені сполуки, вступають у реакції полімеризації. Внаслідок полімеризації утворюються високомолекулярні сполуки (полімери). Етен за високого тиску й підвищеної температури утворює поліетилен:nH2C=CH2 n
(–CH2 – CH2 –)
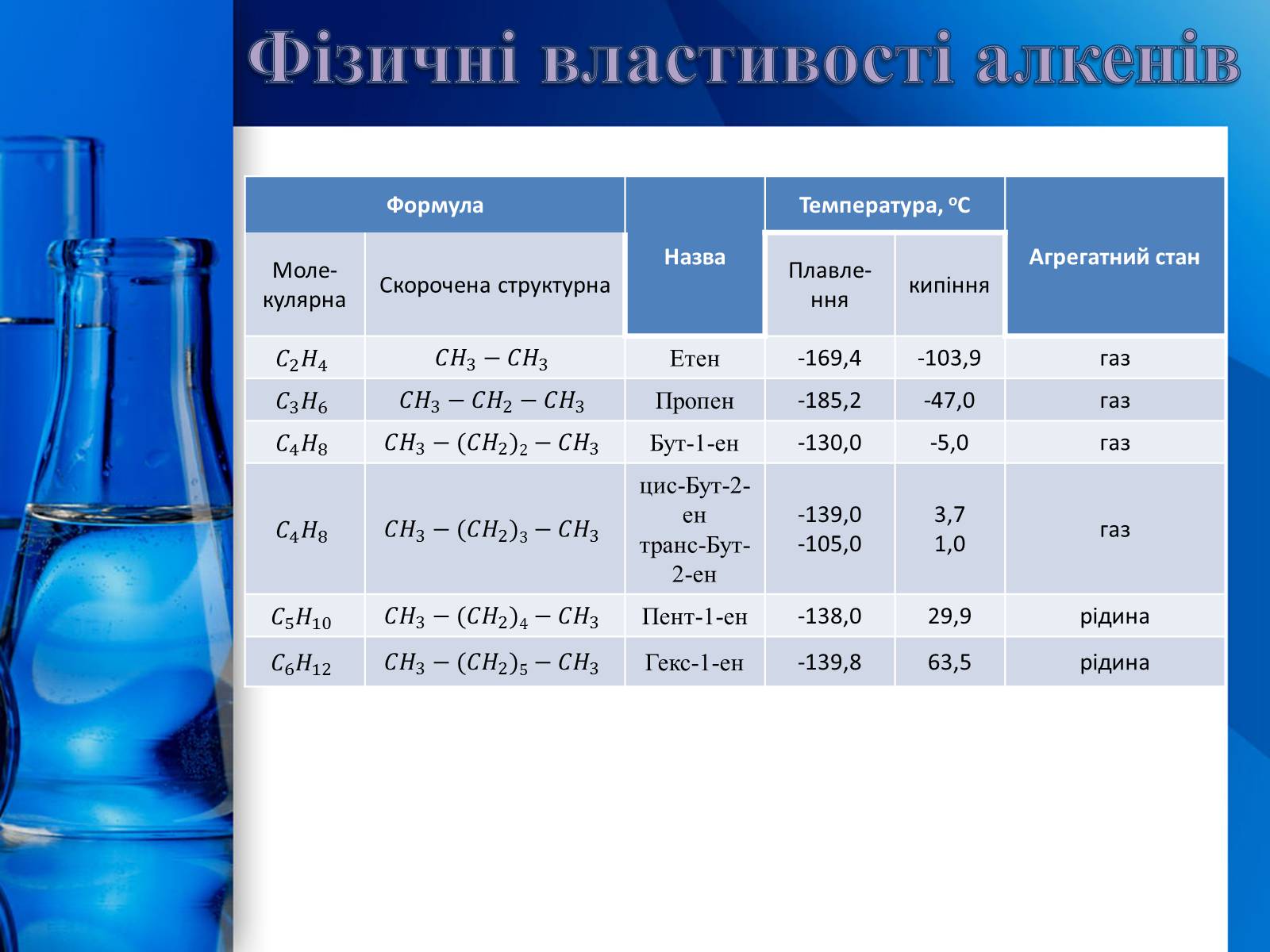
Фізичні властивості алкенів
Формула
Назва
Температура, оС
Агрегатний стан
Моле-кулярна
Скорочена структурна
Плавле-ння
кипіння
Етен
-169,4
-103,9
газ
Пропен
-185,2
-47,0
газ
Бут-1-ен
-130,0
-5,0
газ
цис-Бут-2-ен
транс-Бут-2-ен
-139,0
-105,0
3,7
1,0
газ
Пент-1-ен
-138,0
29,9
рідина
Гекс-1-ен
-139,8
63,5
рідина
Формула
Назва
Температура, оС
Агрегатний стан
Моле-кулярна
Скорочена структурна
Плавле-ння
кипіння
Етен
-169,4
-103,9
газ
Пропен
-185,2
-47,0
газ
Бут-1-ен
-130,0
-5,0
газ
цис-Бут-2-ен
транс-Бут-2-ен
-139,0
-105,0
3,7
1,0
газ
Пент-1-ен
-138,0
29,9
рідина
Гекс-1-ен
-139,8
63,5
рідина

Застосування алкенів
Алкени широко використовують у промисловості органічного синтезу для отримання різноманітних речовин. Наприклад, етен є сировиною для добування етанолу, 1,2-дихлоретану, поліетилену. Його використовують у сільському господарстві для прискорення дозрівання плодів. Пропен є сировиною для отримання пропан-2-олу, ацетону, гліцеролу і поліпропілену.

Алкіни – це ненасичені вуглеводні, у молекулах яких є один потрійний зв'язок. Вони утворюють гомологічний ряд із загальною формулою:
Алкіни
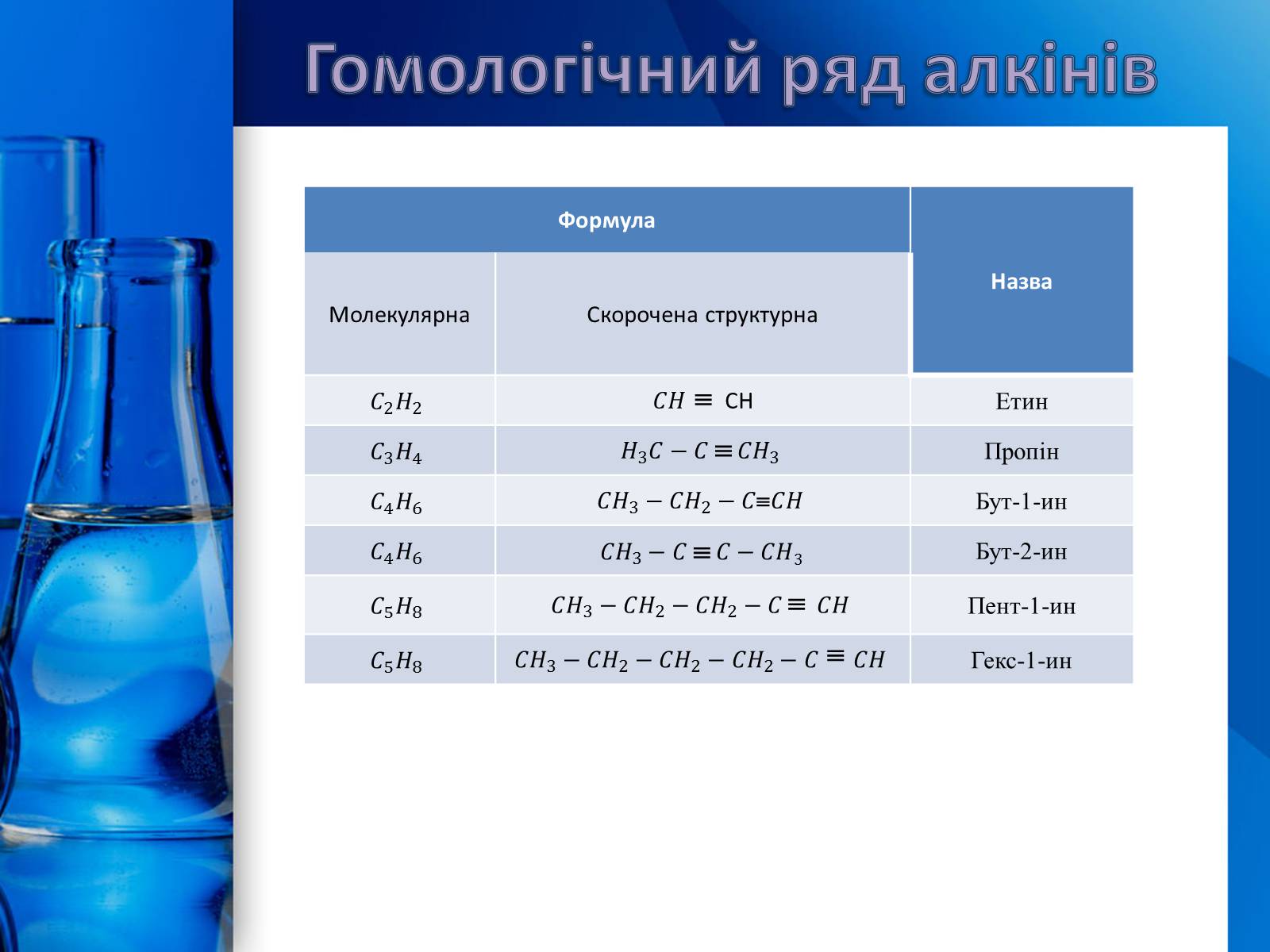
Гомологічний ряд алкінів
Формула
Назва
Молекулярна
Скорочена структурна
CH
Етин
Пропін
Бут-1-ин
Бут-2-ин
Пент-1-ин
Гекс-1-ин
Формула
Назва
Молекулярна
Скорочена структурна
Етин
Пропін
Бут-1-ин
Бут-2-ин
Пент-1-ин
Гекс-1-ин

Номенклатура алкінів
Назви алкінів утворюють із назв відповідних насичених вуглеводнів заміною суфікса -ан на суфікс -ин (-ін). Якщо молекула алкіну розгалужена, головним ланцюгом вважають найдовший із тих, що містить потрійний зв'язок. Нумерують атоми Карбону головного ланцюга з того краю, до якого ближче знаходиться потрійний зв'язок.

Будова молекул алкінів
Утворення потрійного зв'язку можливе лише тоді, коли два поряд розміщені атоми Карбону знаходяться у третьому валентному стані (sp3-гібридизація). У цьому стані осі симетрії двох гібридних орбіталей утворюють одну пряму лінію (180о). Отже, кожен атом Карбону в такому разі може утворювати два -зв'язки, спрямовані в протилежні боки. У молекулі ацетилену всі чотири атоми (два атоми Карбону і два атоми Гідрогену) розміщені на одній прямій, тобто вона має лінійну будову. Оскільки у третьому валентному стані атом Карбону має дві р-орбіталі, що не брали участі в процесі гібридизації, він додатково може утворити два π-зв'язки. Отже, потрійний зв'язок складається з одного -зв'язку і двох π-зв'язків.
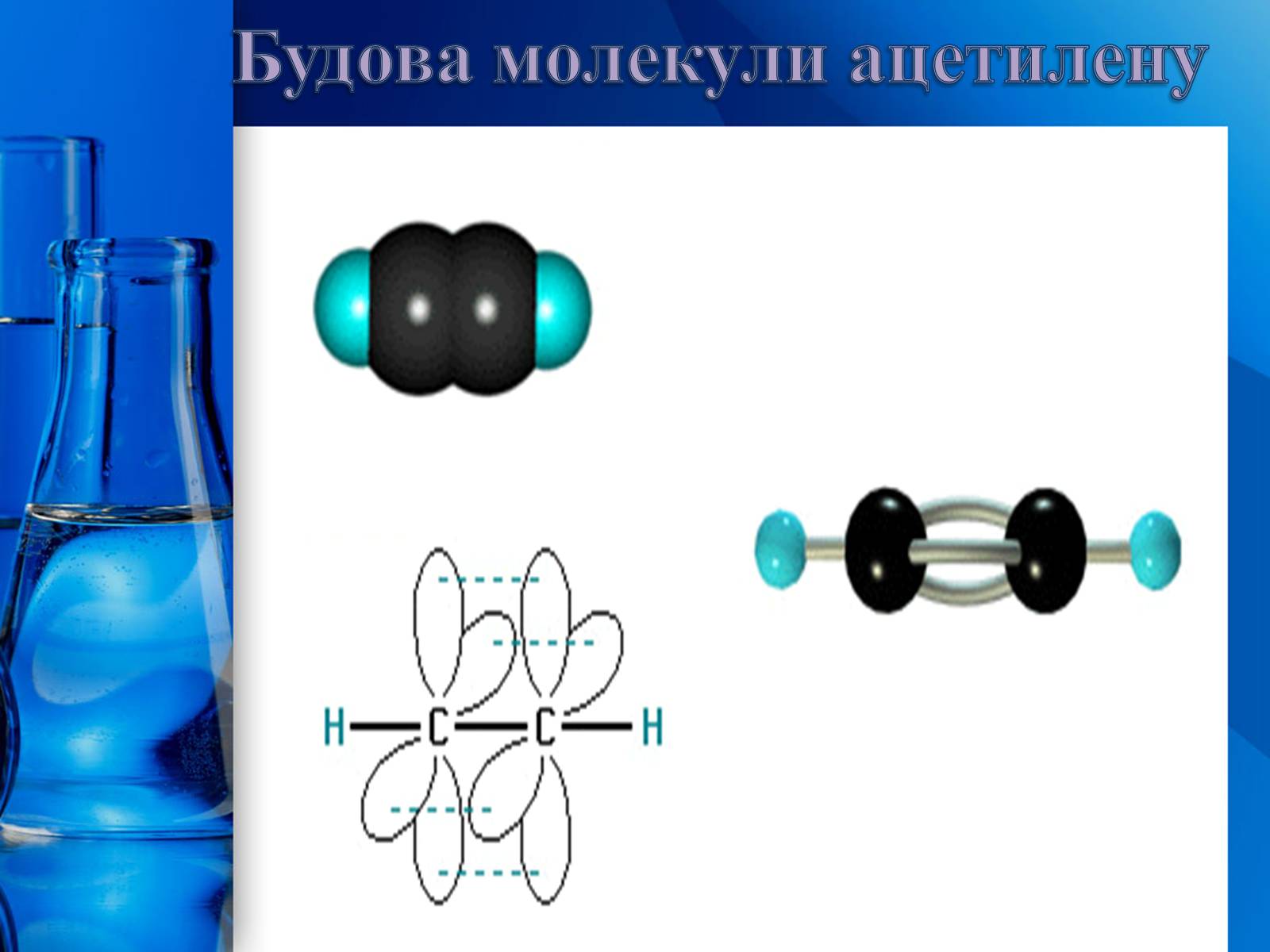
Будова молекули ацетилену

Ізомери алкінів
Структурна ізомерія
1. Ізомерія положення потрійного зв'язку (починаючи з С4Н6):
СН ССН2СН3 t СН3СССН3
бутин-1 бутин-2
2. Ізомерія карбонового скелету (починаючи з С5Н8):
СН ССН2СН2СН3tСН ССНСН3
СН3
пентин-1t 3-метилбутин-1
3. Міжкласова ізомерія з алкадієнами і циклоалкенами, (починаючи з С4Н8):
СН = СН
СН С–СН2–СН3t СН2=СН–СН=СН2
СН2 –СН2
бутин-1t бутадієн-1,3t циклобутен

Способи добування алкінів
Найпоширеніший представник алкінів – ацетилен. У промисловості його добувають трьома методами.
Карбідний метод. Спочатку з вапняку і коксу отримують кальцій карбід, який під час взаємодії з водою утворює ацетилен.
CaCO3 CaO + CO2
CaO + 3C CaC2 + CO
CaC2 + 2H2O CH CH + Ca(OH)2
Піроліз метану. Внаслідок нагрівання метану без доступу повітря (піроліз) утворюється ацетилен, а як побічний продукт – водень.
2CH4 CH CH + 3H2
Дегідрогалогенування дигалогенопохідних алканів.
t
2500Oc
1500Oc

Хімічні властивості алкінів
Хімічні властивості алкінів обумовлені наявністю в їхніх молекулах потрійного зв'язку. Типовими реакціями для ацетилену та його гомологів є реакції приєднання. Відмінність алкінів від алкенів полягає в тому, що реакції приєднання можуть протікати у дві стадії. На першій стадії йде приєднання до потрійного зв'язку утворенням подвійного зв'язку, а на другій стадії — приєднання за подвійним зв'язком. Реакції приєднання для алкінів протікають повільніше, ніж для алкенів.
1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднання брому до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану:
Алкіни, так само як і алкени, знебарвлюють бромну воду.
2. Гідрогалогенування. Галогеноводні приєднуються до потрійного зв'язку важче, ніж до подвійного. Для активації галогеноводню використовують АlСl3. З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду:

У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад:
3. Гіоратація. Приєднання води до алкінів каталізується солями ртуті (II):
На першій стадії реакції утворюється ненасичений спирт, в якому гідроксильна група перебуває безпосередньо в атома Карбону при подвійному зв'язку. Такі спирти заведено називати вініловими, або енолами. Прикметною рисою енолів є їхня нестійкість. У момент утворення вони ізомеризуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок перенесення протона від гідроксильної групи до сусіднього атома Карбону при подвійному зв'язку. При цьому подвійний зв'язок між атомами Карбону розривається й утворюється подвійний зв'язок з атомом Карбону та атомом Оксигену. Причиною ізомеризації є більша міцність подвійного зв'язку С=О порівняно з подвійним С=С.

У результаті реакції гідратації тільки ацетилен перетворюється в альдегід; гідратація гомологів ацетилену протікає за правилом Марковникова, і утворені еноли ізомеризуються в кетони. Наприклад, пропін перетворюється в ацетон:
Реакцію гідратації алкінів відкрив М.Г. Кучеров (1881 р.), саме тому її й називають реакцією Кучерова.
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв'язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами:
Ацетиленіди Аргентуму и Купруму(I) легко утворюються й випадають в осад при пропусканні ацетилену через аміачний розчин аргентум оксиду або купрум (І) хлориду. Ці реакції слугують для виявлення алкінів з потрійним зв'язком у кінці ланцюга:

Ацетиленіди Арґентуму й Купруму як солі дуже слабких кислот легко розкладаються при дії хлороводневої кислоти з виділенням вихідного алкіну:
Таким чином, використовуючи реакції утворення й розкладу ацетиленідів, можна виділяти алкіни із сумішей з іншими вуглеводнями.
5. Полімеризація. У присутності каталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. Так, під дією водного розчину СuСl та NH4Cl ацетилен димеризується, утворюючи вінілацетилен:
Вінілацетилен має велику реакційну здатність, приєднуючи хлороводень, він утворює хлоропрен, який використовують для добування штучного каучуку:
При пропусканні ацетилену над активованим вугіллям при температурі +600°С відбувається тримеризація ацетилену з утворенням бензену:

В аналогічні реакції тримеризації можуть також вступати й найближчі гомологи ацетилену, наприклад:
6. Реакції окиснення й відновлення. Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв'язку. При окисненні зазвичай відбувається розщеплення потрійного зв'язку, утворюються карбонові кислоти:
У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани:
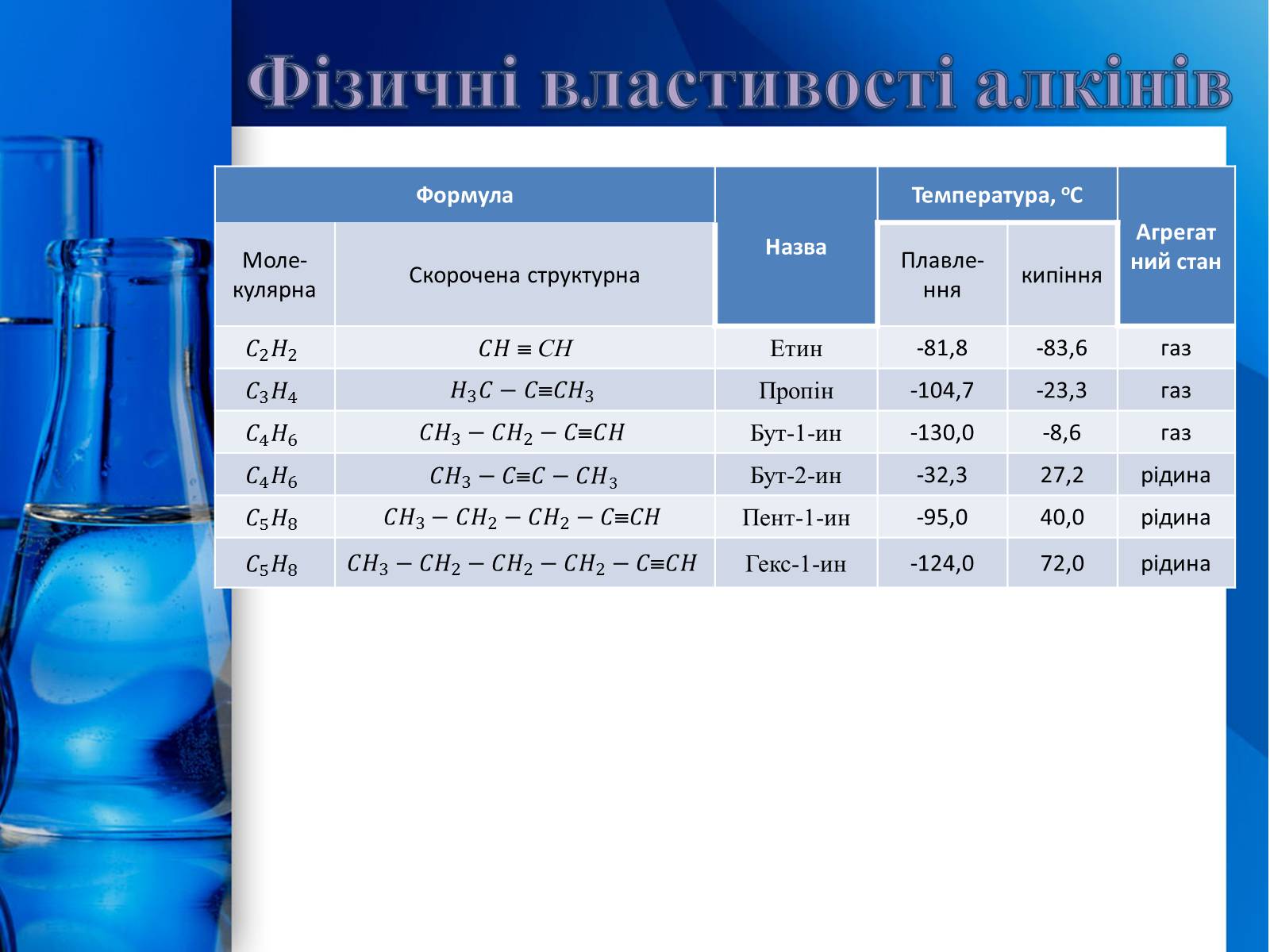
Формула
Назва
Температура, оС
Агрегатний стан
Моле-кулярна
Скорочена структурна
Плавле-ння
кипіння
CH
Етин
-81,8
-83,6
газ
Пропін
-104,7
-23,3
газ
Бут-1-ин
-130,0
-8,6
газ
Бут-2-ин
-32,3
27,2
рідина
Пент-1-ин
-95,0
40,0
рідина
Гекс-1-ин
-124,0
72,0
рідина
Формула
Назва
Температура, оС
Агрегатний стан
Моле-кулярна
Скорочена структурна
Плавле-ння
кипіння
Етин
-81,8
-83,6
газ
Пропін
-104,7
-23,3
газ
Бут-1-ин
-130,0
-8,6
газ
Бут-2-ин
-32,3
27,2
рідина
Пент-1-ин
-95,0
40,0
рідина
Гекс-1-ин
-124,0
72,0
рідина

Застосування алкінів
Серед усіх алкінів найбільше застосовують ацетилен (етин). Світова продукція його обчислюється мільйонами тонн за рік. Більша частина C2H2 витрачається на зварювання і різання металів. Ацетилен також є сировиною для отримання багатьох хімічних речовин: оцтового альдегіду, оцтової кислоти, етанолу, галогенопохідних, етену та етану, синтетичного каучуку, пластичних мас тощо. Чистий етин має типовий для ненасичених вуглеводнів запах, виявляє наркотичну дію, тому знаходить застосування в медицині.

Дякую за увагу!