Презентація на тему «Al – металл»

Al – металл
Подготовили ученицы 10 класса
Пилипенко ЕкатеринаЧерненко Екатерина
Алюминий
Металл

История открытия
Первое знакомство человека с металлами произошло несколько десятков тысяч лет назад. Куски самородных металлов – серебра и золота, метеоритного железа, которые он находил в размытых берегах или при падении метеоритов, привлекали его внимание. Однако на заре своего развития человек не умел пользоваться металлами. Метеориты, которые находили люди, часто становились предметом обожествления. Впоследствии металлы стали пользоваться кусками метеоритного железа, разбросанного вокруг воронки, для изготовления ножей, наконечников копий и т. д.

Строение атомов
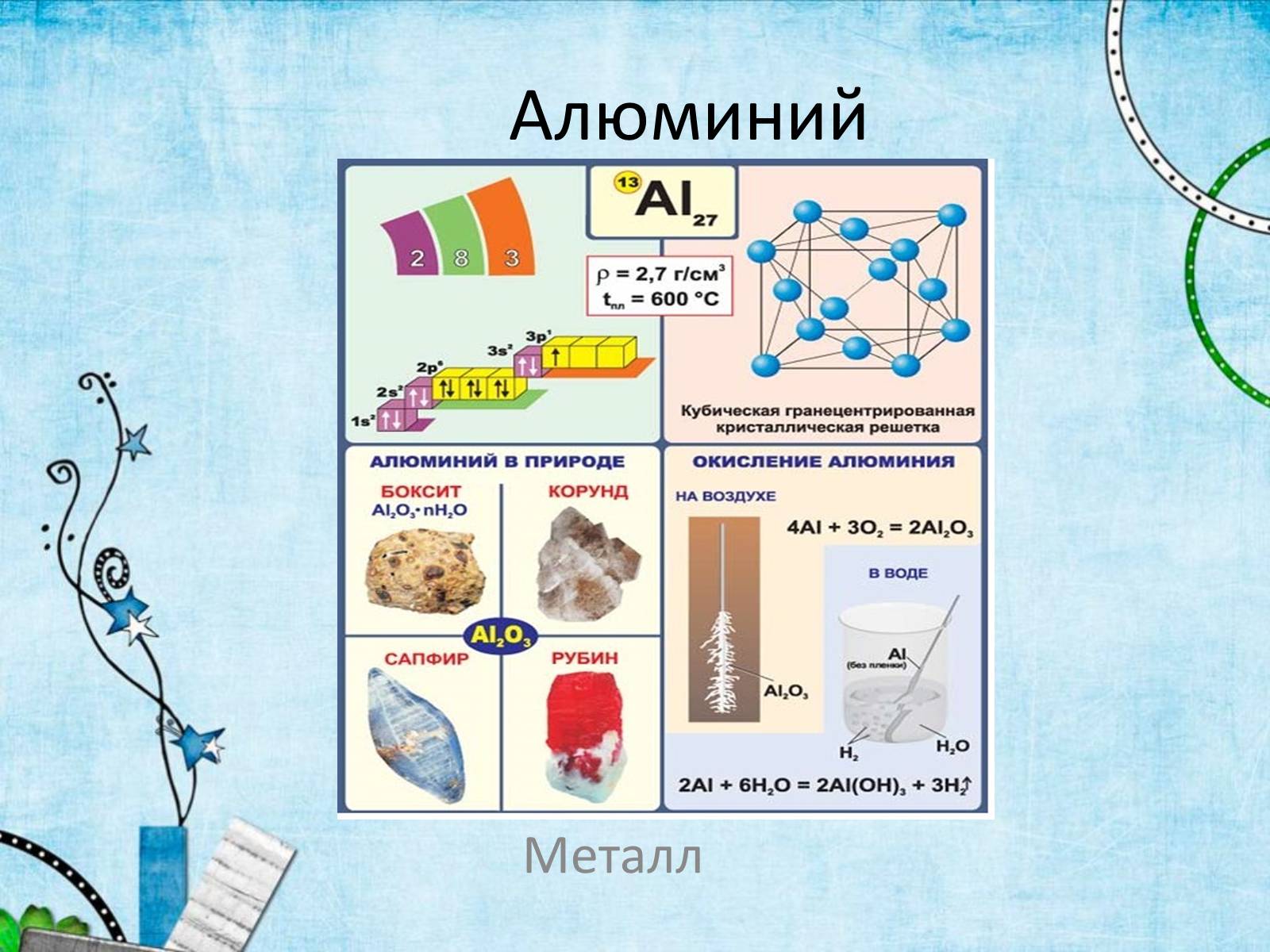
Алюминий – элемент III группы, главной подгруппы.
Порядковый номер - 13
Р-элемент
На последнем энергетическом уровне 3 электрона
Степень окисления +3
Валентность III
Высший оксид Al2O3
Носится к группе легких металлов
Наиболее распространенный металл и третий по распространенности химический элемент в земной коре

Физические свойства
Механически прочный
Плотность – 2,7 г/см3
Электрическая проводимость
Теплопроводность
Пластичность
Образует сплавы
Легкий, парамагнитный металл
Серебристого цвета
Стойкий к коррозии(за счёт быстрого образования оксидных плёнок , защищающих поверхность от дальнейшего взаимодействия.
температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
температура кипения — 2500 °C

Химические свойства
C водой:
2Al+6H2O=2Al(OH)3+3H2
C раствором щелочей:
2Al+2NaOH+10H2O=2Na{Al(OH)4(H2O)2}+3H2
C хлором:
2Al+3Cl2=2AlCl3
C серой:
2Al+3S=Al2S3
C азотом:
2Al+N2=2AlN
При нормальных условиях покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями Н2O(t),О2, HNO3 поэтому Алюминий не подвергается коррозии.

Химические свойства
C водой:
2Al+6H2O=2Al(OH)3+3H2
C раствором щелочей:
2Al+2NaOH+10H2O=2Na{Al(OH)4(H2O)2}+3H2
C хлором:
2Al+3Cl2=2AlCl3
C серой:
2Al+3S=Al2S3
C азотом:
2Al+N2=2AlN
При нормальных условиях покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями Н2O(t),О2, HNO3 поэтому Алюминий не подвергается коррозии.

Получение
1) Очистка природных соединений
2) В лаборатории:
4Al+3O2=2Al2O3(сжигание в О2)
2Al(OH)3=Al2O3+3H2O
3) Осаждение из солей
AlCl3+2NaOH=Al(OH)3+3NaCl
Al2S3+6H2O=2Al(OH)3+3H2S
Na{Al(OH)4}+HCl=Al(OH)3+NaCl+H2O

Бокситы
Бокситы – горная порода, состоящая главным образом из гидратированного оксида алюминия и оксидов железа, которые придают им красный цвет.

Корунд
Минерал . Обладает большой твердостью, применяется как абразивный материал.

Алюмосиликаты
Алюмосиликаты составляют основную массу земной коры. Их можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щелочноземельных металлов. При выветривании многих алюмосиликатов образуется глина.
Драгоценный камень Берилл представляет собой
алюмосиликат бериллия

Криолит
В настоящее время приготавливается искусственным путем, применяется в металлургии алюминия.
Криолит с криолитинитом и хиолитом, Ильменские горы, Урал. Горный

Нахождение в природе
В природе алюминий встречается только в соединениях:
Бокситы — Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — KAl(SO4)2 • 2Al(OH)3
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд — Al2O3
Полевой шпат (ортоклаз) — K2O×Al2O3×6SiO2
Каолинит — Al2O3×2SiO2 × 2H2O
Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3
Берилл — 3ВеО • Al2О3 • 6SiO2

Применение
В авиационной промышленности.
Для кабели и провода.
Детали аппаратов и тара для азотной кислоты.
Упаковка для пищевых продуктов и посуда.
Алюминотермия применяется для получения хрома, марганца, ванадия, титана, циркония и других металлов из их оксидов, а также для получения специальных солей.

Применение

Предметы быта