Презентація на тему «Причини виникнення та екологічні наслідки кислотних дощів»

Презентація на тему: «Причини виникнення та екологічні наслідки кислотних дощів». Підготувала: учениця 11-А класу Рокосівської ЗОШ Білецька Олеся
Начать

Термін "кислотний дощ" існує вже більше 100 років; вперше його використовувавбританський дослідник Роберт Ангус
Сміт у 1882 році, коли опублікував книгу "Повітря і дощ: початок хімічної кліматології". Кислотні дощі (або більш правильно, кислотніопади, так як випадання шкідливих речовин може відбуватися як у вигляді
дощу, так і у вигляді снігу, граду) наносятьзначний екологічний, економічний і естетичний збиток.

Реакція світової громадськості
Вперше проблема кислотних дощів стала предметом серйозного обговорення на ХХVIII Генеральній асамблеї Міжнародного союзу з теоретичної та прикладної хімії (ІЮПАК), що проходила в Мадриді у вересні 1975.
У 1983р. вступила в силу "Конвенція про транскордонне забруднення повітря на велику відстань", в якій зазначено, що країни повинні прагнути до обмеження і поступового зменшення забруднення повітряного середовища, включаючи забруднення, що виходять за межі своєї держави.
У липні 1985р. в Хельсінкі 20 держав Європи та Канада підписали Протокол про 30%-ве зниження викидів оксидів сірки на території цих держав або їх транскордонних потоків на території сусідніх держав. Проблема охорони атмосферного повітря від забруднень відображена і в Законі Росії про охорону навколишнього середовища (2002р.).

Причини утворення кислотних дощів:
вулкани
Природні причини
гроза

Причини утворення кислотних дощів:
Штучні джерела
мінеральні добрива
спалювання топлива
топливо літаків
нафтопереробка
автотранспорт
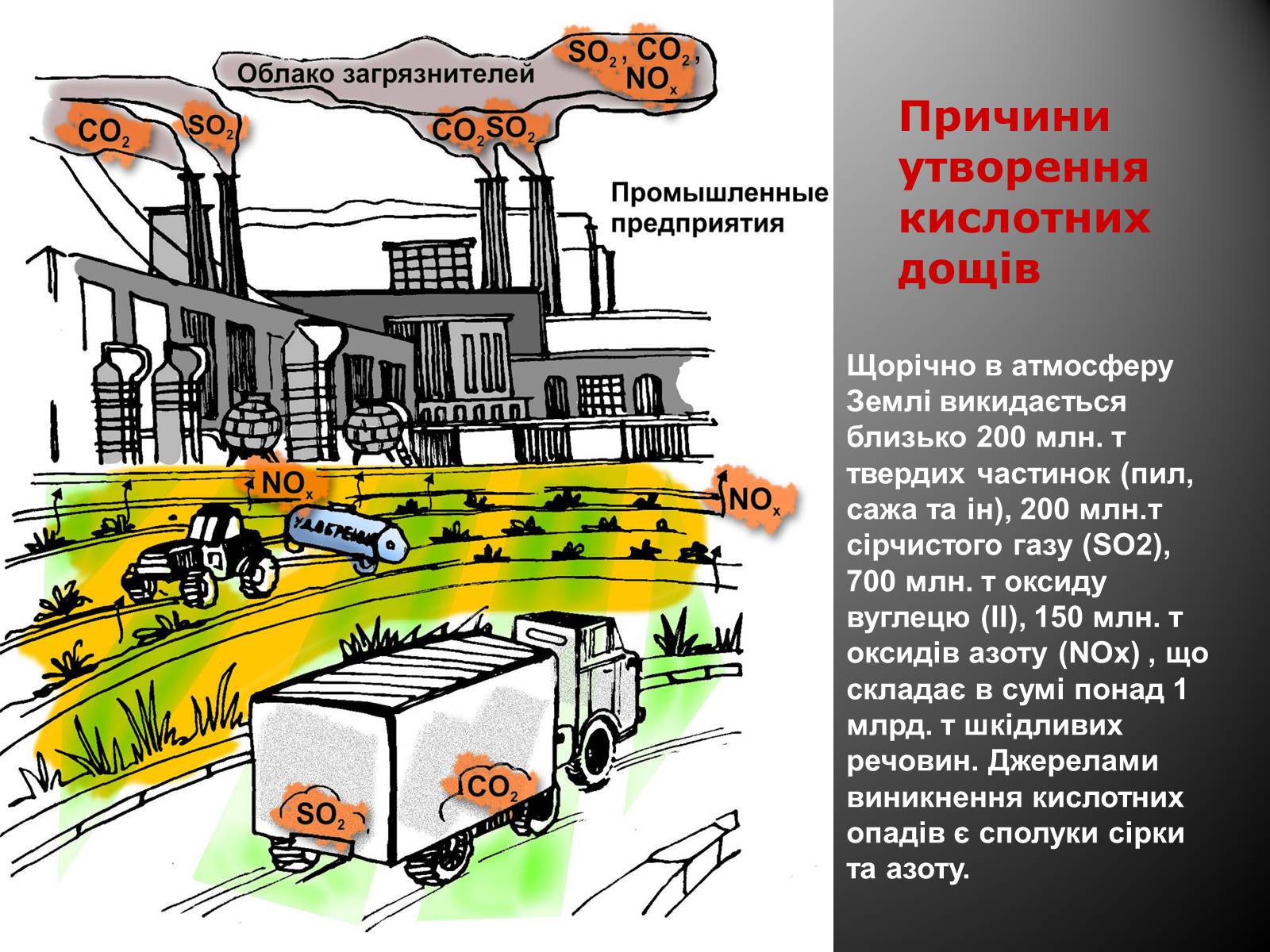
Причини утворення кислотних дощів
Щорічно в атмосферу Землі викидається близько 200 млн. т твердих частинок (пил, сажа та ін), 200 млн.т сірчистого газу (SO2), 700 млн. т оксиду вуглецю (II), 150 млн. т оксидів азоту (NOx) , що складає в сумі понад 1 млрд. т шкідливих речовин. Джерелами виникнення кислотних опадів є сполуки сірки та азоту.

Сірка
Вона міститься в таких корисних копалинах, як вугілля, нафта, залізні, мідні та ін руди; одні з них використовують як паливо, інші направляють на підприємства хімічної та металургійної промисловості. При переробці (зокрема, при випалюванні руд) сірка переходить в хімічні з'єднання, наприклад, в сірчистий газ (оксид сірки (IV)). Утворені з'єднання частково вловлюються очисними спорудами, інша їх кількість викидається в атмосферу. З'єднуючись з парами води, попередньо окислений оксид сірки (IV) утворює сірчану кислоту.

Сірка
У більшості антропогенних викидів переважають оксид сірки (IV) та сульфати. Сульфати виділяються при спалюванні палива і в ході таких промислових процесів, як нафтопереробка, виробництво цементу, гіпсу та цементу, сірчаної кислоти. З природних джерел сірковмісних сполук важливу роль відіграють біогенні викиди з грунту і продукти життєдіяльності рослин. В даний час в науці недостатньо даних про механізм процесів, в результаті яких виділяються сполуки сірки.

Сірка
При виверженнях вулканів переважає оксид сірки (IV), в меншій кількості в атмосферу надходить сірководень, а також сульфати у вигляді аерозолів і твердих часток. Щорічно в усьому світі в результаті вулканічної діяльності виділяється 4-16 млн. т сполук сірки (у перерахунку на SO2).

Азот
Він міститься в паливі багатьох видів копалин, наприклад, у вугіллі і нафті. З антропогенних джерел виділяється близько 93% оксидів азоту (II), який в результаті хімічних реакцій в атмосфері перетворюється на оксид азоту (IV), який і утворює з водою азотну кислоту.

Природні джерела оксидів азоту - це грозові розряди і блискавки, а також біогенні речовини. Летючі органічні сполуки, на відміну від оксидів сірки та азоту, надходять в атмосферу головним чином з природних джерел (65% від загальної кількості). Основне джерело цих речовин - рослини, в результаті життєдіяльності яких утворюються складні органічні речовини.
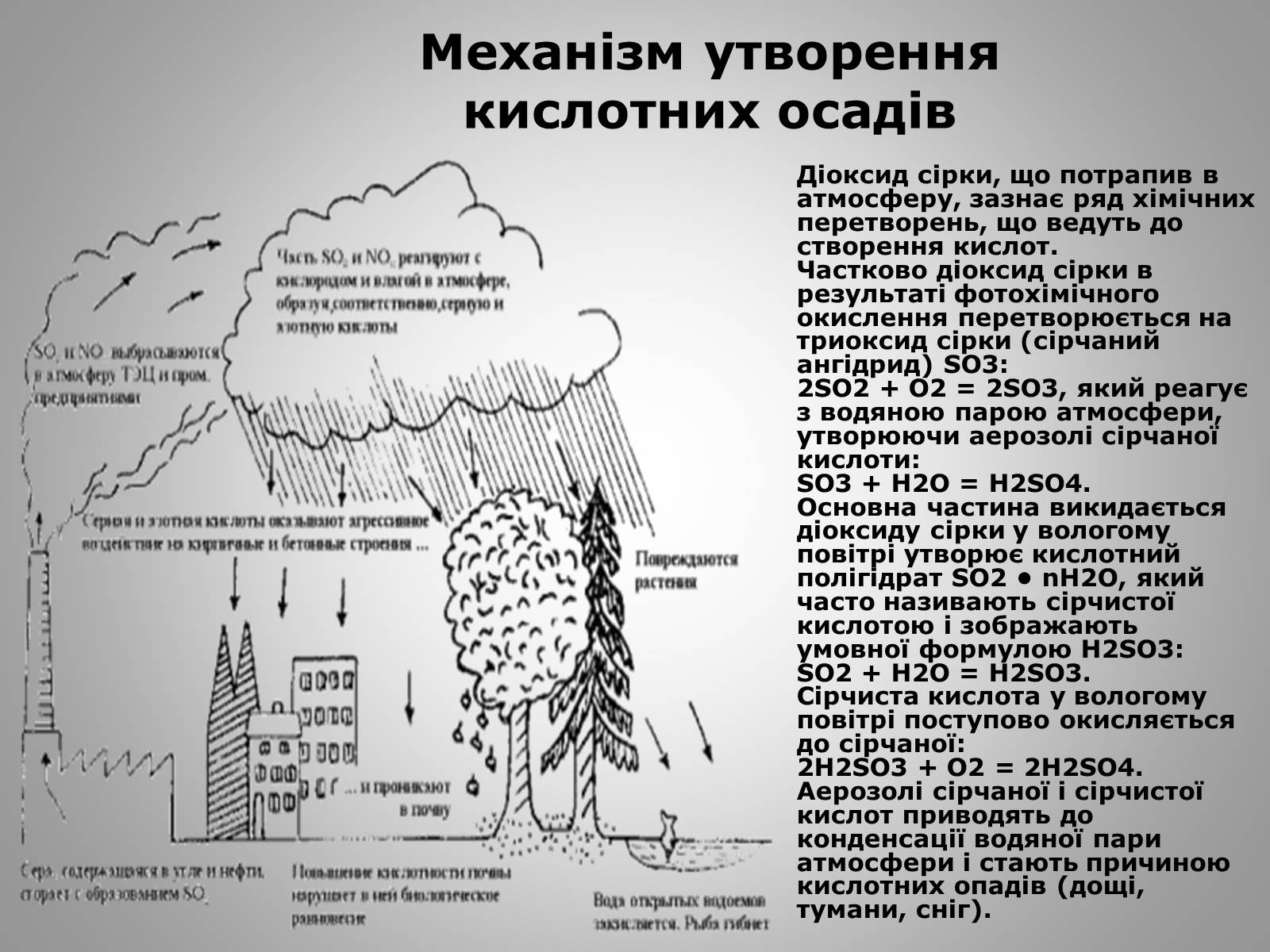
Механізм утворення кислотних осадів
Діоксид сірки, що потрапив в атмосферу, зазнає ряд хімічних перетворень, що ведуть до створення кислот. Частково діоксид сірки в результаті фотохімічного окислення перетворюється на триоксид сірки (сірчаний ангідрид) SО3: 2SO2 + O2 = 2SO3, який реагує з водяною парою атмосфери, утворюючи аерозолі сірчаної кислоти: SO3 + Н2O = Н2SO4. Основна частина викидається діоксиду сірки у вологому повітрі утворює кислотний полігідрат SО2 • nH2O, який часто називають сірчистої кислотою і зображають умовної формулою Н2SО3: SO2 + H2O = H2SO3. Сірчиста кислота у вологому повітрі поступово окисляється до сірчаної: 2Н2SО3 + О2 = 2Н2SO4. Аерозолі сірчаної і сірчистої кислот приводять до конденсації водяної пари атмосфери і стають причиною кислотних опадів (дощі, тумани, сніг).

Механізм утворення кислотних осадів (продовження)
При спалюванні палива утворюються тверді мікрочастинки сульфатів металів (в основному при спалюванні вугілля), легко розчинні у воді, які осідають на грунт і рослини, роблячи кислотними роси. Аерозолі сірчаної і сірчистої кислот складають близько 2 / 3 кислотних опадів, інше доводиться на частку аерозолів азотної і азотистої кислот, щоутворюються при взаємодії діоксиду азоту з водяною парою атмосфери:
2NО2 + Н2О = НNО3 + НNО2.
Існують ще два види кислотних дощів, які поки не відслідковуються моніторингом атмосфери. Хлор, що знаходиться в атмосфері (викиди хімічних підприємств; спалювання відходів; фотохімічне розкладання фреонів, що приводить до утворення радикалів хлору) при з'єднанні з метаном (джерела надходження метану в атмосферу: антропогенний - рисові поля, а також результат танення гідрату метану у вічній мерзлоті внаслідок потепління клімату ) утворює хлороводень, добре розчиняється у воді з утворенням аерозолів соляної кислоти:
Сl• + СН4 CН•3 + НСl,
СН•3 + Сl2 CН3Cl + Сl•.
Дуже небезпечні викиди фтороводню (виробництво алюмінію, скляне), який добре розчиняється у воді, що призводить до появи в атмосфері аерозолів плавикової кислоти.

Наслідки кислотних дощів в природі
В результаті випадання кислотних осадів порушується рівновага в екосистемах, погіршується продуктивность сільськогосподарських рослин і поживні властивості грунтів.

Наслідки кислотних дощівв техніці
В результаті корозії руйнуються металеві конструкції.
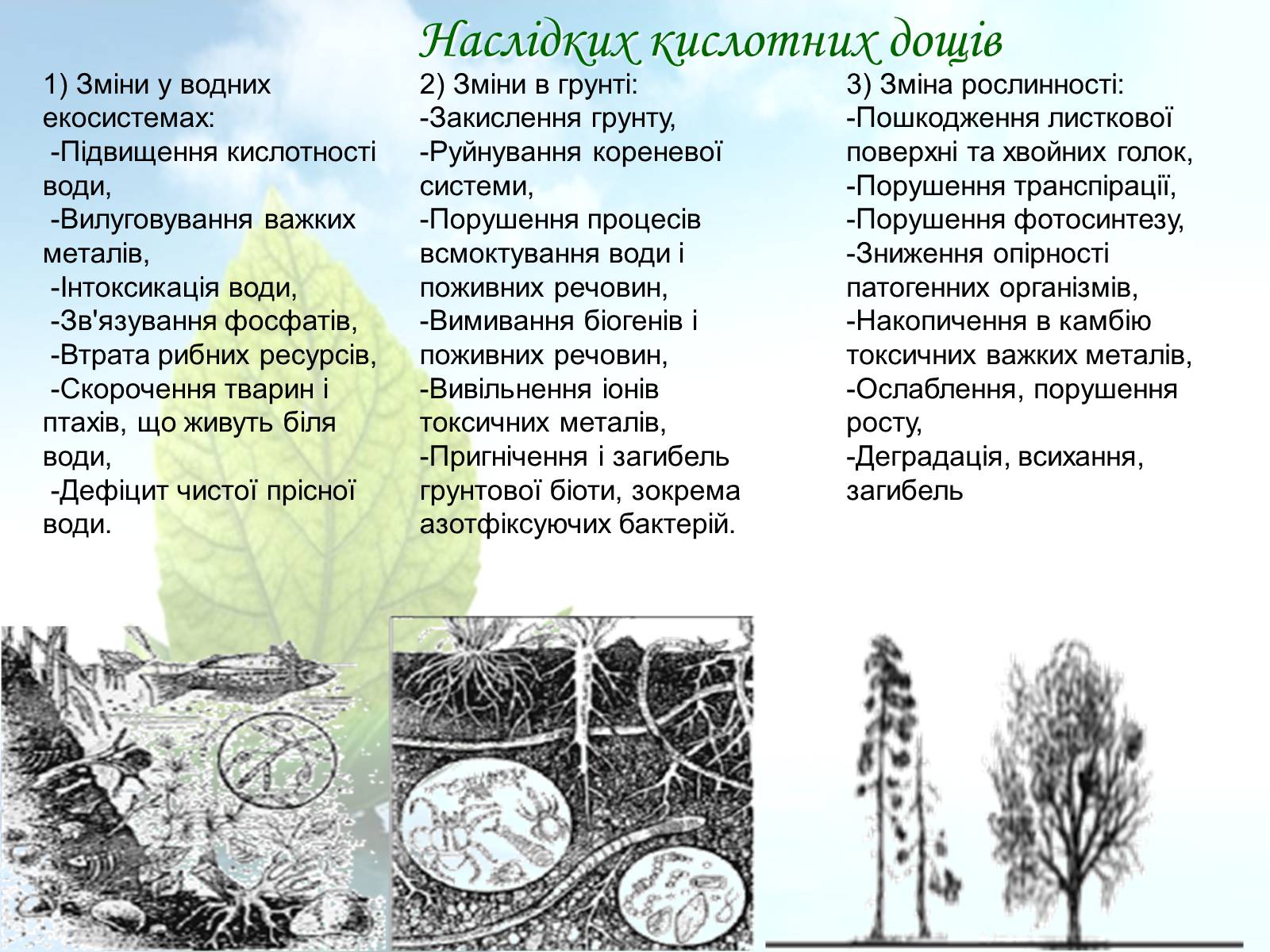
1) Зміни у водних екосистемах: -Підвищення кислотності води, -Вилуговування важких металів, -Інтоксикація води, -Зв'язування фосфатів, -Втрата рибних ресурсів, -Скорочення тварин і птахів, що живуть біля води, -Дефіцит чистої прісної води.
2) Зміни в грунті:-Закислення грунту,-Руйнування кореневої системи,-Порушення процесів всмоктування води і поживних речовин,-Вимивання біогенів і поживних речовин,-Вивільнення іонів токсичних металів,-Пригнічення і загибель грунтової біоти, зокрема азотфіксуючих бактерій.
3) Зміна рослинності:-Пошкодження листкової поверхні та хвойних голок,-Порушення транспірації,-Порушення фотосинтезу,-Зниження опірності патогенних організмів,-Накопичення в камбію токсичних важких металів,-Ослаблення, порушення росту,-Деградація, всихання, загибель
Наслідких кислотних дощів

Наслідки кислотних дощів
В кожному регіоні є будівлі, що піддалися руйнування в результаті кислотних осадів.

Вплив кислотних дощівна ступінь руйнування історичних пам'ятників
До будівельних матеріалів, в першу чергу, відносяться вапняк, мармур, шифер і вапняні розчини, в яких карбонат кальцію (CaCO3) переходить в сульфат - гіпс (CaSO4 ∙ 2H2O). Особливо небезпечні такі реакції для вапняного розчину, оскільки вони призводять до об'ємного розширення і деформацій конструкцій і пов'язаним з ним зміщенням елементів конструкцій, з'єднаних цим розчином. Вироби з мармуру також нестійкі до агресивного впливу забруднюючих речовин. Цей красивий камінь ще з часів античних цивілізацій широко використовувався при створенні творів монументальної архітектури, статуй, колон і надгробків. Під дією кислих дощів кальцит в мармурі перетворюється в гіпс. Гіпс відрізняється від кальциту, по-перше, більшою розчинністю (у гіпсу Пр = 10-4,6 проти 10-8,6 у кальциту) і, по-друге, більшою м'якістю (36 кг/мм2 у гіпсу, проти 109 кг/мм2 у кальциту), у зв'язку з чим він легше піддається руйнівній дії дощів. Перехід кальциту в гіпс під впливом сіркокислих сполук у дощових опадах супроводжується зміною об'єму в n разів у зв'язку зі зміною структури кристалічної решітки (з Тригональна у кальциту в моноклінної у гіпсу- ангідриту і гідратацією ангідриту до алебастру і сьогодення гіпсу): ttttt H2O
CaCO3 + H2SO4 = CaSO4 +H2CO3
Ангідрит CO2
2. CaSO4 + H2O = CaSO4 ∙ H2O – алебастр
CaSO4 ∙ H2O + H2O = CaSO4 ∙ 2H2O – гіпс
Проте за прикладами впливу забруднюючих речовин на мармур, і як наслідок, доказ їх наявності в повітрі, що навколо нас, зовсім необов'язково звертатися до античності або до середніх століть, бо на будь-якому міському кладовищі можна знайти мармурові надгробки того чи іншого віку, що знаходяться в тому чи іншому ступені руйнування.

Наслідки кислотних дощів в архітектурі
Кислотні осади руйнують будівлі із мармура і вапняку.
Історичні пам'ятники Греції і Риму, що простояли тисячоліттями, за останні роки руйнуються прямо на очах.

Наслідки кислотних дощів в архітектурі
Така ж доля загрожує і
Тадж-Махалу – шедевру індійскої
архітектури періоду Великих
моголів, в Лондоні - Тауеру іВестмінстерському аббатству…

Последствия кислотных дождей
архитектура

Наслідки кислотних дощів
… в Санкт-Петербурзі – Казанському собору, Александро-Невской Лаврі і ін.

Наслідки кислотних дощів в архітектурі
На соборі Св. Павла шар портлендського вапняку роз'їденого на 2.5 см.У Голландії статуї на соборі Св. Іоанна "тануть, як льодяники".Чорними відкладеннями, цим "раком каменю", роз'їдений королівський палац на площі Дам в Амстердамі.
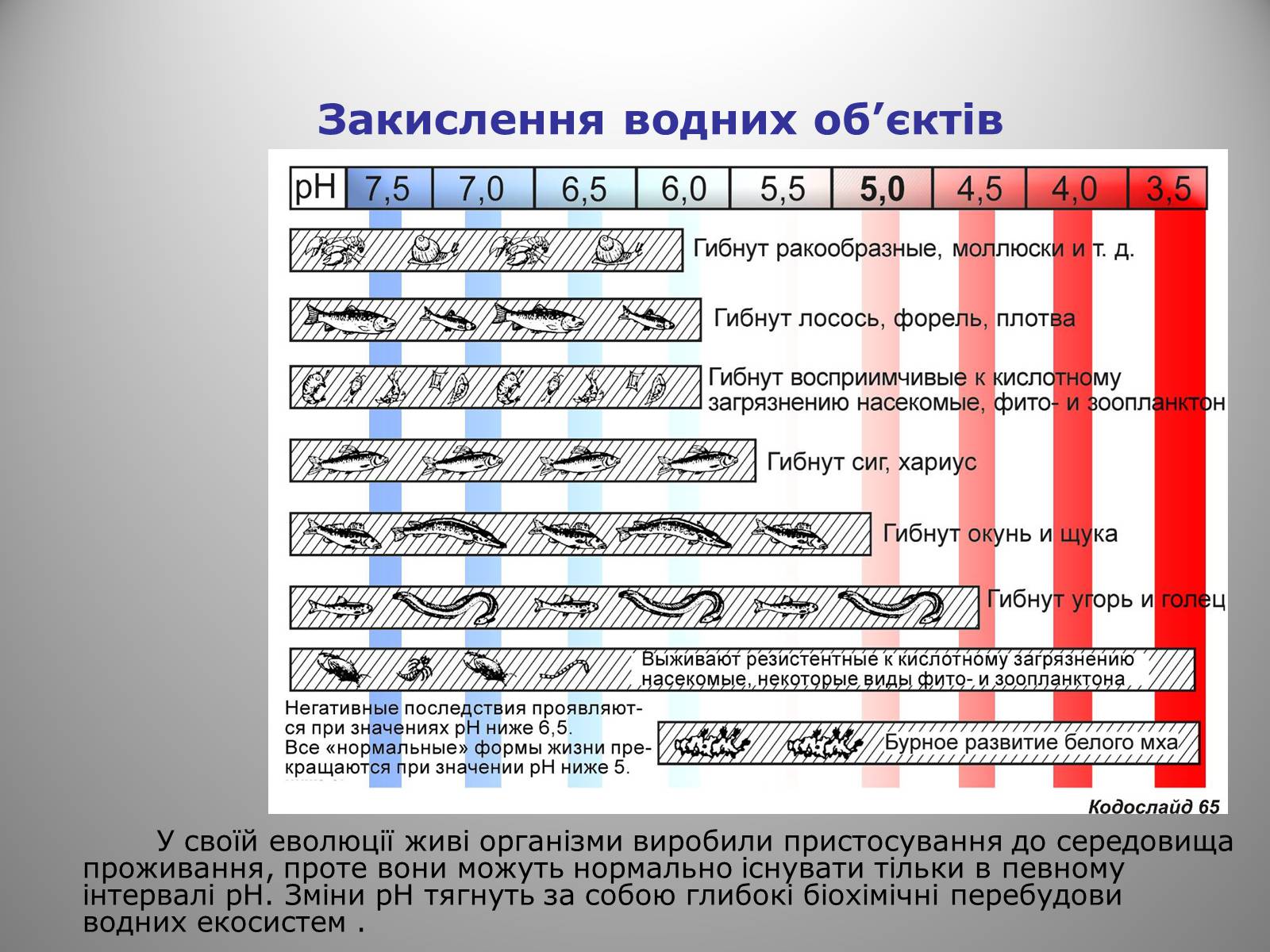
Закислення водних об'єктів
У своїй еволюції живі організми виробили пристосування до середовища проживання, проте вони можуть нормально існувати тільки в певному інтервалі рН. Зміни рН тягнуть за собою глибокі біохімічні перебудови водних екосистем .

Коли рН знижується до 6,5-6,0, гине
багато молюсків, ракоподібних, гине ікра
земноводних. При рН рівним 6,0-5,0 гинуть
найбільш чутливі планктонні організми і
комахи, сигів риби, форель, харіус, лосось,
плотва, окунь і щука. Риба гине не тільки
від прямої дії кислоти. Витиснений з
гірських порід і донних відкладень
ухливий алюміній пошкоджує зябровий
апарат. Через порушення кальцієвої
рівноваги риба втрачає здатність до
відтворення. При рН менше 5,5 мохи та
нитчасті водорості витісняють основну
рослинність водойми, іноді у воду навіть
переселяється сфагновий мох – мешканець
суші. При рН нижче 4,5 у воді озер вимирають
мікроорганізми, розвиваються анаеробні
(Безкисневі) процеси з виділенням метану
та сірководню.
рН водних об'єктів

Методи відбору проб води
Спостереження за атмосферними опадами та вивчення методу відбору їх проб становить інтерес як з точки зору метеорологічної оцінки опадів, що випали, так і з точки зору їх подальшого аналізу на вміст важких металів, сульфатів, нітратів, кислотність та ін. Збір рідких опадів (дощової води) проводиться за допомогою простого дождемера, що складається з лійки (зазвичай, діаметром не менше 20 см) і мірного циліндра. Дощова вода може збиратися і в інших ємностях (відра, хімічні склянки).

Методи відбору проб снігу
Відбір проб твердих опадів (снігу) зазвичай проводиться методом вирізування кернів-циліндричних зразків снігу, з використанням глибоких циліндричних предметів (труби, металеві циліндри, банки та ін) з діаметром понад 100 мм.

ВисновокОтже, як ми бачимо кислотні дощі приносять велику шкоду людству по всьому світу: пошкоджуються статуї, будівлі, метал автомобілів; гине риба, водні рослини і мікроорганізми в озерах і річках. Для боротьби з кислотними дощами необхідно направити зусилля на скорочення викидів кислотоутворюючих речовин вугільними електростанціями. А для цього необхідно: використання низько сірчисте вугілля чи його очищення від сірки; установка фільтрів для очищення газоподібних продуктів; застосування альтеpHативних джерел енергії. Більшість людей залишається байдужими до проблеми кислотних дощів.
Выход
