Презентація на тему «Кислотні Дощі» (варіант 10)

КИСЛОТНІ ДОЩІ

Коли йде дощ, краплі води (або сніжинки, коли йде сніг) захоплюють з повітря шкідливі домішки, що потрапили в нього з труб якогось заводу. В результаті в деяких місцях Землі випадають шкідливі, так звані кислотні дощі.
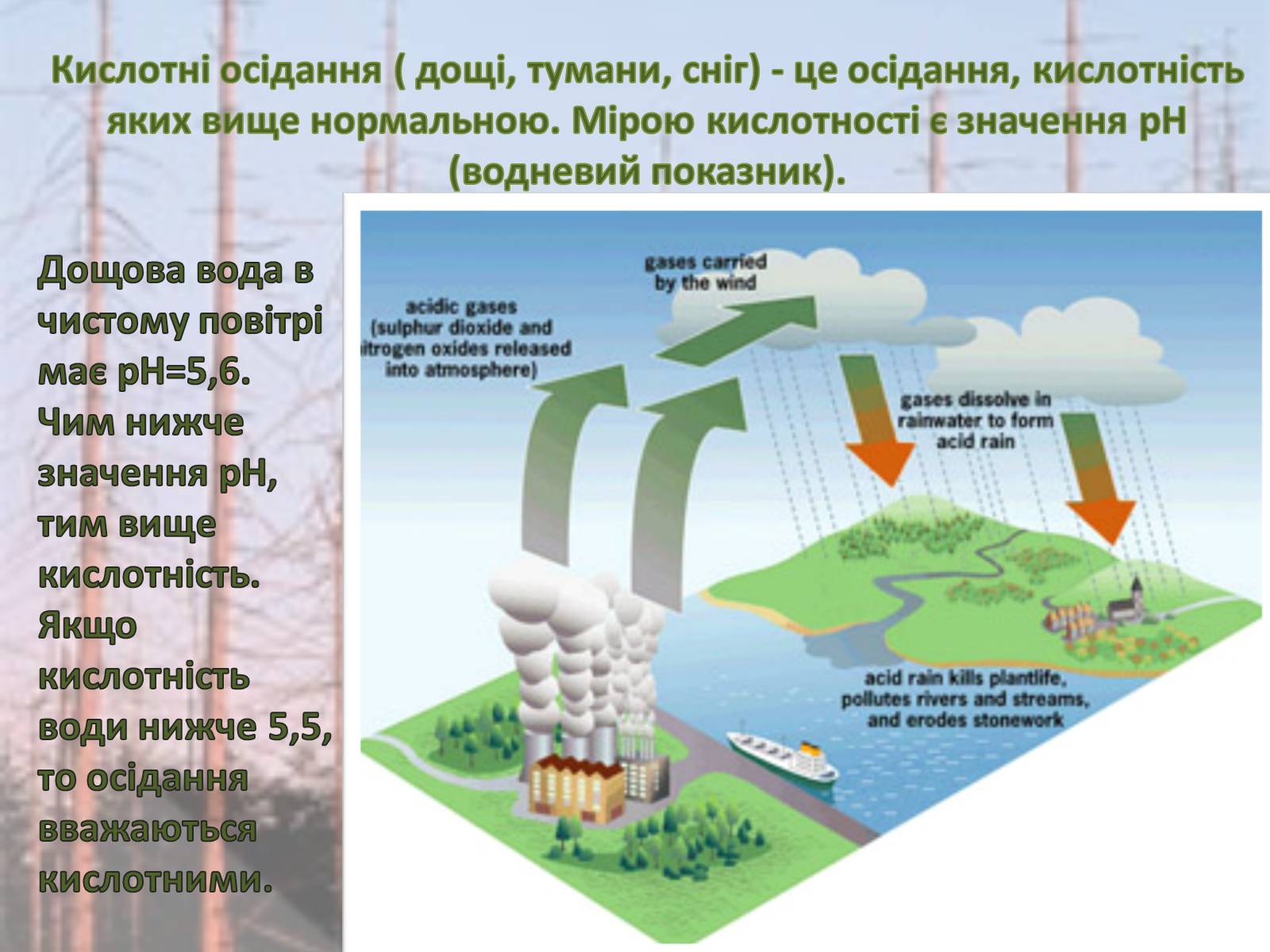
Кислотні осідання ( дощі, тумани, сніг) - це осідання, кислотність яких вище нормальною. Мірою кислотності є значення pH (водневий показник).
Дощова вода в чистому повітрі має pH=5,6. Чим нижче значення pH, тим вище кислотність. Якщо кислотність води нижче 5,5, то осідання вважаються кислотними.

У водних екосистемах кислотні осідання викликають загибель риб і інших водних мешканців. Разом із загибеллю озер стає очевидним і деградація лісів. Кислоти порушують захисний восковий покрив листя, роблячи рослини більш уразливими для комах, грибів і інших патогенних мікроорганізмів.
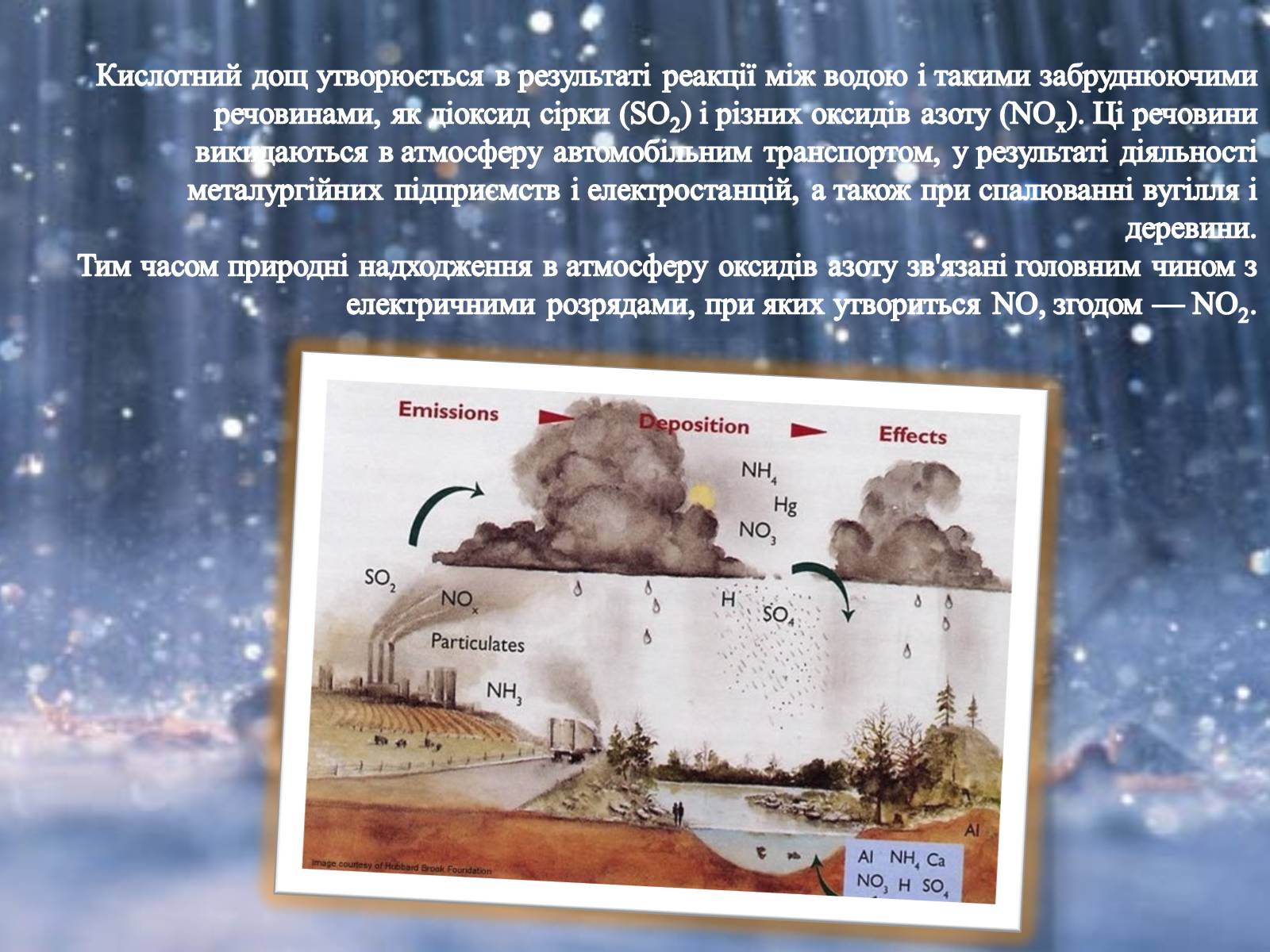
Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як діоксид сірки (SO2) і різних оксидів азоту (NOx). Ці речовини викидаються в атмосферу автомобільним транспортом, у результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини.
Тим часом природні надходження в атмосферу оксидів азоту зв'язані головним чином з електричними розрядами, при яких утвориться NО, згодом — NO2.

Діоксид сірки, що потрапив в атмосферу, перетерплює ряд хімічних перетворень, що ведуть до утворення кислот. Частково діоксид сірки в результаті фотохімічного окислювання перетворюється в триоксид сірки : SO3: 2SO2 +О2 → 2SO3
який реагує з водяною парою атмосфери, утворюючи аерозолі сірчаної кислоти:
SO3 + Н2О → H2SO4.
утворить аерозоль сірчистої кислоти і зображують умовною формулою Н2SO3: SO2 + H2O → H2SO3.
Сірчиста кислота у вологому повітрі поступово окисляється до сірчаної:
2H2SO3 + O2 → 2H2SO4.

Для боротьби з кислотними дощами необхідно направити зусилля на скорочення викидів кислотоутворюючих речовин вугільними електростанціями.

ДЯКУЄМО ЗА УВАГУ!