Презентація на тему «Основи МКТ»

Основи МКТ
Газові закони

Чому на балонах з газом пишуть: “Не нагрівати!”?
Чому нагріта медична банка “присмоктується” до тіла людини?
Чому від палаючих полін з тріском відлітають іскри?
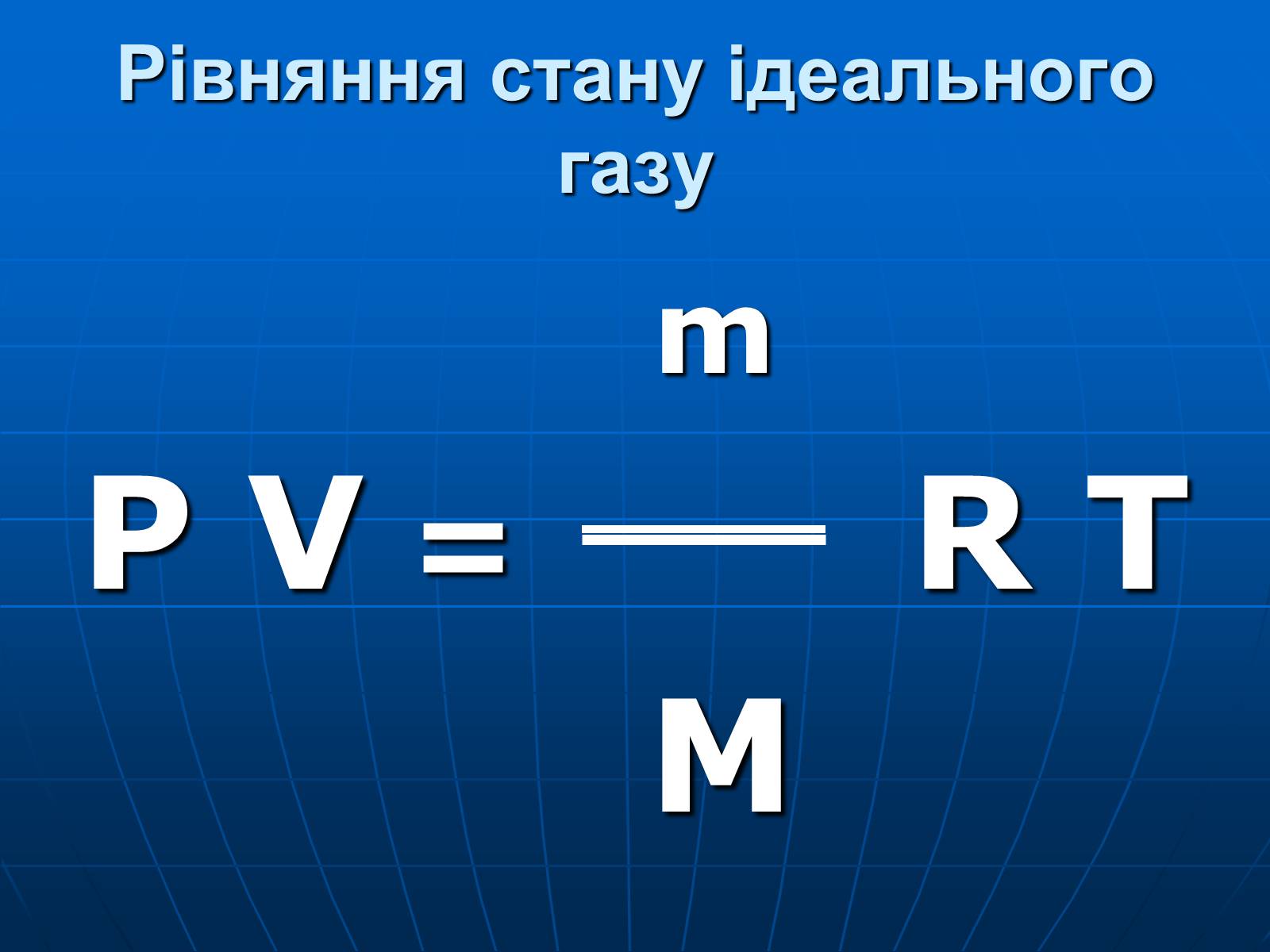
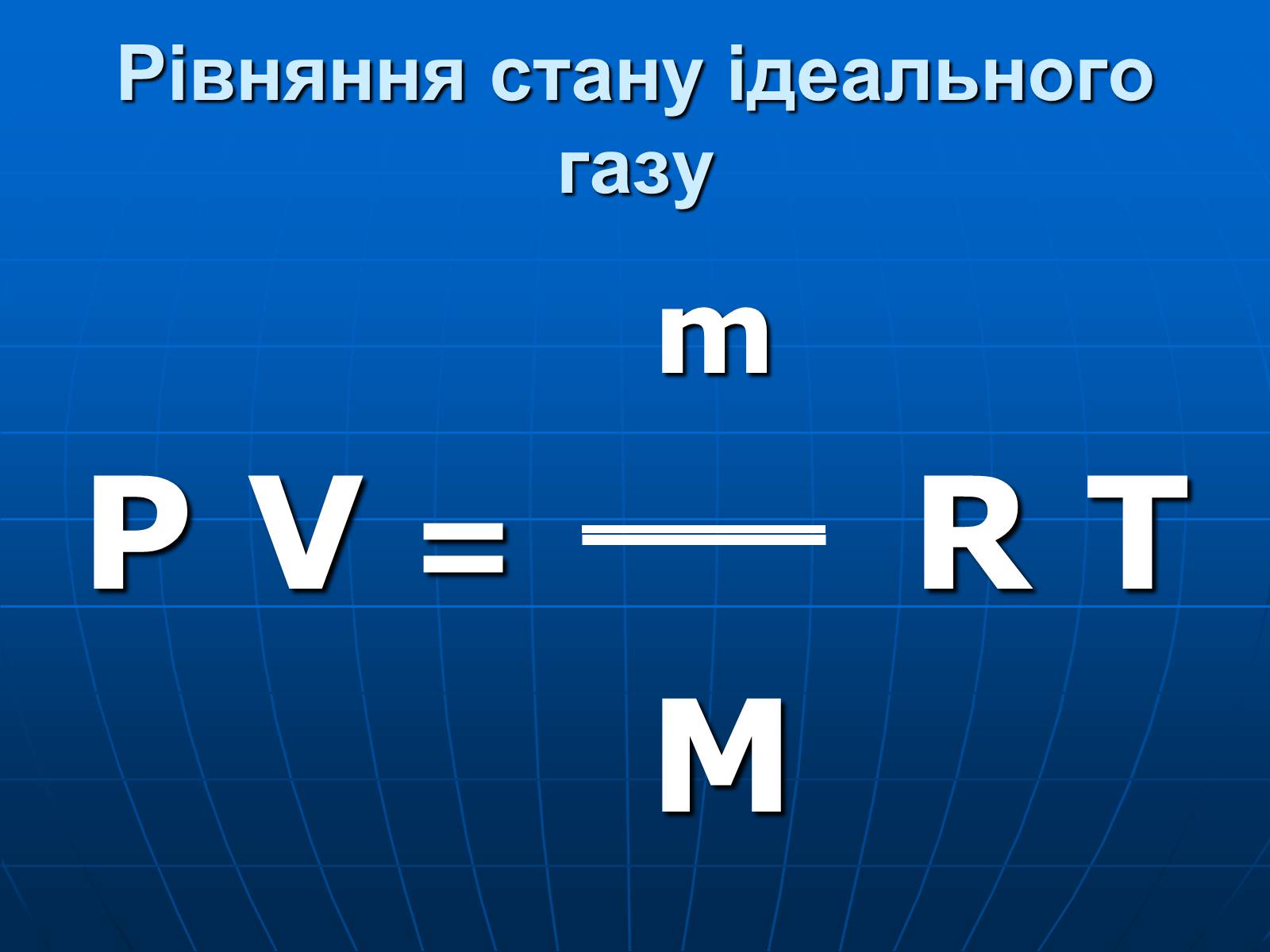
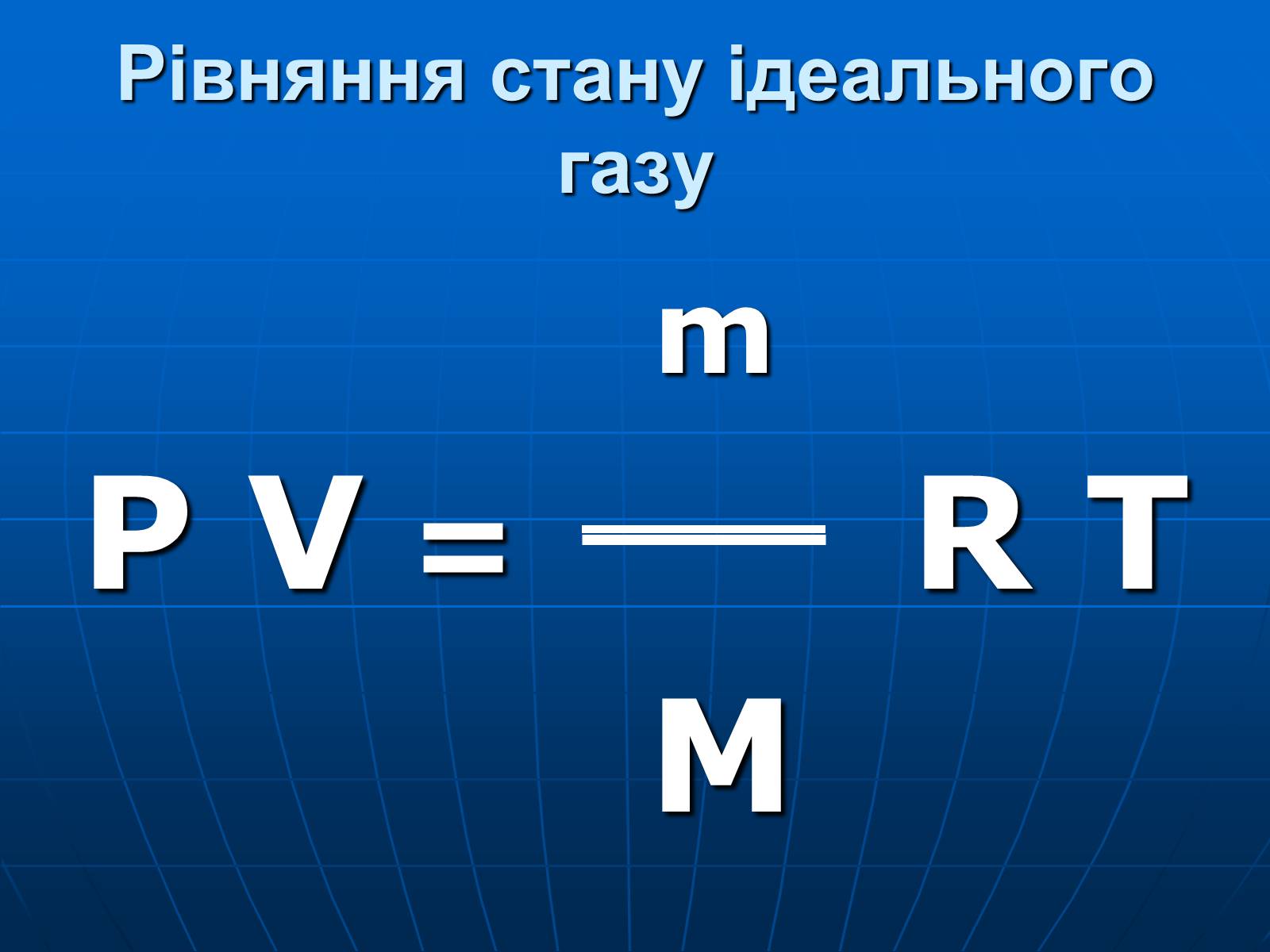
Рівняння стану ідеального газу
m
P V = R T
M

Ізотермічний процес
m = const
M = const
T = const
Закон Бойля – Маріотта
PV = const !!!

Запам‘ятай! Це закон!
Закон Бойля – Маріотта: для даної маси газу при незмінному хімічному складі, за незмінної температури, добуток тиску газу на його об'єм є величина стала ( тиск газу обернено пропорційний його об'єму ).

Графіки ізотермічного процесу
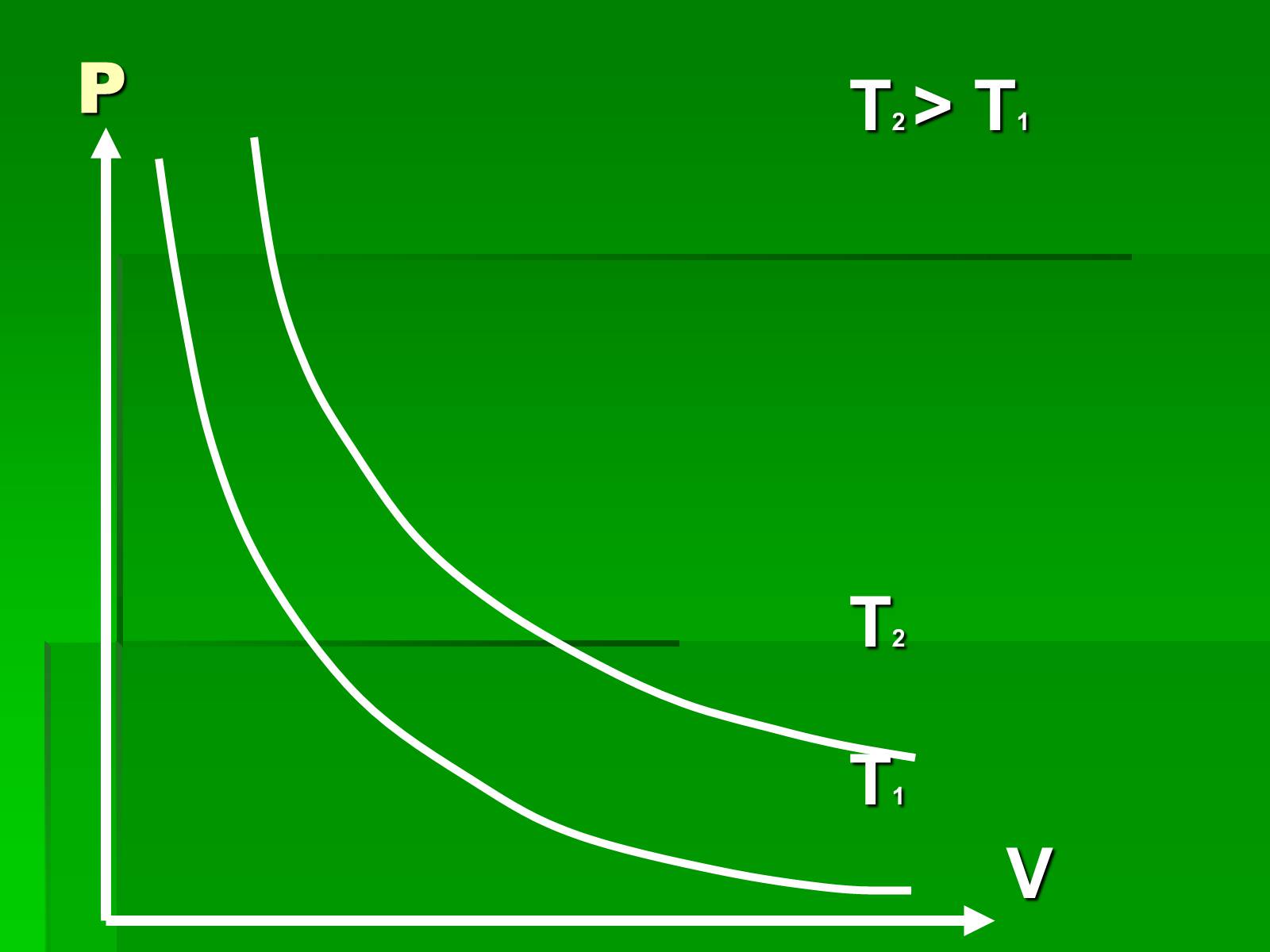
P
T2 > T1
T2
T1
V
T1 T2
P
T2 > T1
T
T1 T2
V
T2 > T1
T
Рівняння стану ідеального газу
m
P V = R T
M

Ізобарний процес
m = const
M = const
P = const
Закон Гей - Люссака
V
--- = const !!!
T

Запам‘ятай! Це закон!
Закон Гей – Люссака: для даної маси газу та незмінного хімічного складу, при сталому тиску, відношення об'єму газу до його абсолютної температури є величина стала
( об'єм газу прямо пропорційний його абсолютній температурі ).

Графіки ізобарного процесу
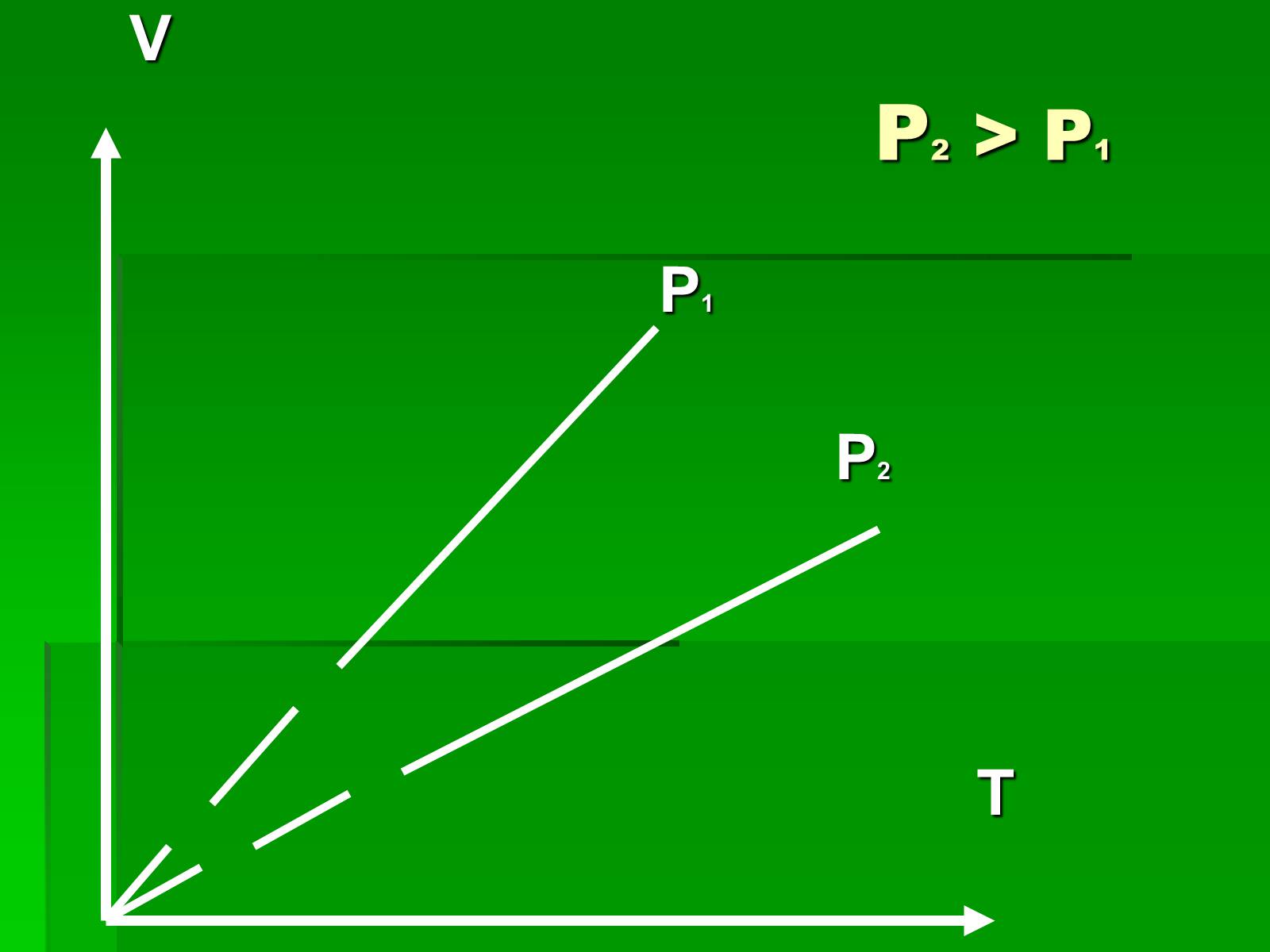
P2 > P1
V
P1
P2
T
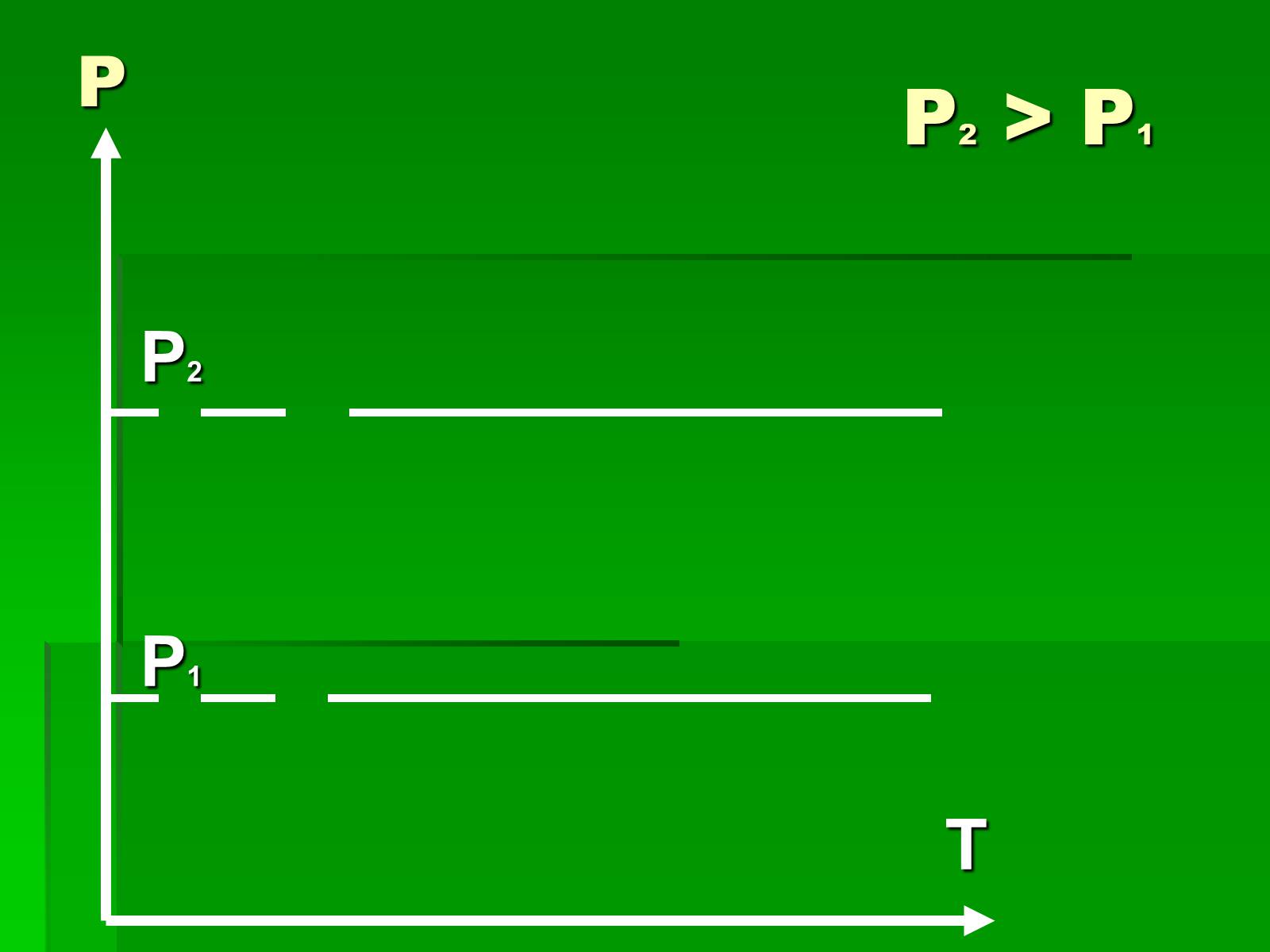
P2
P1
T
P
Р2 > P1
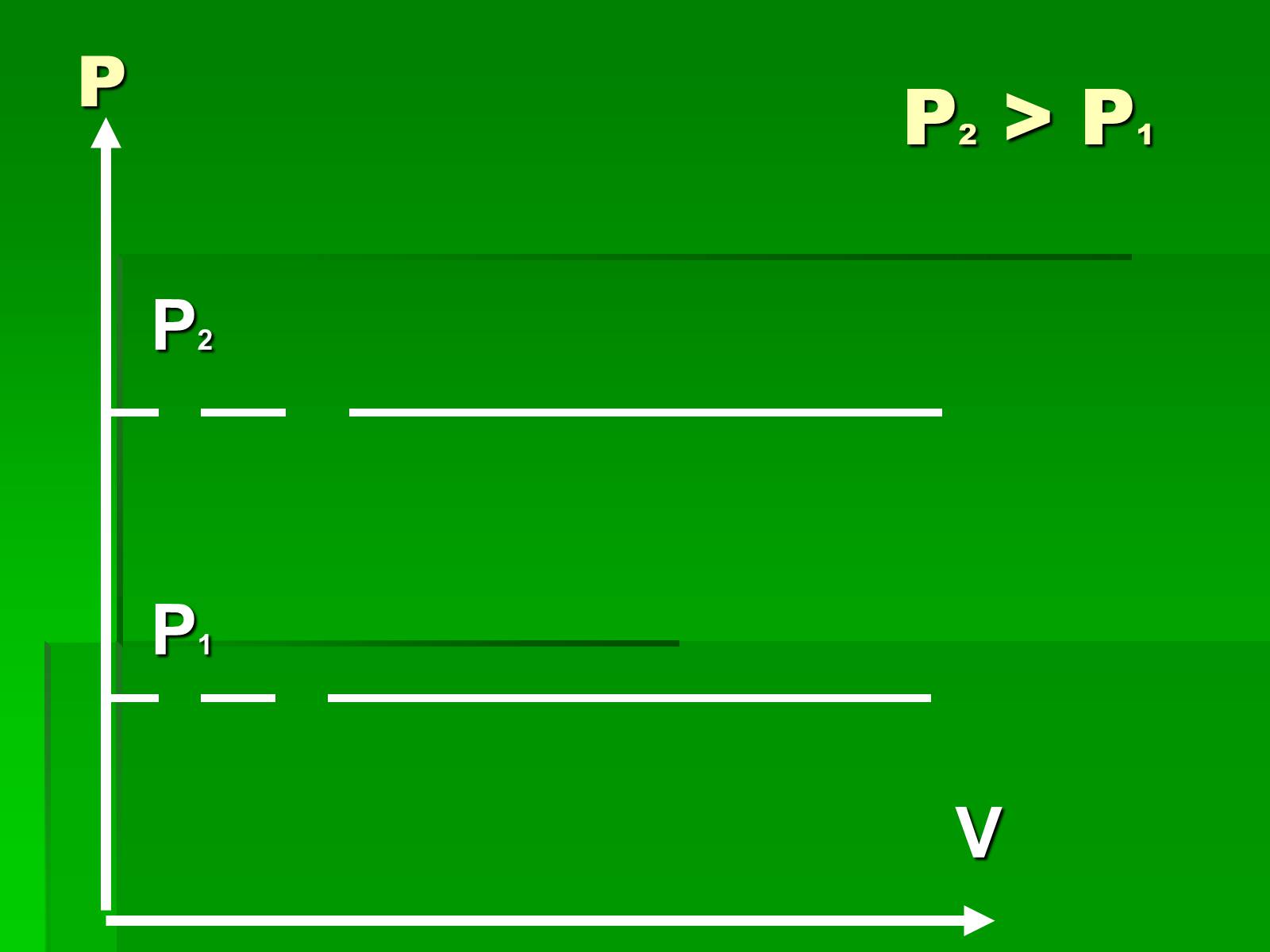
Р2 > P1
P2
P1
V
P
Рівняння стану ідеального газу
m
P V = R T
M

Ізохорний процес
m = const
M = const
V = const
Закон Шарля
P
--- = const !!!
T

Запам‘ятай! Це закон!
Закон Шарля: для даної маси газу та незмінного хімічного складу при сталому об'ємі відношення тиску газу до його абсолютної температури є величина стала ( тиск газу прямопропорційний його абсолютній температурі)

Графіки ізохорного процесу
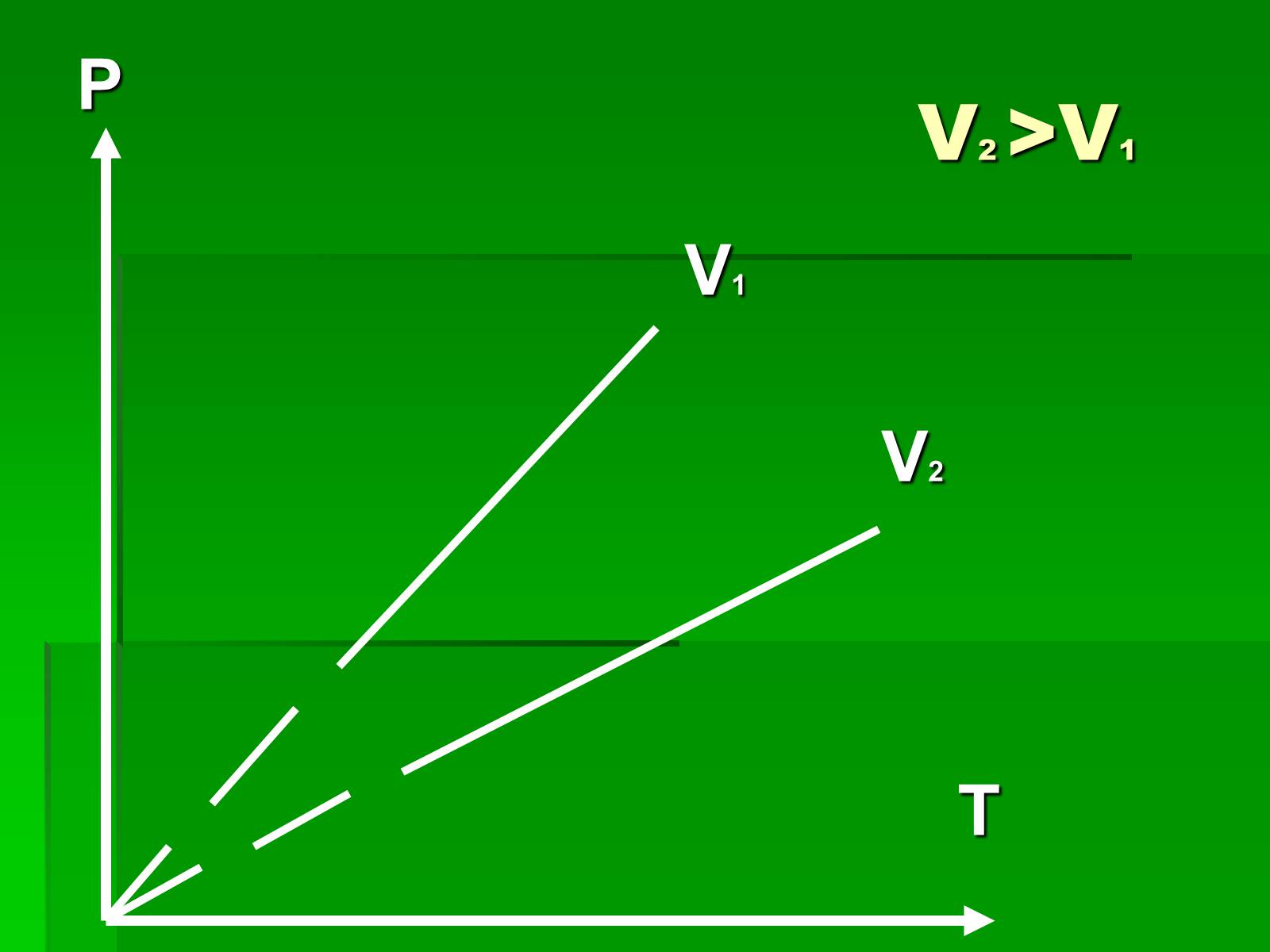
V2 >V1
P
V1
V2
T
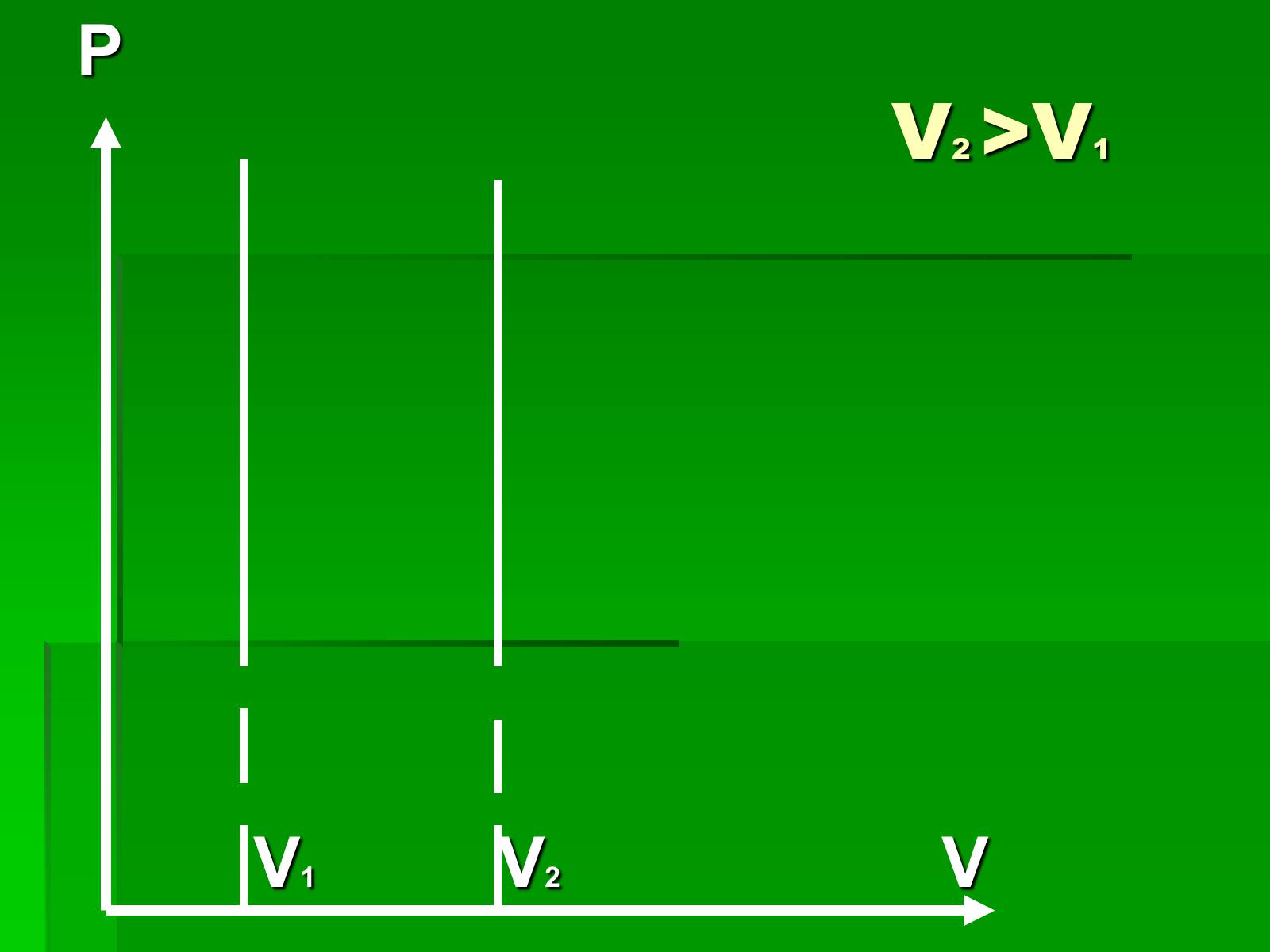
V2 >V1
P
V1 V2 V
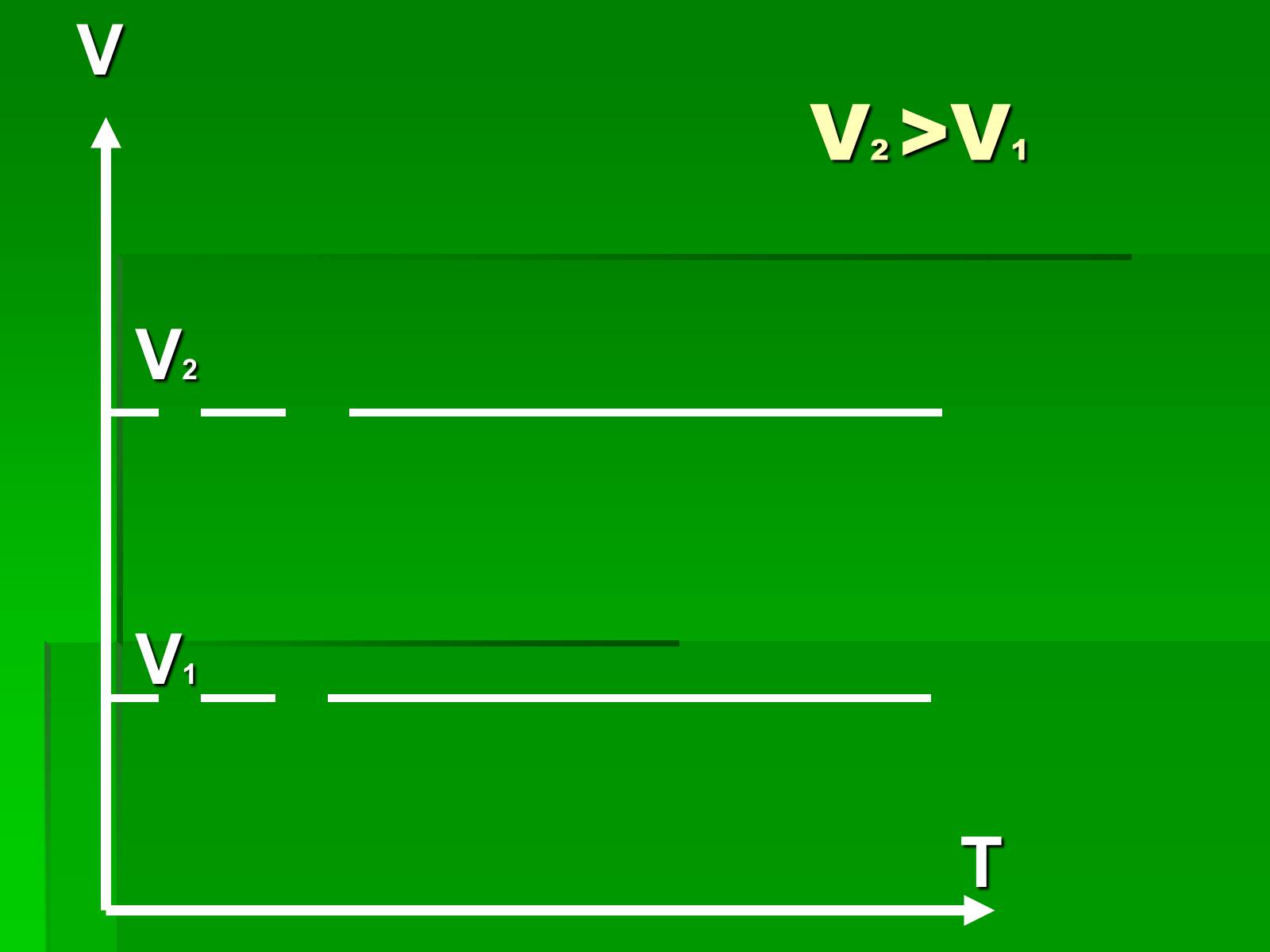
V2 >V1
V
V2
V1
T
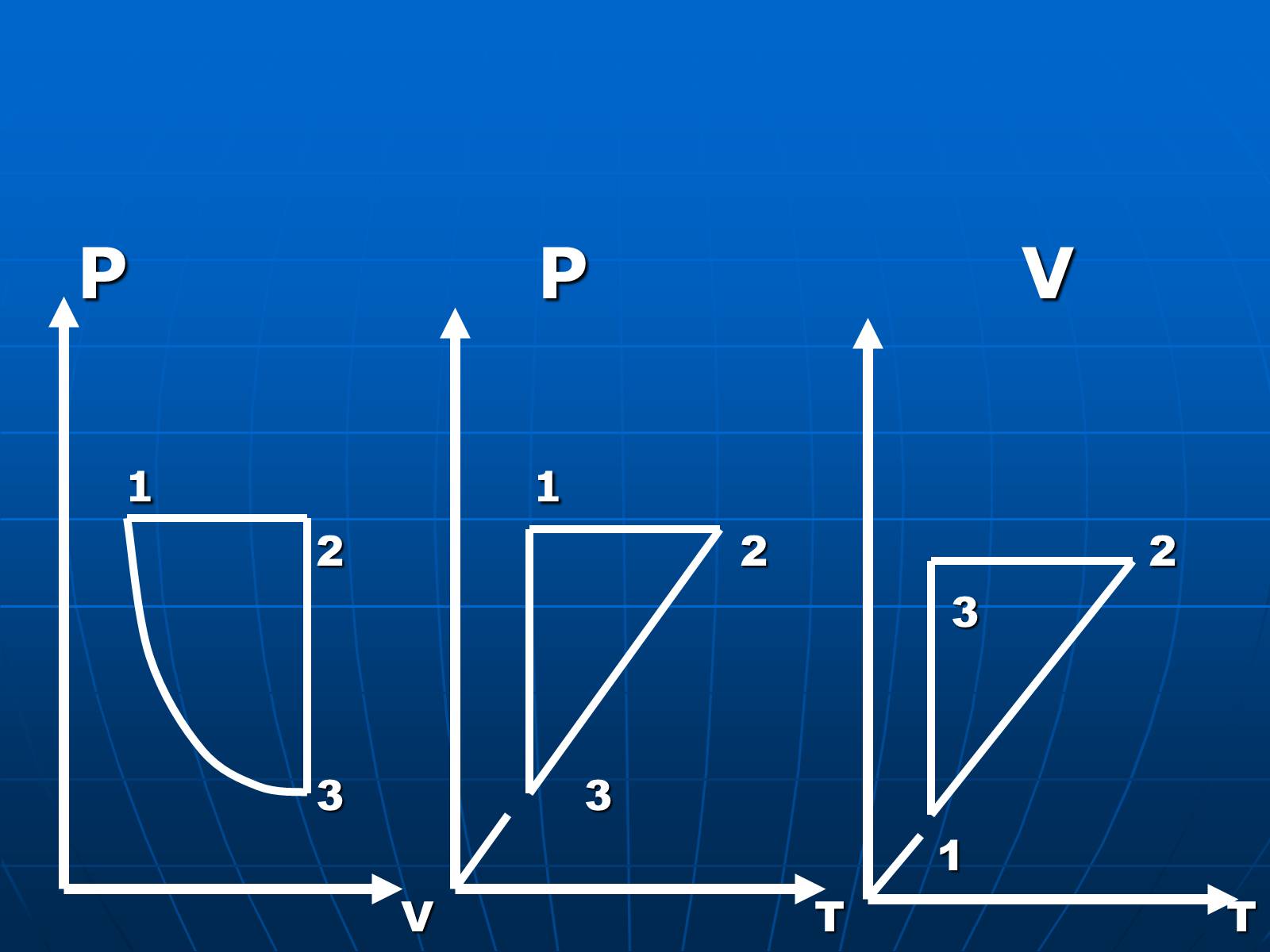
P P V
1 1
2 2 2
3
3 3
1
V T T
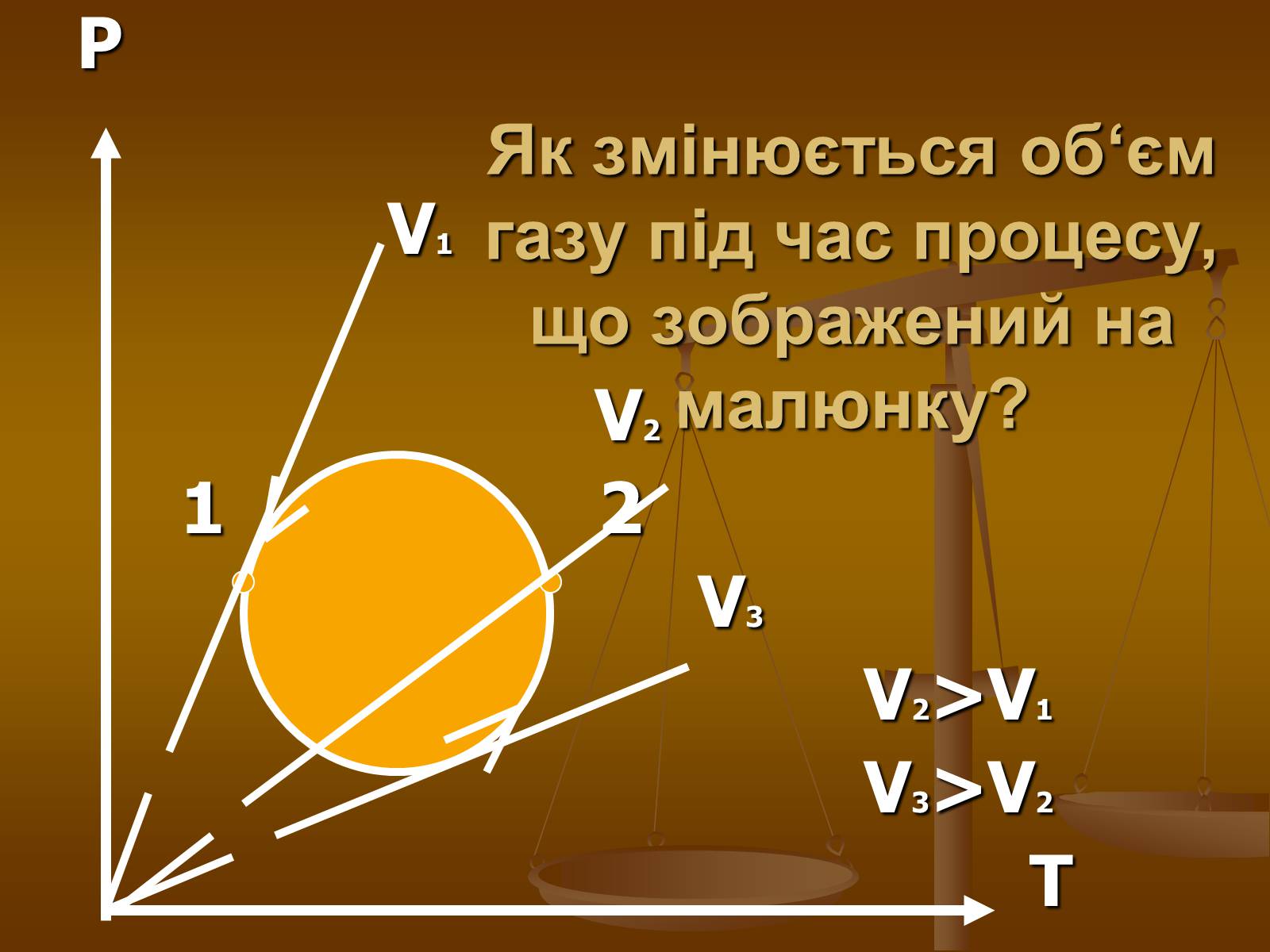
Як змінюється об‘єм газу під час процесу, що зображений на малюнку?
P
V1
V2
1 2
V3
V2>V1
V3>V2
T