Презентація на тему «Модель атома Томсона» (варіант 1)

АТОМНАЯ
ФИЗИКА
Prezentacii.com

Модель атома Томсона
Джозеф Джон Томсон
(1856 – 1940)
Атом представляет собой непрерывно заряженный положительным зарядом шар радиуса порядка 10-10м, внутри которого около своих положений равновесия колеблются электроны.
Недостатки модели:
не объясняла дискретный характер излучения атома и его устойчивость;
не дает возможности понять, что определяет размеры атомов;
оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме (опыты, проводимые Эрнестом Резерфордом).
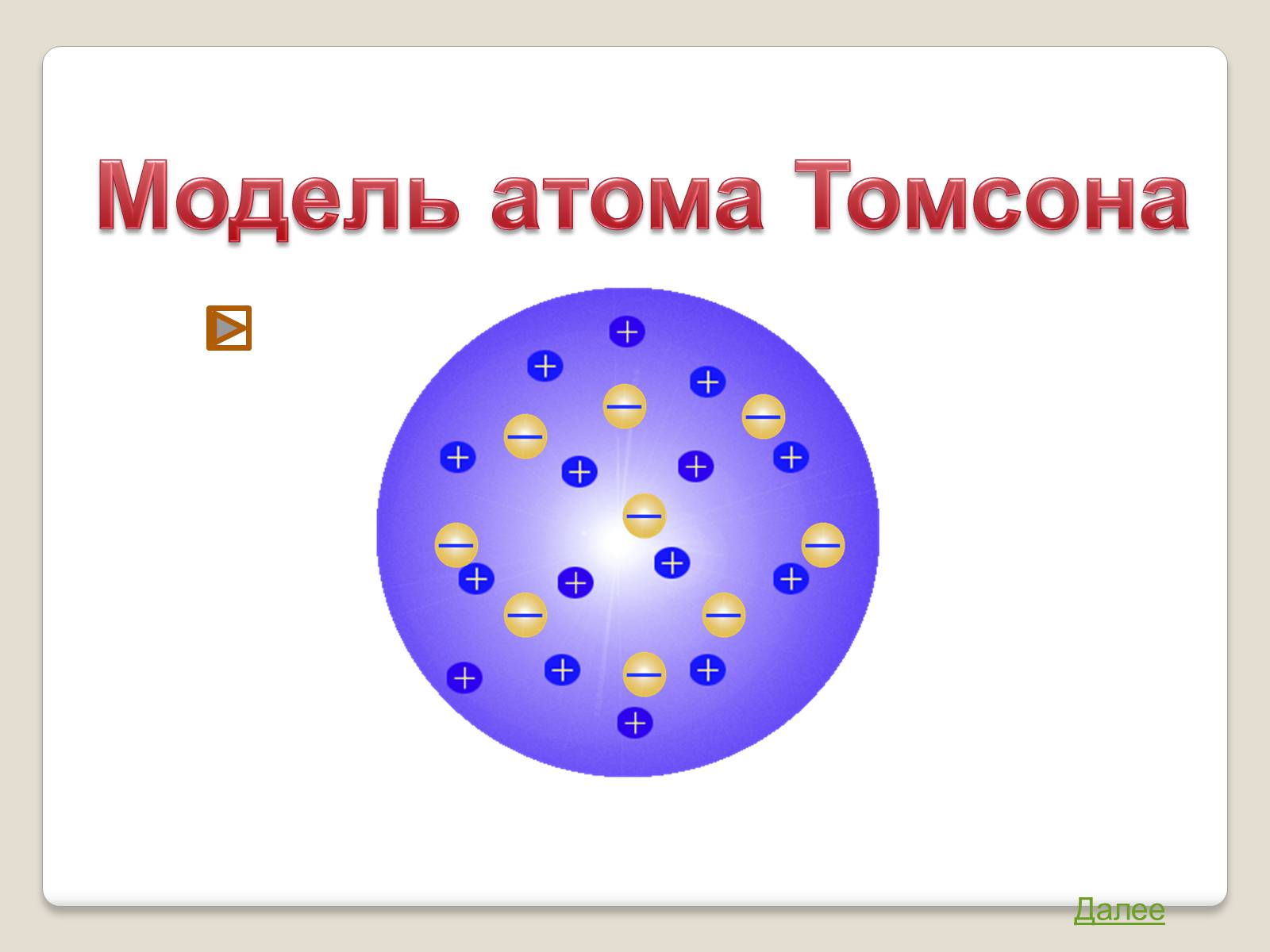
Модель атома Томсона
Далее

Модель атома Резерфорда
Эрнест Резерфорд
(1871 – 1937)
Экспериментально исследовал распределение положительного заряда.
В 1906 г. зондировал атом с помощью α-частиц.
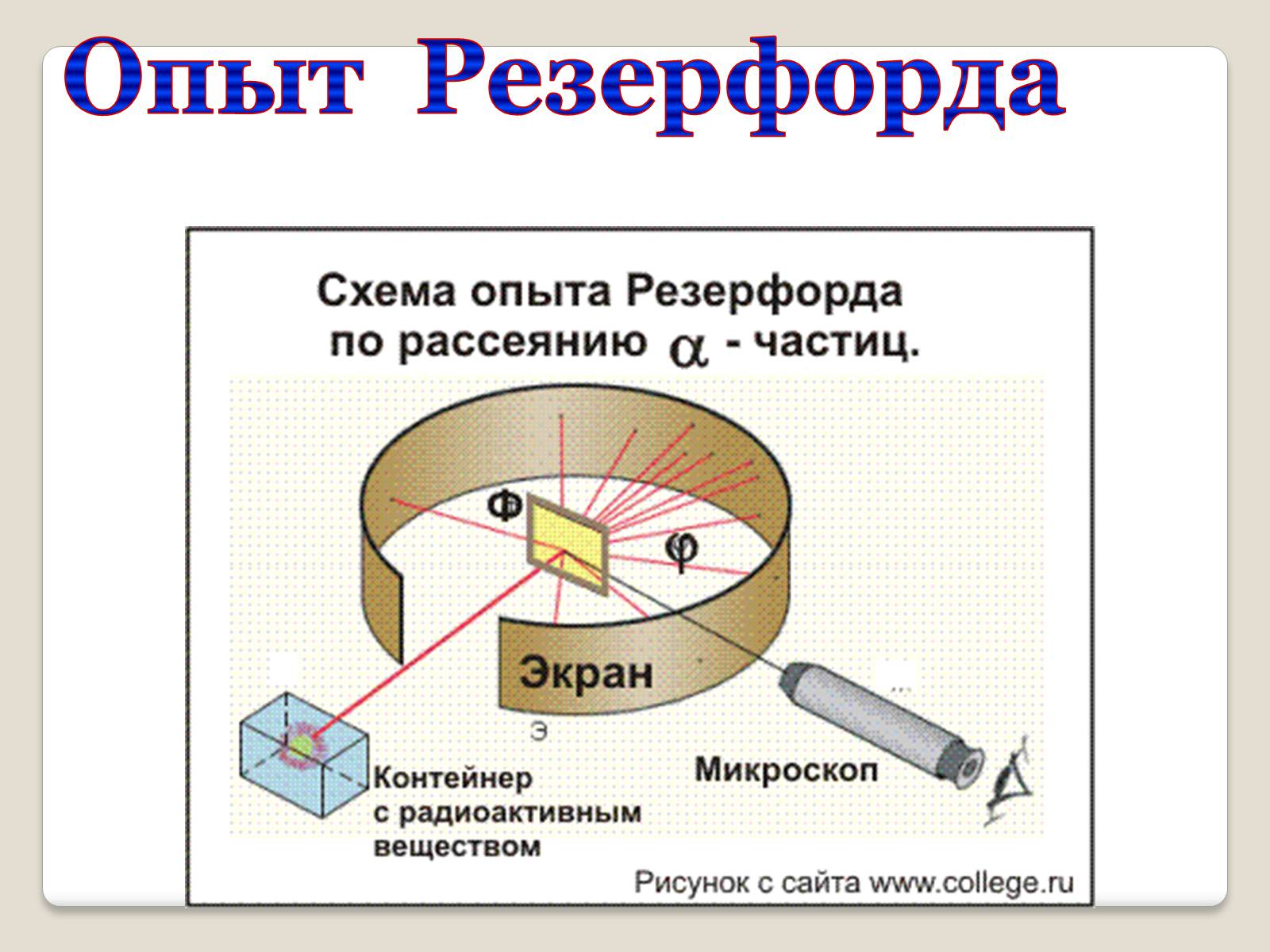
Опыт Резерфорда
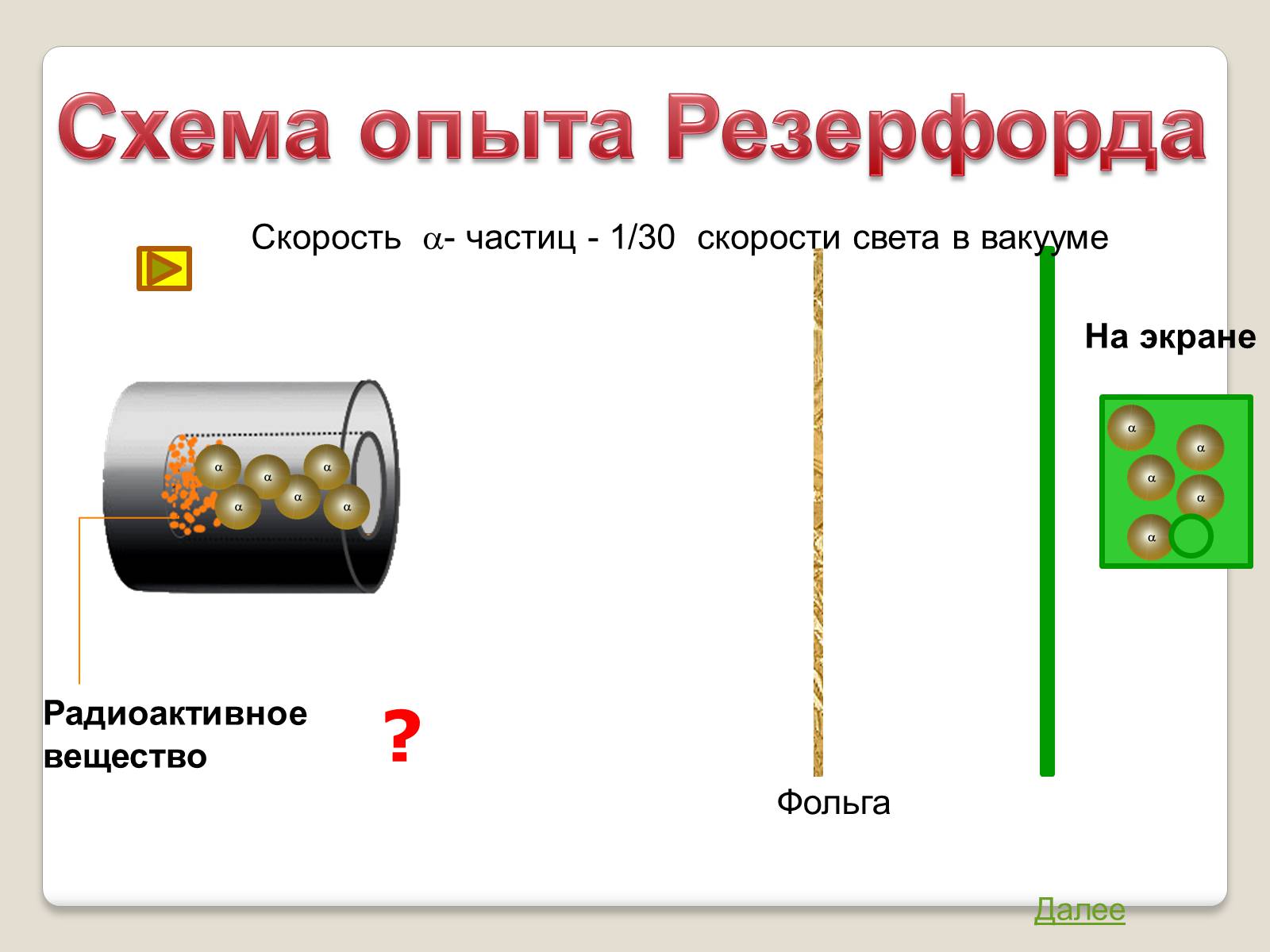
?
Схема опыта Резерфорда
Фольга
Радиоактивное
вещество
Скорость a- частиц - 1/30 скорости света в вакууме
Далее
На экране

Недостатки атома Резерфорда
Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него.
Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприемлемы.
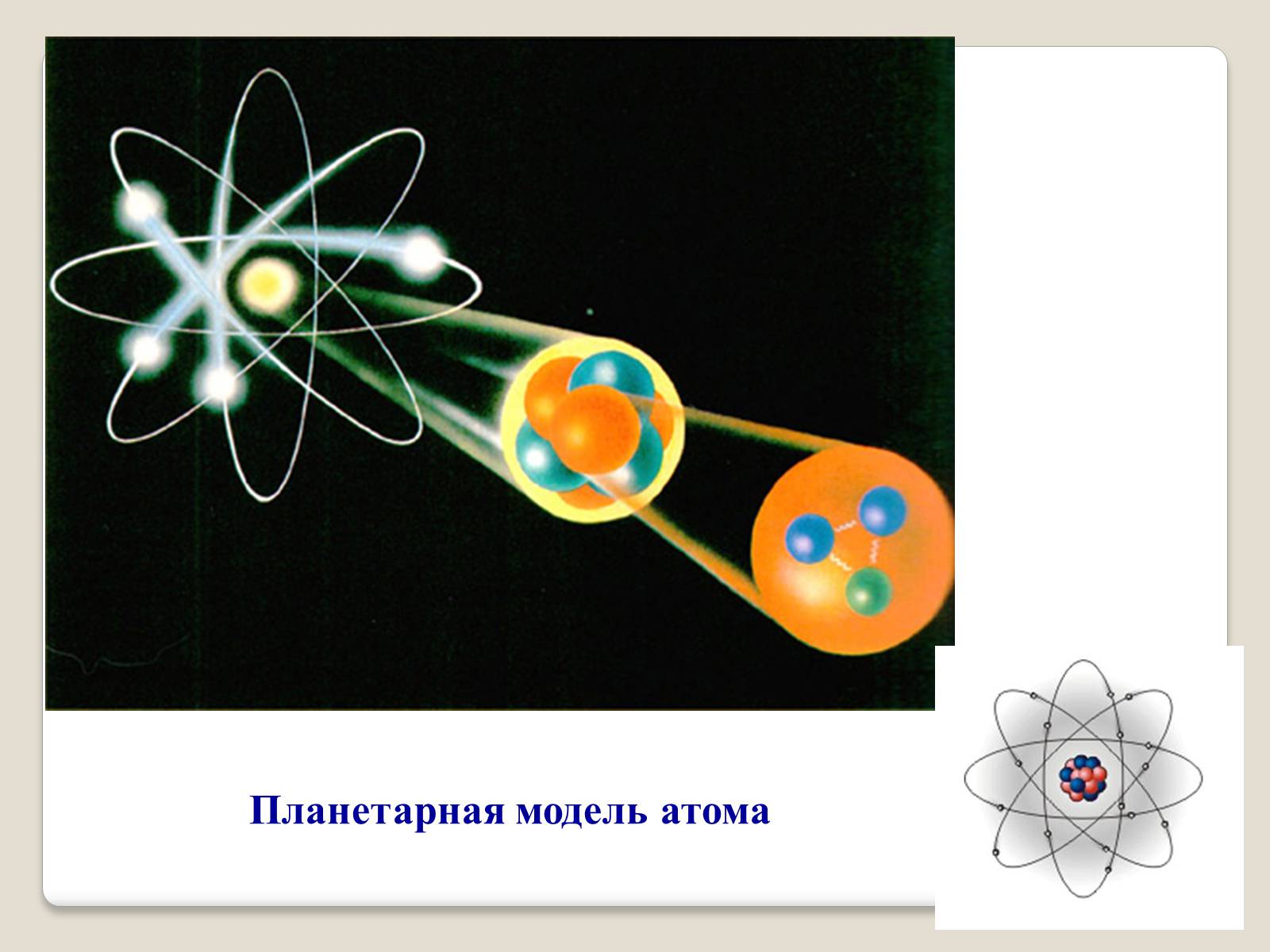
Планетарная модель атома

Квантовые постулаты Бора

Трудности теории Бора
КВАНТОВАЯ МЕХАНИКА -
наука, позволяющая предсказать поведение огромного числа физических систем – от Галактик до атомов и атомных ядер
ВОЛНА
или
ЧАСТИЦА
«Наука вынуждает нас создавать новые теории. Их задача – разрушить стену противоречий, которые часто преграждают дорогу научному прогрессу. Все существенные идеи в науке родились в драматическом конфликте между реальностью и нашими попытками ее понять».
Корпускулярные и волновые свойства частиц следует рассматривать не как взаимоисключающие, а как взаимодополняющие друг друга
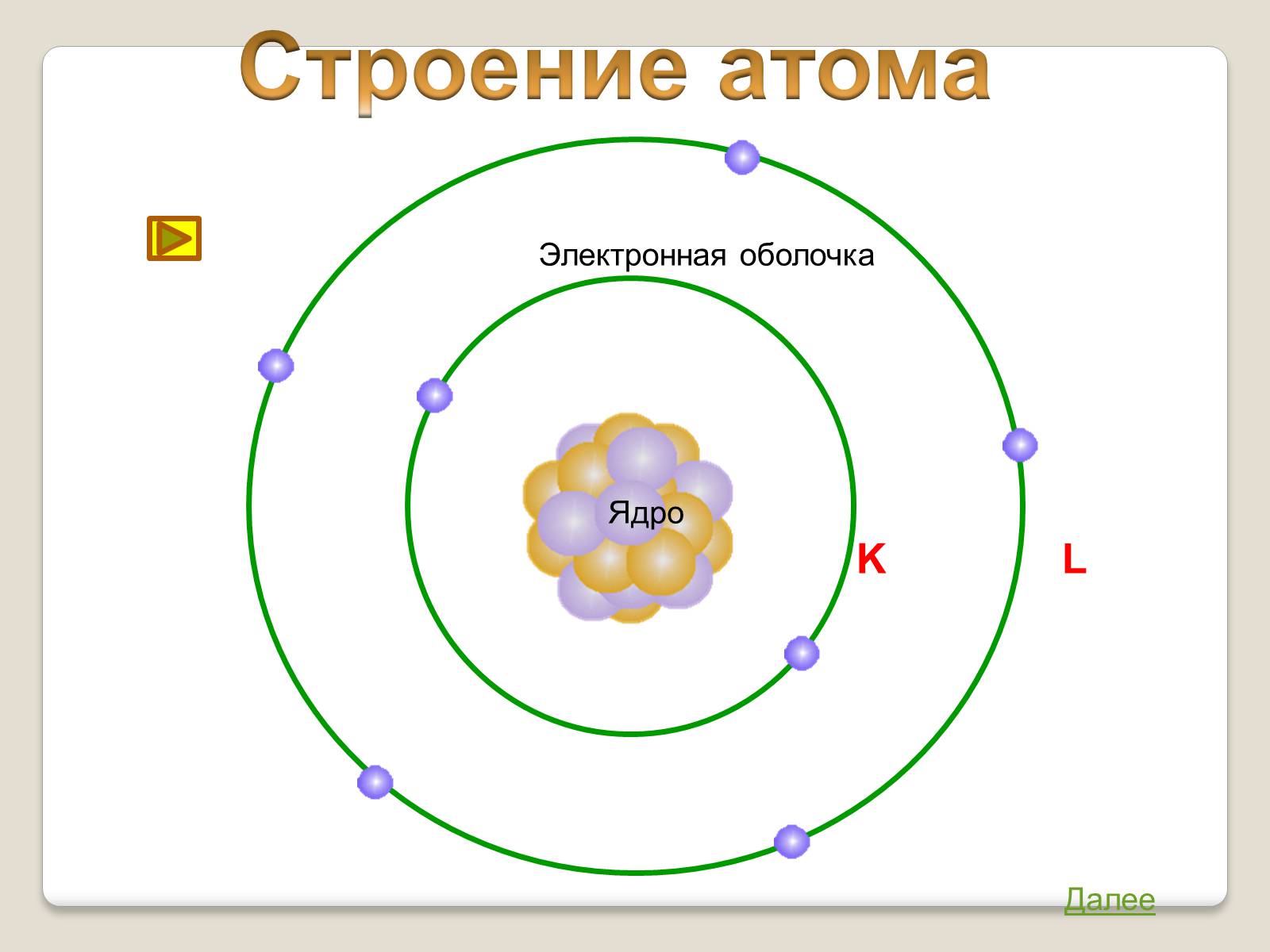
Строение атома
Ядро
Далее
Электронная оболочка
K L

Энергия связи атомных ядер – та энергия, которая необходима для полного расщепления ядра на отдельные частицы.
Закон сохранения энергии энергия связи равна той энергии, которая выделается при образовании ядра из отдельных частиц.
Альберт Эйнштейн
(1879 - 1955)
Уравнение Эйнштейна между массой и энергией:
Точнейшие измерения масс ядер масса покоя ядра Мя всегда меньше суммы масс покоя слагающих его протонов и нейтронов:
- дефект массы.

Уменьшение массы при образовании ядра из частиц уменьшается энергия этой системы частиц на значение энергии связи :
ядро образуется из частиц;
частицы за счет действия ядерных сил на малых расстояниях устремляются с огромным ускорением друг к другу;
излучаются γ- кванты с энергией и массой .
Пример: образование 4 г гелия сопровождается выделением такой же энергии, что и сгорание 1,5 - 2 вагонов каменного угла.
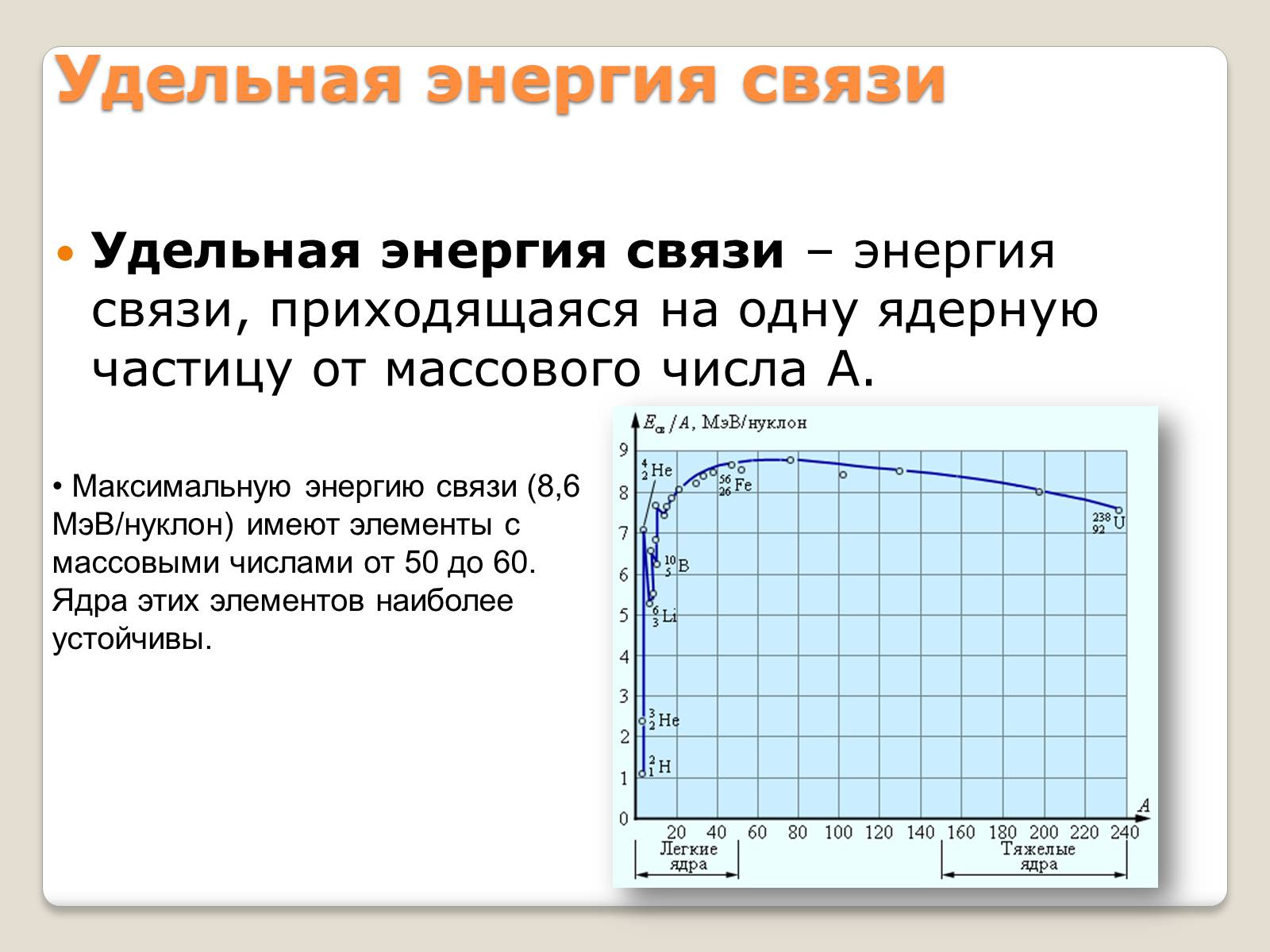
Удельная энергия связи
Удельная энергия связи – энергия связи, приходящаяся на одну ядерную частицу от массового числа А.
Максимальную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60.
Ядра этих элементов наиболее устойчивы.

Ядерные силы являются короткодействующими.
Нуклоны, находящиеся на поверхности ядра, взаимодействуют с меньшим числом соседей, чем нуклоны внутри ядра.
Энергия связи нуклонов на поверхности меньше, чем у нуклонов внутри ядра.
Чем больше ядро, тем большая часть от общего числа нуклонов оказывается на поверхности энергия связи в среднем на один нуклон меньше у легких ядер.
У тяжелых ядер удельная энергия связи уменьшается за счет растущей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Уменьшение удельной энергии связи у легких элементов объясняется поверхностными эффектами.

Ядерные силы ( сильное взаимодействие)-силы, действующие между нуклонами в ядре и обеспечивающие существование устойчивых ядер
Являются силами притяжения
Короткодействующие (~ 2*10 м)
Действуют одинаково между p-p p-n n-n
Радиоактивность - доказательство сложного строения атомов.
Эрнест Резерфорд

Радиоактивные превращения
Фредерик Содди 1903г. (до открытия атомного ядра)
Правило смещения
α – распад:
β – распад: