Презентація на тему «Електричний струм в різних середовищах: металах, рідинах, газах»

Підготувалаучениця 11-А класуПрокопенко Анна
Електричний струм в різних середовищах : металах, рідинах,газах .Та його використання

Носіями струму в металах є вільні електрони, їх розміщені на зовнішній оболонці, слабко зв'язані з ядром атома. Їх називають зовнішніми або валентними електронами, оскільки вони визначають властивість даного елемента – здатність його атомів входити в хімічний зв'язок з певним числом інших атомів.
Електричний струм у металах

. Сукупність вільних електронів можна розглядати як електронний газ, що має властивості деякого ідеального газу. Якщо ж електричне поле відсутнє, вільні електрони рухаються хаотично.

Надпровідності-це опір металів обумовлений дефектами решітки і тепловими коливаннями решітки. Під час охолодження деяких металів і сплавів нижче певної критичної температури їх опір наближується до нуля.

Гази за нормальних умов погано проводять електричний струм,тобто є ізоляторами.

Внаслідок зовнішніх дій (опромінювання ультрафіолетовим, рентгенівським, радіоактивним випромінюванням, нагрівання і т.д.) газ іонізується, тобто від атомів і молекул відриваються електрони. Внаслідок іонізації утворюються позитивні іони і електрони.

Коефіцієнт іонізації-це
- відношення числа іонів N, що виникли, до числа молекул газу N0 в даному об'ємі.

Для різних газів енергія іонізації має різне значення і залежить від будови атома чи молекули. Необхідна умова іонізації – надання електронам значної швидкості: , де Аі - робота іонізації, m i V – відповідні швидкість і маса електронів.
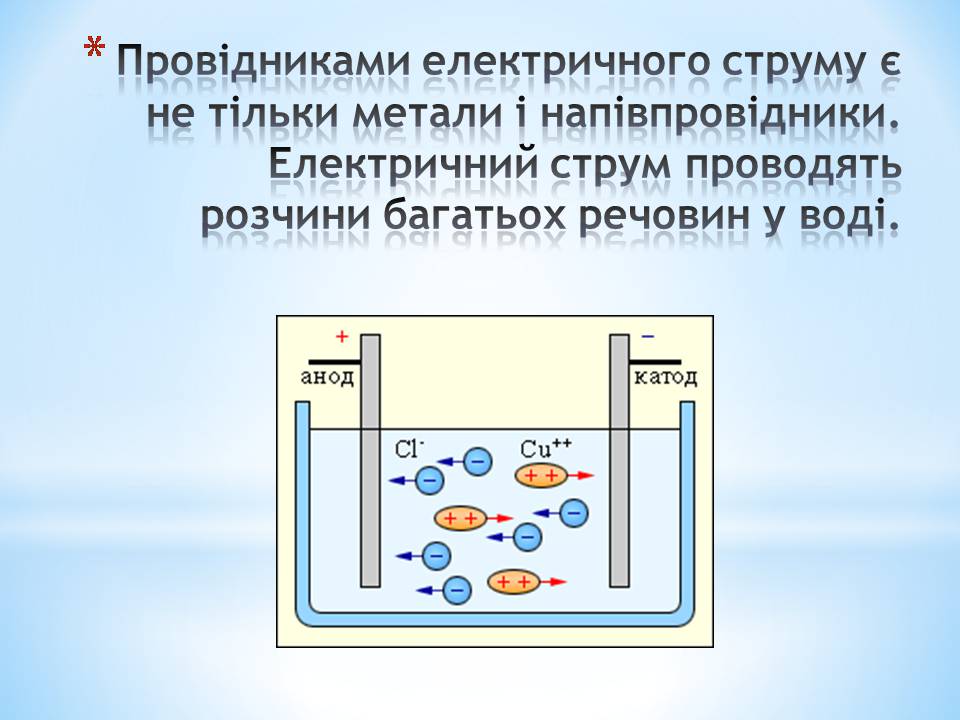
Провідниками електричного струму є не тільки метали і напівпровідники. Електричний струм проводять розчини багатьох речовин у воді.

Проходження електричного струму через електроліт обов'язково супроводжується виділенням речовини в твердому або газоподібному стані на поверхні електродів

Електролізом називають процес виділення речовини на електродах показує, що в електролітах електричні заряди переносять заряджені атоми речовини - іони

Майкл Фарадей на основі експериментів з різними електролітами встановив, що при електролізі маса m виділяється на електроді речовини пропорційна пройшов через електроліт заряду Δq чи силі струму I і часу Δt проходження струму:
m = kΔq = kIΔt.