Презентація на тему «Електричний струм в електролітах»

Електричний струм в електролітах
Алєксєєнко Вероніка 9-Б

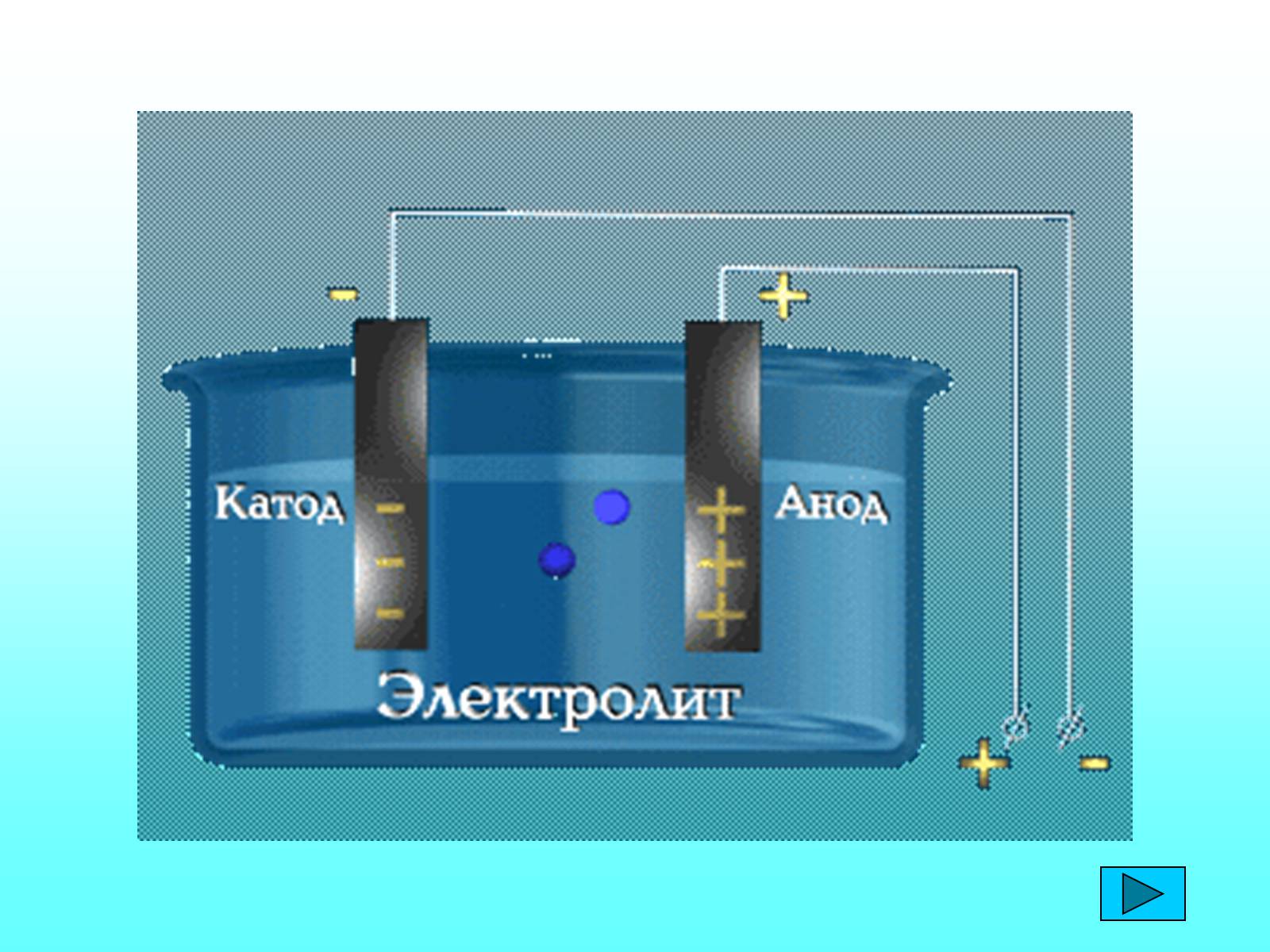
Електроліти— речовини, водні розчини або розплави яких проводять електричний струм.
Електроди – провідники, які проводять електричний струм до певної ділянки.
Електролітична дисоціація - розпад молекул електроліту на позитивні й негативні йони в розчині.
Електроліз - зміна хімічного складу розчину або розплаву, зумовлена втратою або приєднанням електронів йонами.
Закон Фарадея (закон електролізу):
маса m речовини, що виділилась на електроді, пропорційна заряду q, що пройшов через електроліт
Електроліти— речовини, водні розчини або розплави яких проводять електричний струм.
Електроди – провідники, які проводять електричний струм до певної ділянки.
Електролітична дисоціація - розпад молекул електроліту на позитивні й негативні йони в розчині.
Електроліз - зміна хімічного складу розчину або розплаву, зумовлена втратою або приєднанням електронів йонами.
Закон Фарадея (закон електролізу):
маса m речовини, що виділилась на електроді, пропорційна заряду q, що пройшов через електроліт
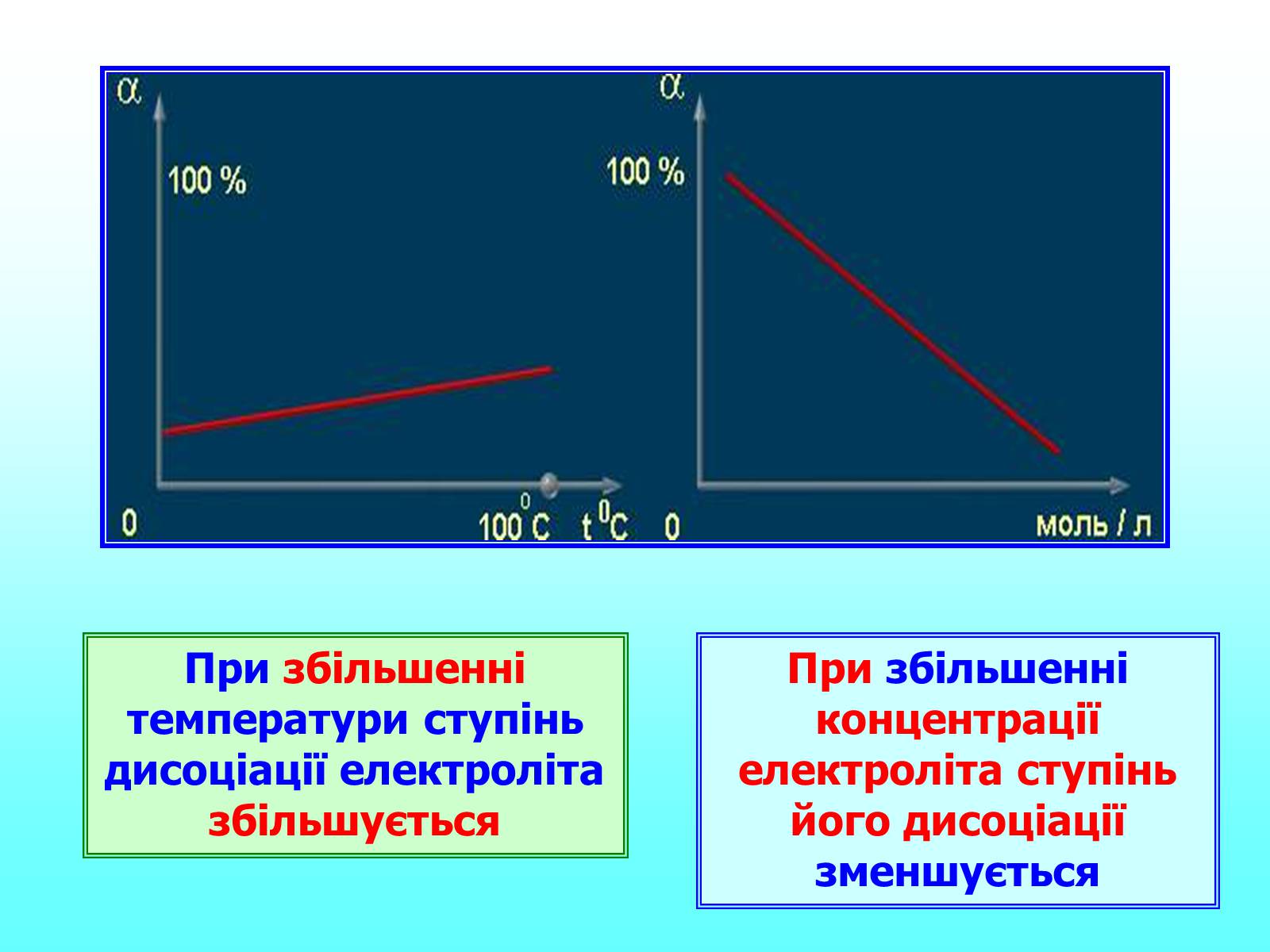
При збільшенні температури ступінь дисоціації електроліта збільшується
При збільшенні концентрації електроліта ступінь його дисоціації зменшується

Оскільки заряд у водних розчинах чи розплавах електролітів переноситься іонами, то таку провідність називають іонною. За іонної провідності проходження струму пов'язано із перенесенням речовини. На електродах відбувається виділення речовин, які входять до складу електроліту. На аноді негативно заряджені частинки віддають свої зайві електрони (окиснювальна реакція), а на катоді позитивні іони отримують електрони (реакція відновлення).
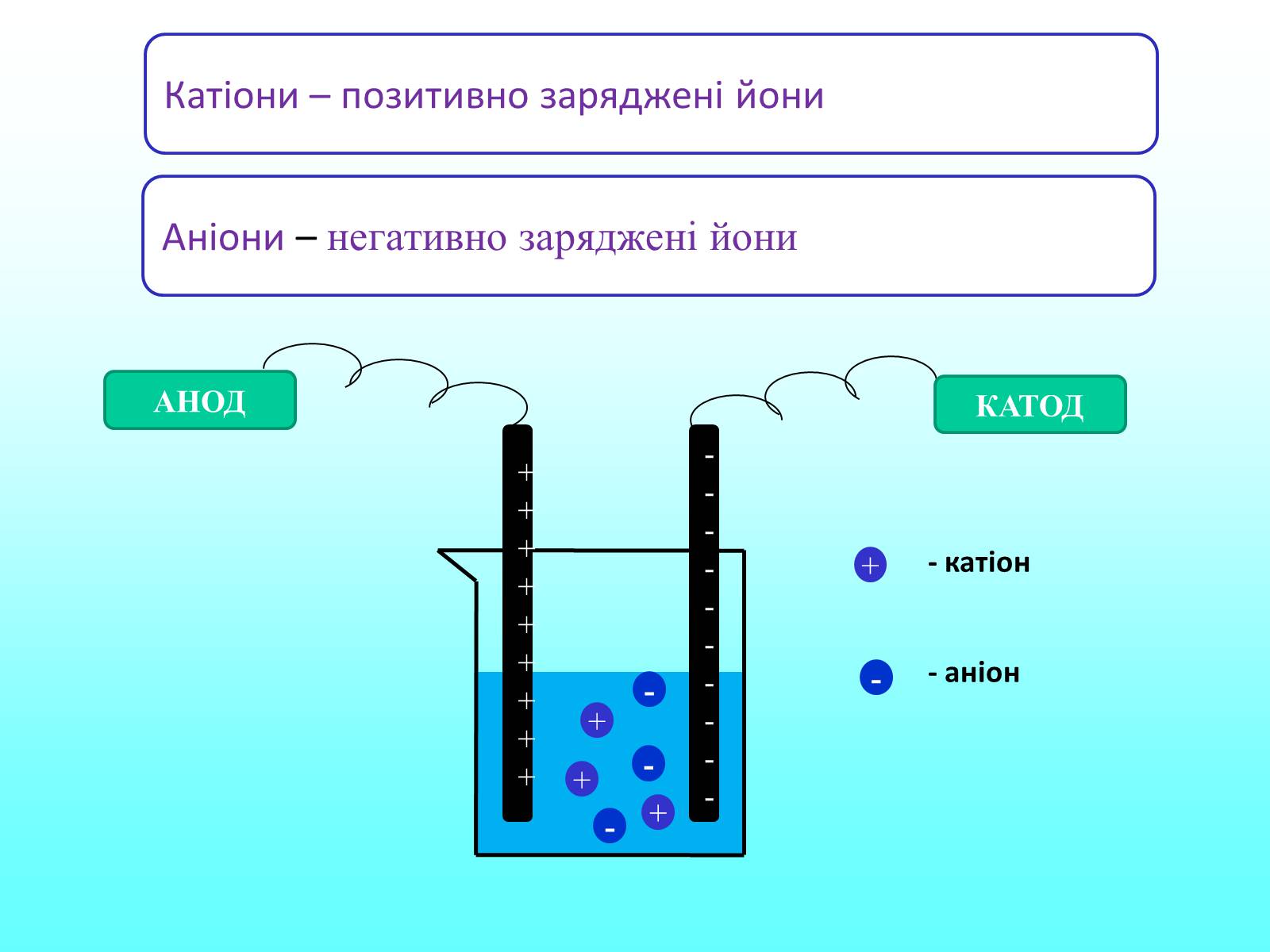
Катіони – позитивно заряджені йони
+++++++++
----------
АНОД
КАТОД
+
+
+
-
-
-
+
-
- катіон
- аніон
Аніони – негативно заряджені йони
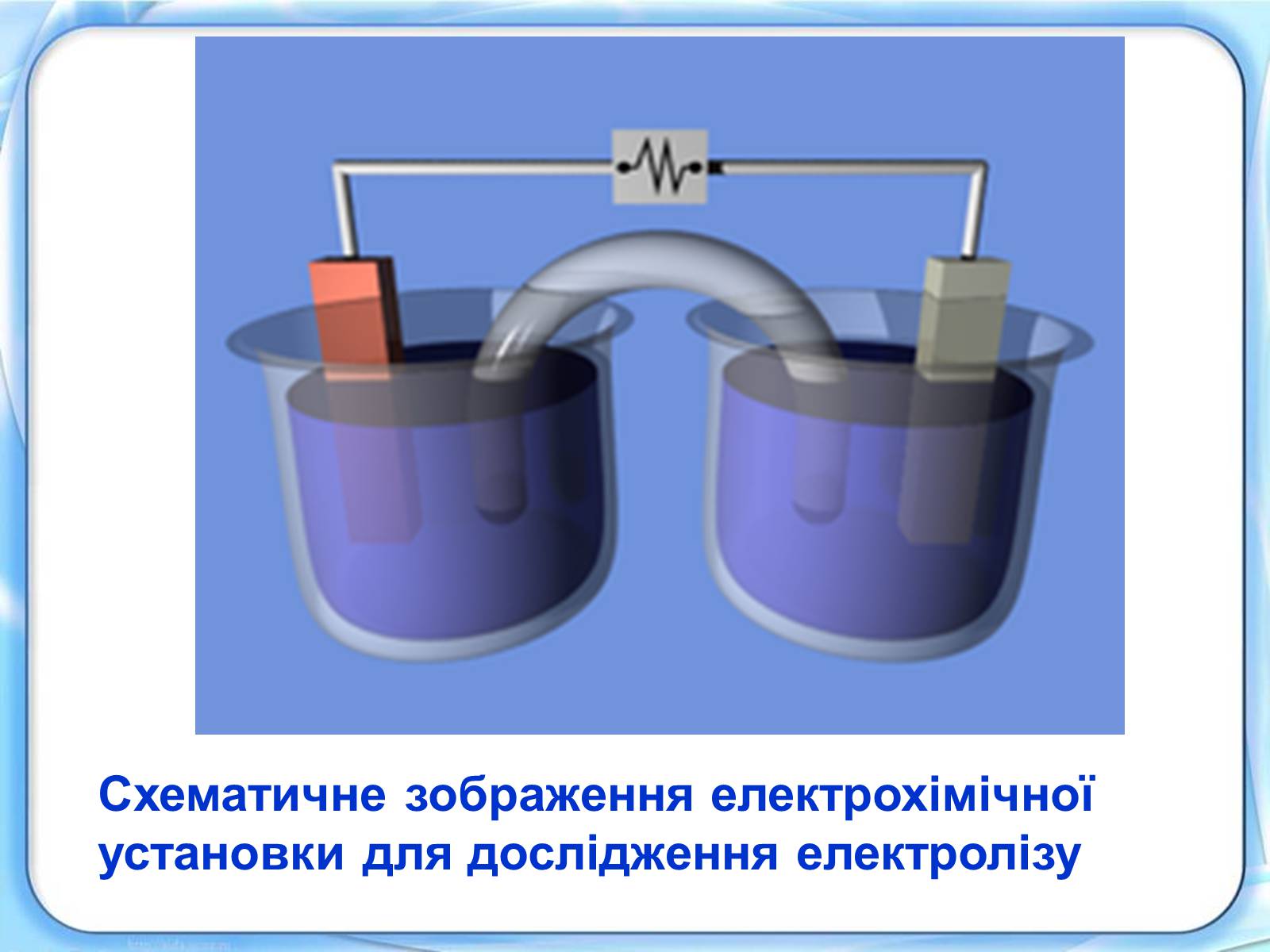
Схематичне зображення електрохімічної установки для дослідження електролізу
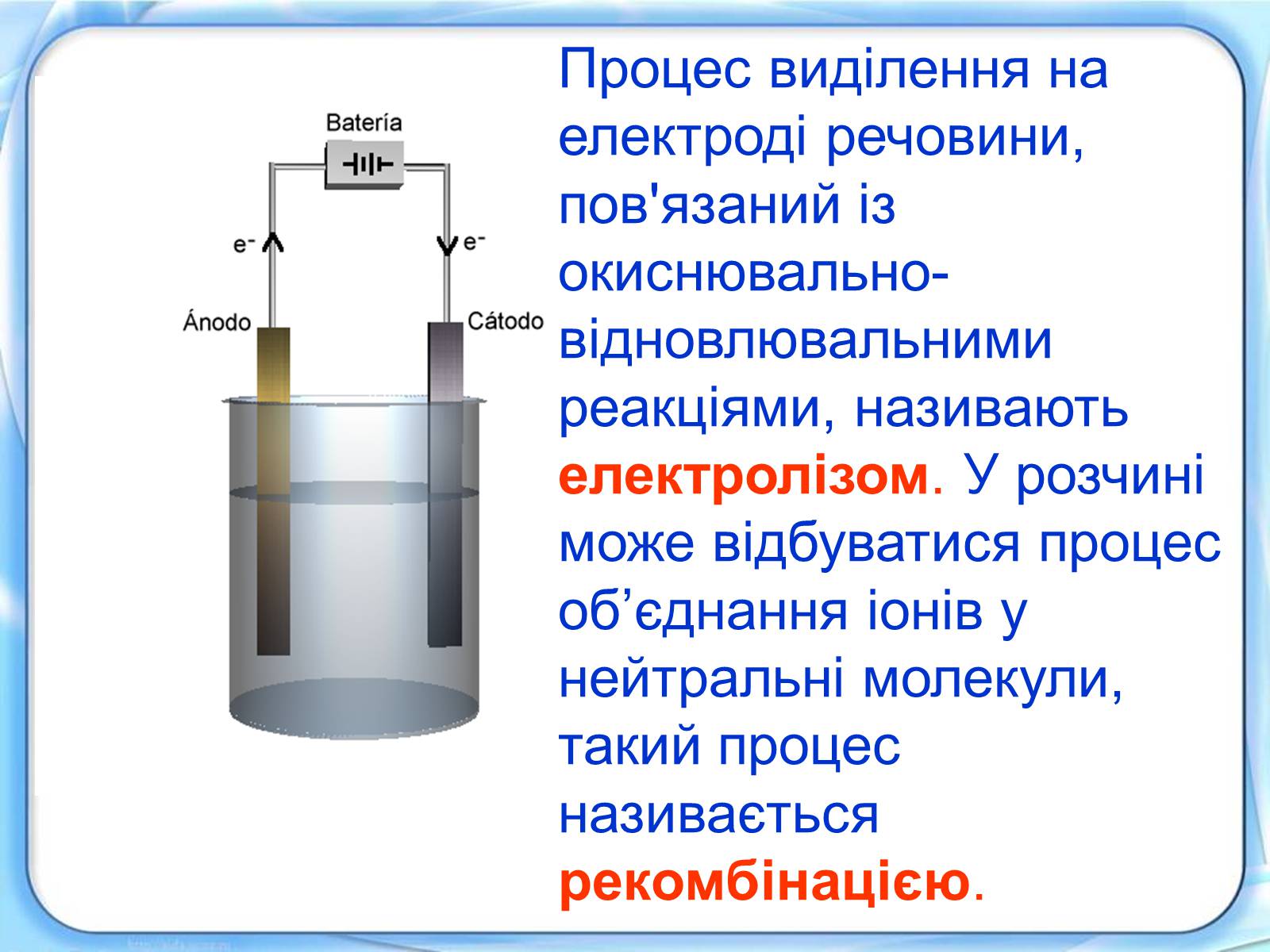
Процес виділення на електроді речовини, пов'язаний із окиснювально-відновлювальними реакціями, називають електролізом. У розчині може відбуватися процес об'єднання іонів у нейтральні молекули, такий процес називається рекомбінацією.

m = kq = kIΔt
Маса речовини, яка виділяється на катоді за час Δt, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Електроліз - зміна хімічного складу розчину або розплаву, зумовлена втратою або приєднанням електронів йонами.

Явище електролізу має широке застосування в електрометалургії (добування чистих металів); у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.