Презентація на тему «Електроліз» (варіант 5)

Електроліз
Підготувала презентацію
Учениця 9-б класу
НВК №1
Качур Діана
Електроліз — розклад речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються. В результаті електролізу на електродах виділяються речовини в кількостях, пропорційних кількості пропущеного струму. Електроліз застосовується для одержання багатьох речовин (металів, водню, хлору та ін.), при гальваностегії (нанесенні металічних покриттів), гальванопластиці (відтворенні форми предметів), а також у хімічному аналізі (полярографія).
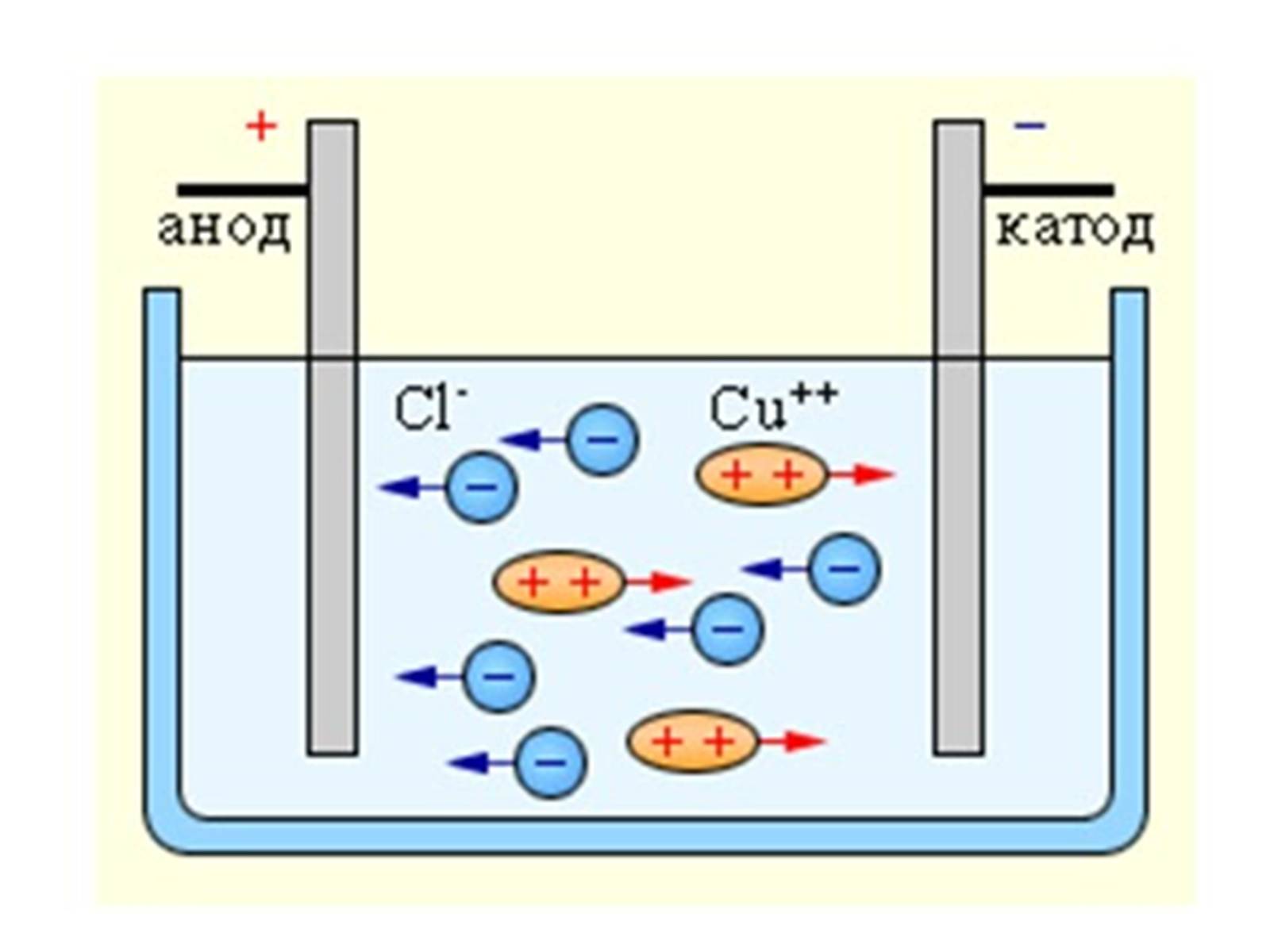
Електроліз — розклад речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються. В результаті електролізу на електродах виділяються речовини в кількостях, пропорційних кількості пропущеного струму. Електроліз застосовується для одержання багатьох речовин (металів, водню, хлору та ін.), при гальваностегії (нанесенні металічних покриттів), гальванопластиці (відтворенні форми предметів), а також у хімічному аналізі (полярографія).

Майкл Фарадей
Відкриття електролізу стало можливим тільки лише після створення Вольтом батареї гальванічних елементів (1799).
У 1800 англійські дослідники Нікольсон і Карлейль відкрили електроліз: вони встановили, що під час проходження постійного струму у воді чи водних розчинах вода розкладається на водень і кисень. Результати пізніших досліджень, завершених Майклом Фарадеєм 1833, були сформульовані у вигляді законів.
Вольт

Реакції, які відбуваються при електролізі на електродах називаються вторинними. Первинними є реакції дисоціації в електроліті. Поділ реакцій на первинні й вторинні допоміг Майклу Фарадею встановити закони електролізу.
Вперше паралельне з'єднання приймачів електричного струму запропонував російський фізик В. В. Петров під час дослідів з електролізу. Учений проводив одночасне розкладання води в декількох скляних трубках, приєднаних до одного джерела струму.

Електрохімічні процеси широко застосовуються в різних галузях сучасної техніки, в аналітичній хімії, біохімії і т. д. У хімічній промисловості електролізом одержують хлор і фтор, луги, хлорат і перхлорат, надсірчану кислоту і персульфати, хімічно чисті водень і кисень і т. д. При цьому одні речовини одержують шляхом відновлення на катоді, інші — електроокисненням на аноді.

Електроліз в гідрометалургії є однією з стадій переробки металовмісткої сировини, що забезпечує отримання товарних металів.
У кольоровій металургії електроліз використовується для добування металів з руд та їх очищення. Електролізом з розплавлених середовищ отримують алюміній, магній, титан, цирконій, уран, берилій та ін Для рафінування (очищення) металу електролізом з нього відливають пластини і поміщають їх як анодів в електролізер. При пропущенні струму метал, що підлягає очищенню, піддається анодному розчиненню, тобто переходить у розчин у вигляді катіонів. Потім ці катіони металу розряджаються на катоді, завдяки чому утворюється компактний осад вже чистого металу. Домішки, що знаходяться в аноді, або залишаються нерозчинними, або переходять в електроліт і видаляються.

Гальванотехніка — область прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їх солей. Гальванотехніка ділиться на гальваностегію і гальванопластику.
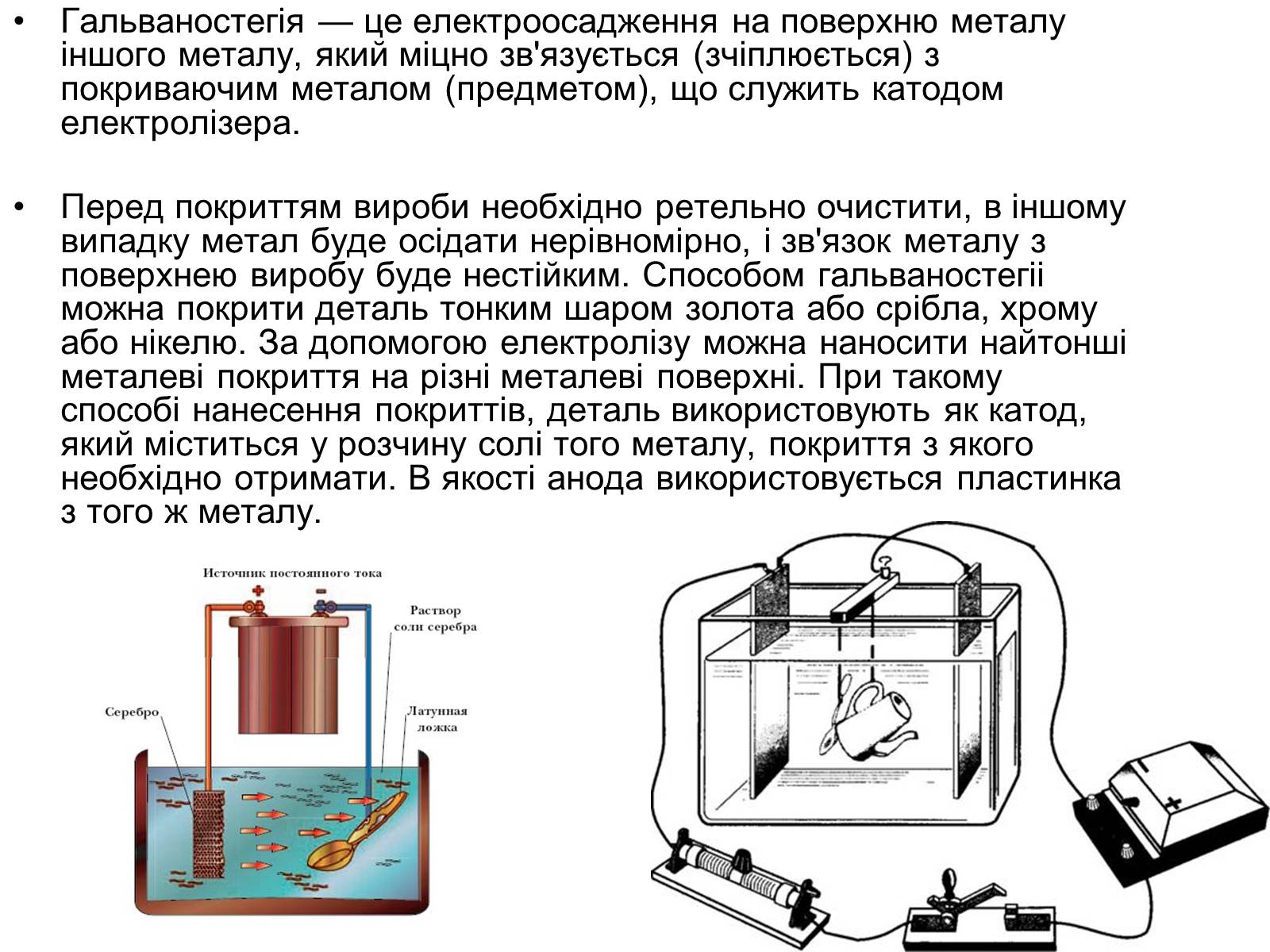
Гальваностегія — це електроосадження на поверхню металу іншого металу, який міцно зв'язується (зчіплюється) з покриваючим металом (предметом), що служить катодом електролізера.
Перед покриттям вироби необхідно ретельно очистити, в іншому випадку метал буде осідати нерівномірно, і зв'язок металу з поверхнею виробу буде нестійким. Способом гальваностегіі можна покрити деталь тонким шаром золота або срібла, хрому або нікелю. За допомогою електролізу можна наносити найтонші металеві покриття на різні металеві поверхні. При такому способі нанесення покриттів, деталь використовують як катод, який міститься у розчину солі того металу, покриття з якого необхідно отримати. В якості анода використовується пластинка з того ж металу.

Гальванопластика — одержання шляхом електролізу точних, легко відокремлюваних металевих копій щодо значної товщини з різних як неметалічних, так і металевих предметів, які називаються матрицями.
За допомогою гальванопластики виготовляють бюсти, статуї і т. д.
Гальванопластика використовується для нанесення порівняно товстих металевих покриттів на інші метали (наприклад, освіта «накладного» шару нікелю, срібла, золота і т. д.).

Крім зазначених вище, електроліз знайшов застосування і в інших галузях:
Отримання оксидних захисних плівок на металах (анодування);
Електрохімічна обробка поверхні металевого виробу (поліровка);
Електрохімічне фарбування металів (наприклад, міді, латуні, цинку, хрому та ін);
Очищення води — видалення з неї розчинних домішок. В результаті виходить так звана м'яка вода (за своїми властивостями наближається до дистильованої);
Електрохімічна заточка ріжучих інструментів (наприклад, хірургічних ножів(скальпелів), бритв і т. д.).