Презентація на тему «Електролітична дисоціація»

Електролітична дисоціація- це розпад речовин на йони під час її розчинення або плавлення
Електролітична дисоціація
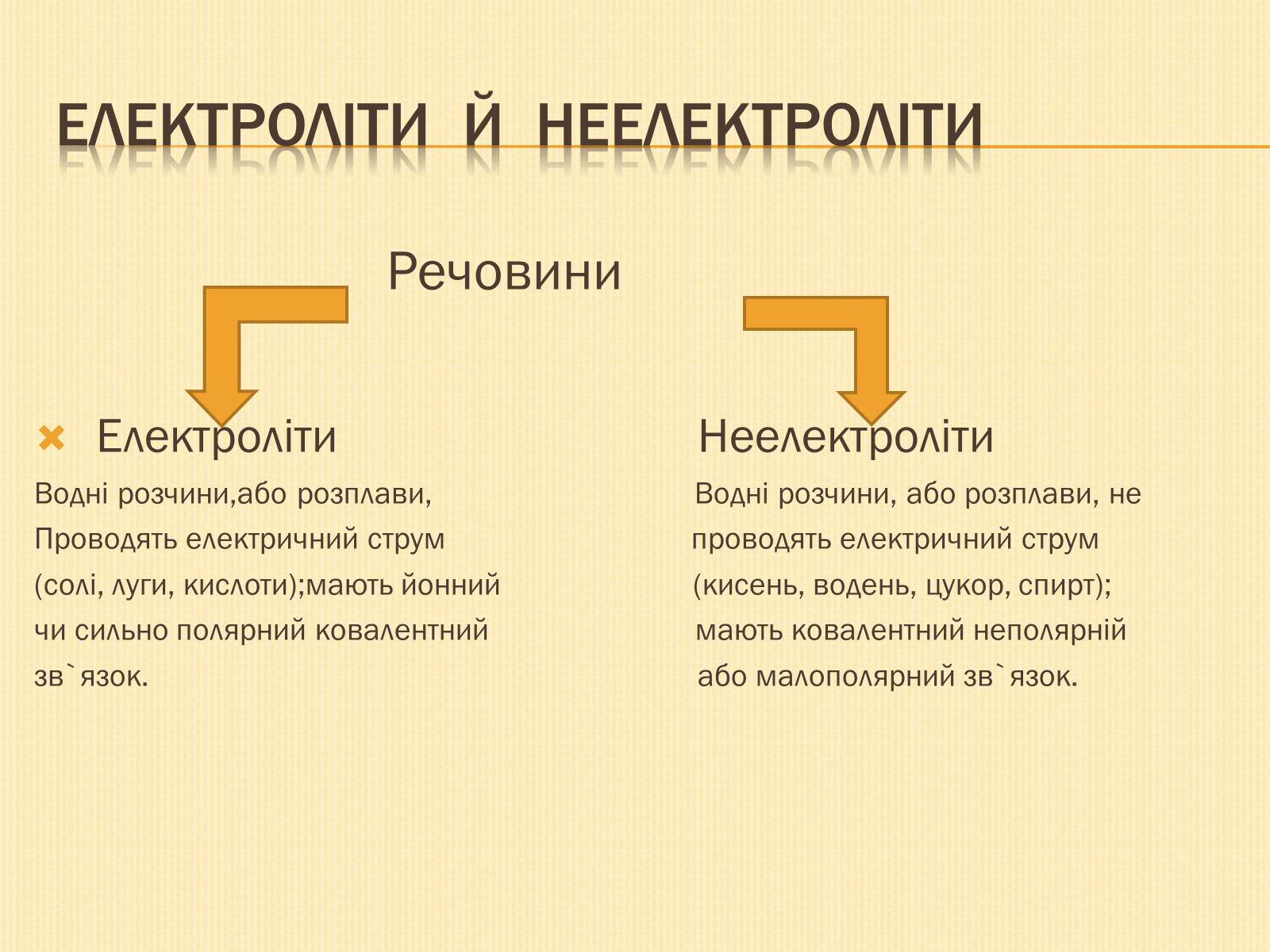
Електроліти й неелектроліти
Речовини
Електроліти Неелектроліти
Водні розчини,або розплави, Водні розчини, або розплави, не
Проводять електричний струм проводять електричний струм
(солі, луги, кислоти);мають йонний (кисень, водень, цукор, спирт);
чи сильно полярний ковалентний мають ковалентний неполярній
зв`язок. або малополярний зв`язок.
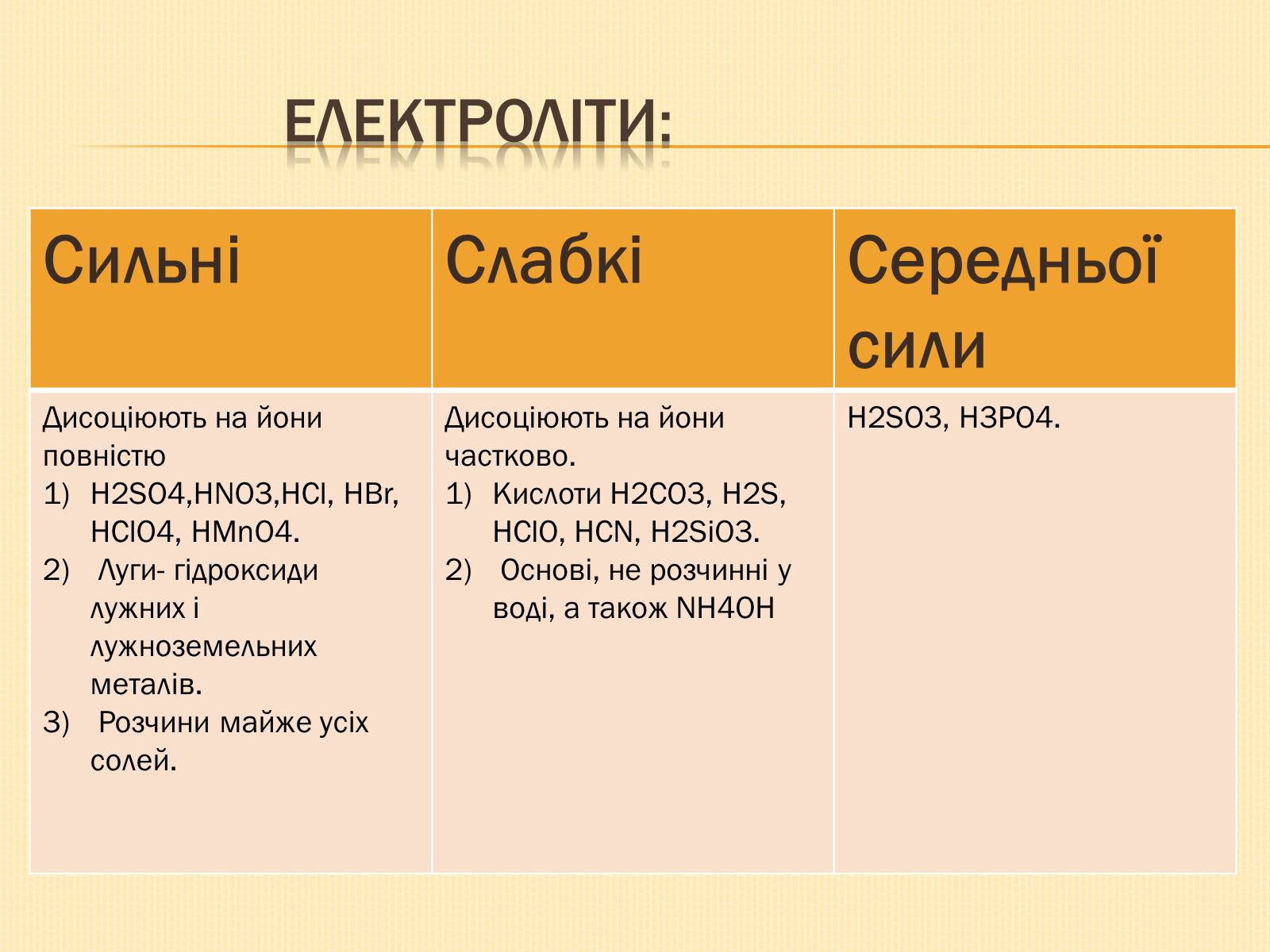
Електроліти:
Сильні
Слабкі
Середньої сили
Дисоціюють на йони повністю
H2SO4,HNO3,HCl, HBr, HClO4, HMnO4.
Луги- гідроксиди лужних і лужноземельних металів.
Розчини майже усіх солей.
Дисоціюють на йони частково.
Кислоти H2CO3, H2S, HClO, HCN, H2SiO3.
Основі, не розчинні у воді, а також NH4OH
H2SO3, H3PO4.
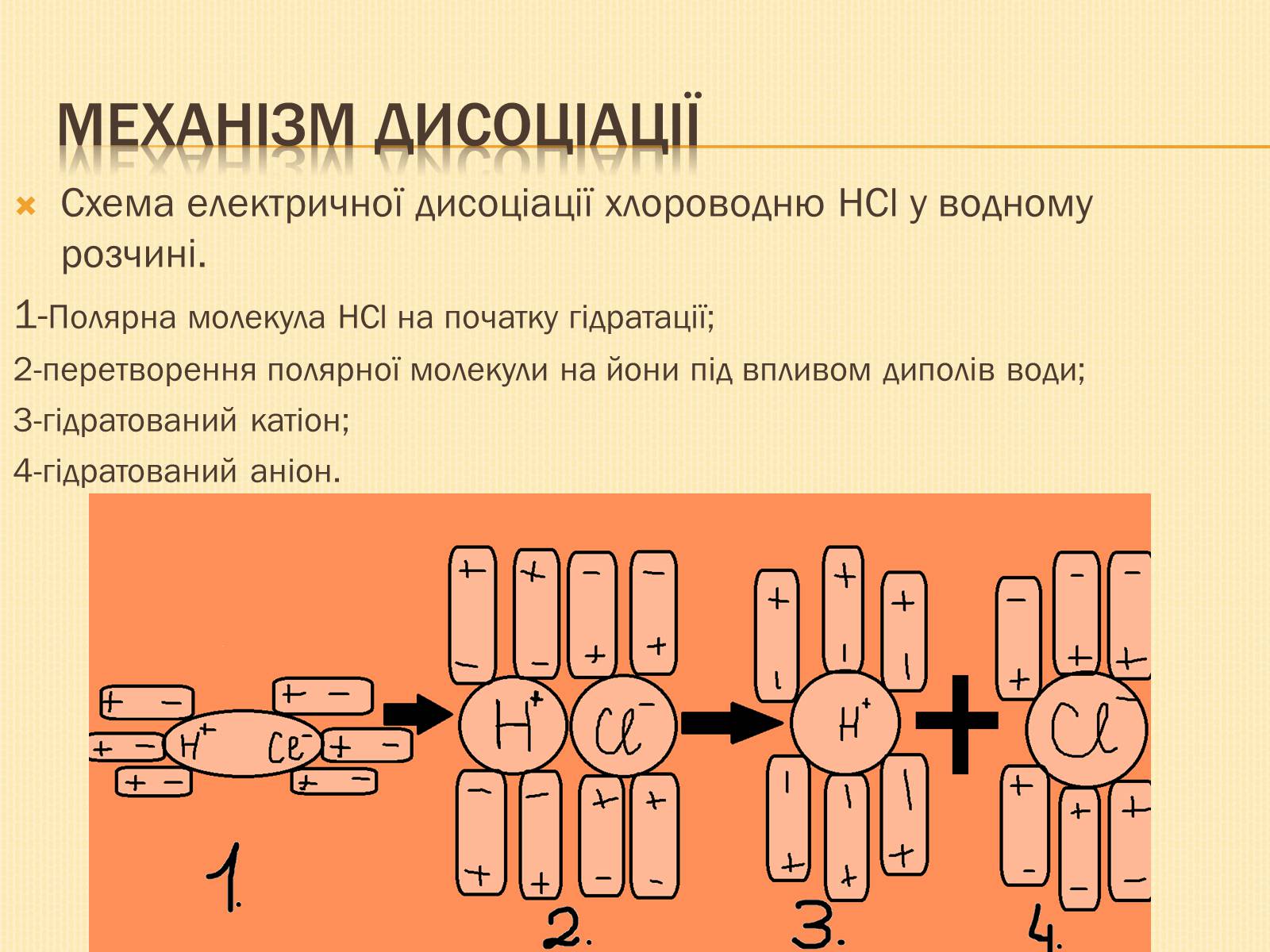
Механізм дисоціації
Схема електричної дисоціації хлороводню HCl у водному розчині.
1-Полярна молекула HCl на початку гідратації;
2-перетворення полярної молекули на йони під впливом диполів води;
3-гідратований катіон;
4-гідратований аніон.
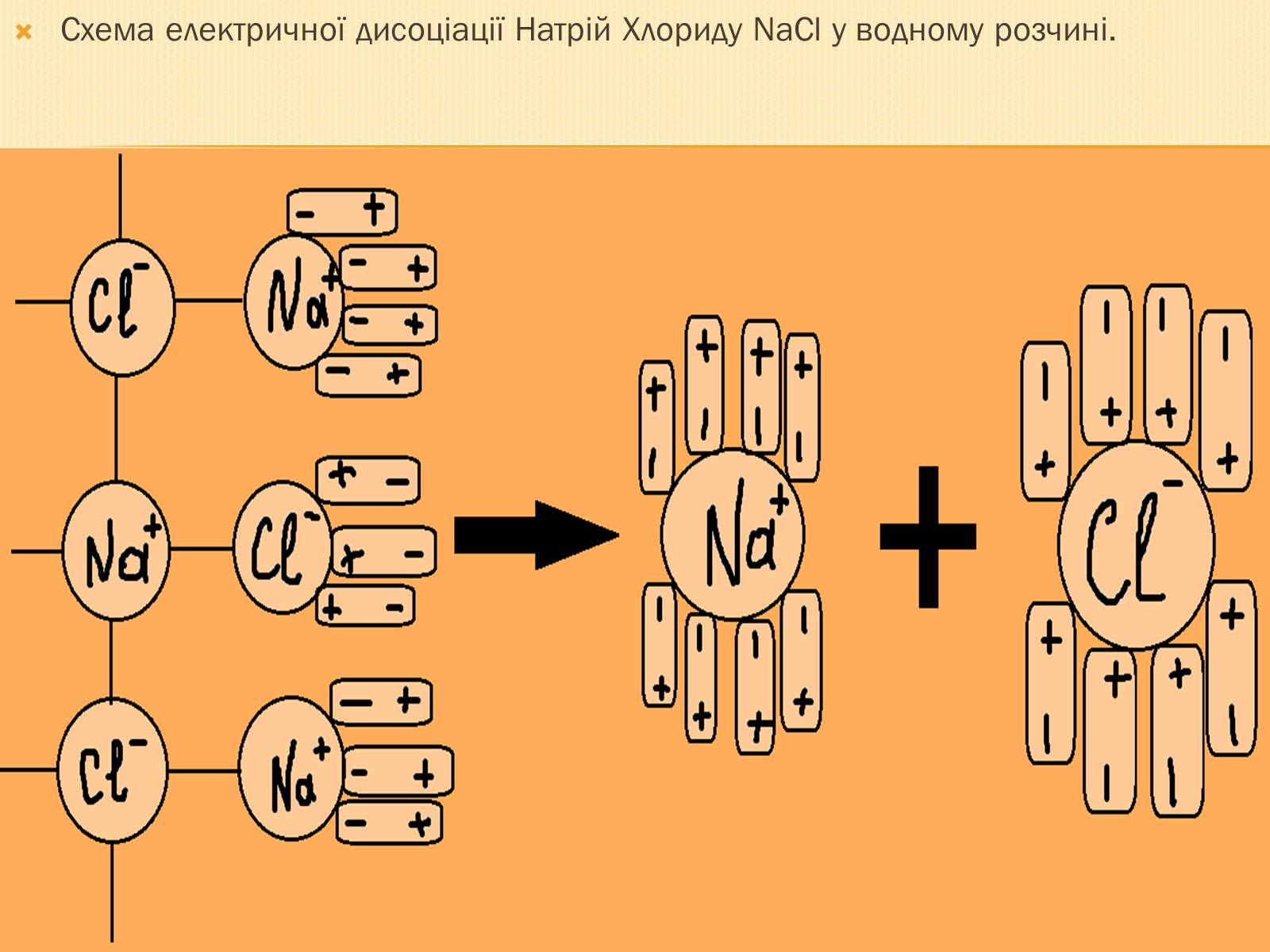
Схема електричної дисоціації Натрій Хлориду NaCl у водному розчині.

Механізм процесу електричної дисоціації
Молекули розчинника відіграють важливу роль у процесі електролітичної дисоціації.
Розглянемо на прикладі води, як молекули розчинника зумовлюють розпад речовин на іони:
молекула води має два ковалентних зв'язки між атомами водню та кисню;
Оксиген — більш електронегативний елемент, ніж Гідроген, і тому спільна електронна пара відтягнута до атома Оксигену. У просторі зв'язки О—Н молекули води розміщені не по прямій лінії, а під кутом близько 105°. Завдяки цьому на одному кінці молекули, з боку атома Оксигену, є певний надлишок негативного електричного заряду, а на протилежному, а з боку атомів Гідрогену,— надлишок позитивного заряду;
молекули води полярні (їх називають диполями).

Реакції обміну між розчинами електронів
Реакції йонного обміну – хімічні реакції, що відбуваються у розчинах електролітів за участі йонів без зміни ступенів окиснення елементів.
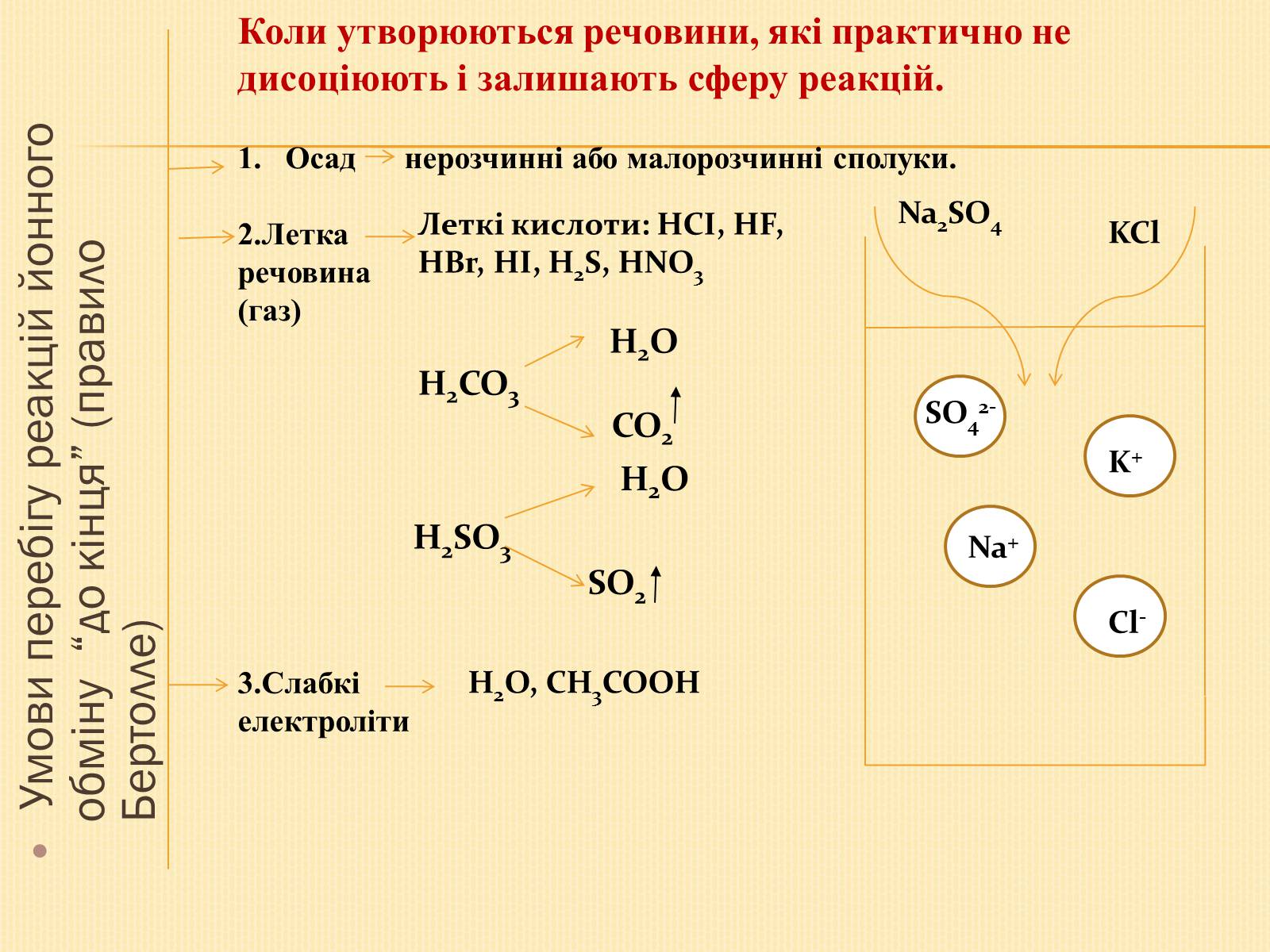
Умови перебігу реакцій йонного обміну “до кінця” (правило Бертолле)
Коли утворюються речовини, які практично не дисоціюють і залишають сферу реакцій.
Осад нерозчинні або малорозчинні сполуки.
2.Летка
речовина
(газ)
Леткі кислоти: НСІ, НF, HBr, HI, H2S, HNO3
H2O
H2CO3
CO2
H2SO3
SO2
H2O
3.Слабкі
електроліти
H2O, CH3COOH
Na+
K+
SO42-
Cl-
KCl
Na2SO4