Презентація на тему «Белки» (варіант 2)

Белки
Презентация ученицы 11-П классаМихеевой Анастасии

Что такое белки?
Белками называют высокомолекулярные (молекулярная масса варьирует от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединённых амидной (пептидной) связью.

Строение
В молекулах белка α - аминокислоты связаны между собой пептидными
(-СO-NH-) связями
Большую роль в создании структуры белков играют ионные (солевые) и водородные связи, а также гидрофобное взаимодействие
Некоторые белки содержат в небольших количествах фосфор, селен и другие элементы

Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной структурой белка.
Вторичной структурой обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи

В формировании третичной структуры, кроме водородных связей, большую роль играет ионное и гидрофобное взаимодействие. По характеры «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.

В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют сложные ансамбли. В этом случае образуется четвертичная структура белков.
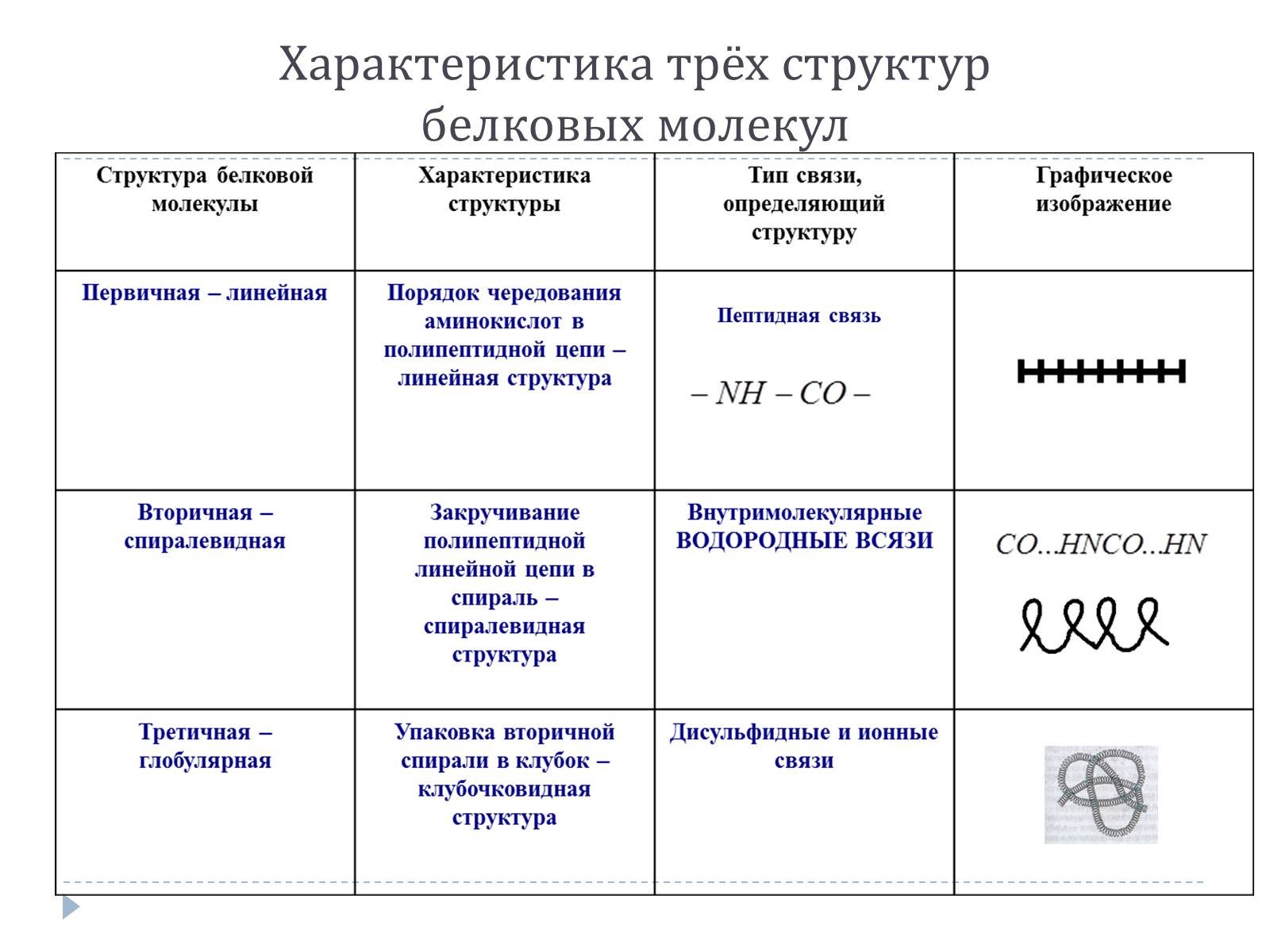
Характеристика трёх структурбелковых молекул

Свойства
Белки – амфотерные электролиты. При определённом значении рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одной из свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения их из растворов, например в технологии получения белковых продуктов.

Горение
Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жжёных перьев.
Цветные реакции
ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением жёлтой окраски;
биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди(II) с образованием комплексных соединений между ионами Cu2+ и полипептидами. Реакция

Биологические функции белков
каталитические (ферменты);
регуляторные (гормоны);
структурные (коллаген, фиброин);
двигательные (миозин);
транспортные (гемоглобин, миоглобин);
защитные (иммуноглобулины, интерферон);
запасные (казеин, альбумин, глиадин).
Среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.

Химический составорганизма человека
ВОДА – 65%
ЖИРЫ – 10%
БЕЛКИ – 18%
УГЛЕВОДЫ – 5%
Другие неорганические и органические вещества – 2%