Презентація на тему «Амінокислоти» (варіант 4)

Амінокислоти
Підготували
учениці 11-А класу
Криничанської СЗШ №1Козак Руслана та Коваль Олена
План
Амінокислоти
Незамінні амінокислоти R-CHNH 2 COOH
Номенклатура
Класифікація за хімічною будовою радикалів
Способи отримання амінокислот
Фізичні властивості
Хімічні властивості
Зв'язки амінокислот
Представники
Значення амінокислот
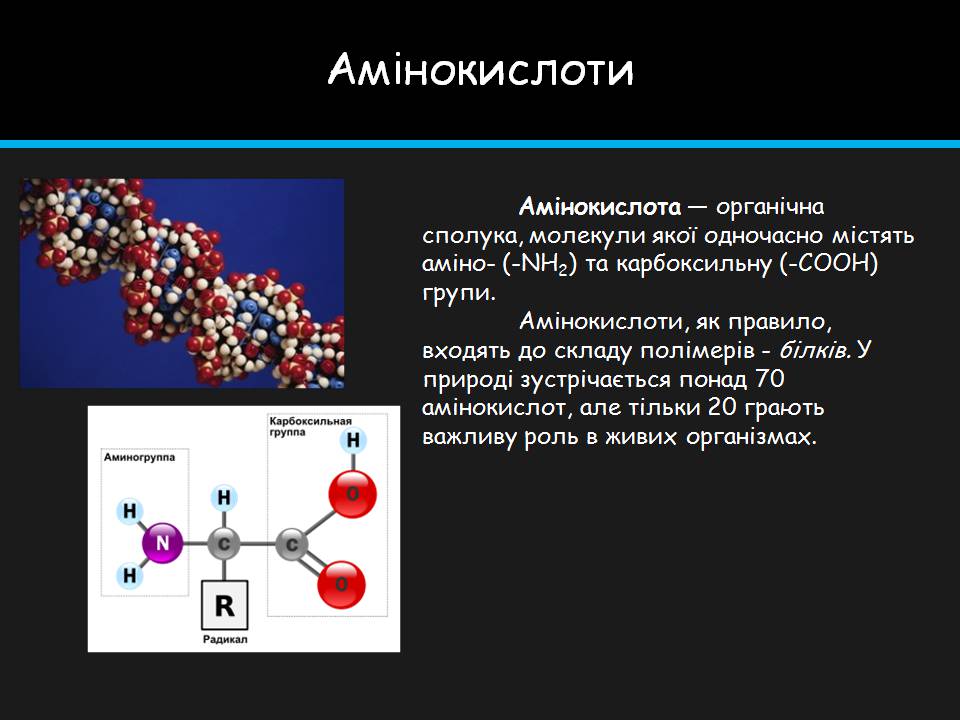
Амінокислоти
Амінокислота — органічна сполука, молекули якої одночасно містять аміно- (-NH2) та карбоксильну (-СООН) групи.
Амінокислоти, як правило, входять до складу полімерів - білків. У природі зустрічається понад 70 амінокислот, але тільки 20 грають важливу роль в живих організмах.
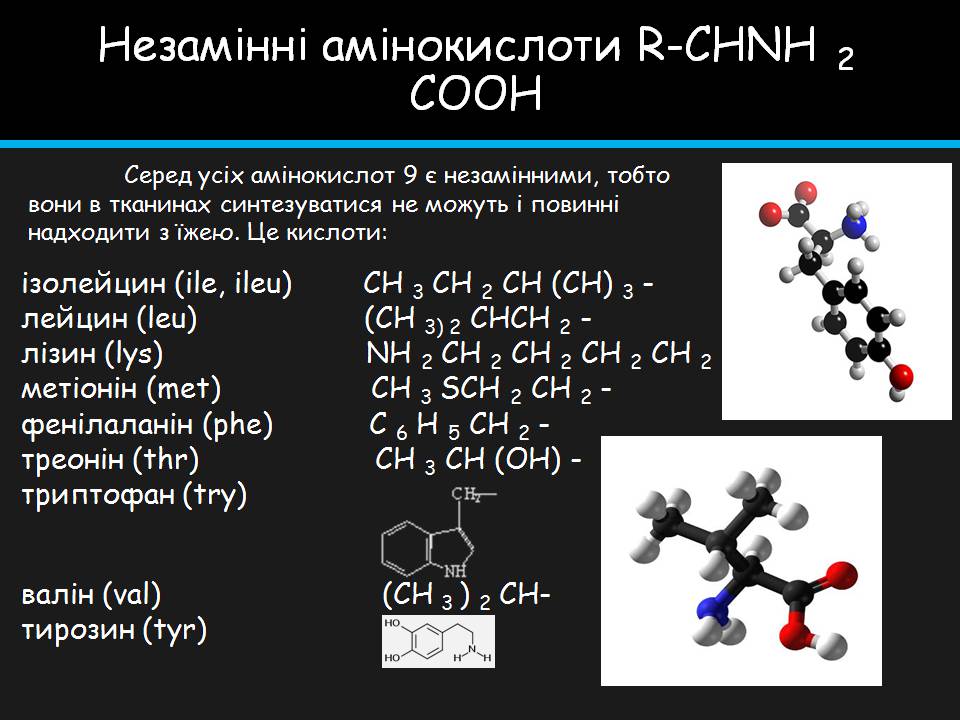
Незамінні амінокислоти R-CHNH 2 COOH
ізолейцин (ile, ileu) CH 3 CH 2 CH (CH) 3 - лейцин (leu) (CH 3) 2 CHCH 2 - лізин (lys) NH 2 CH 2 CH 2 CH 2 CH 2 метіонін (met) CH 3 SCH 2 CH 2 - фенілаланін (phe) C 6 H 5 CH 2 - треонін (thr) CH 3 CH (OH) - триптофан (try)
валін (val) (CH 3 ) 2 CH- тирозин (tyr)
Серед усіх амінокислот 9 є незамінними, тобто вони в тканинах синтезуватися не можуть і повинні надходити з їжею. Це кислоти:

Номенклатура
За правилами замісникової номенклатури ІЮПАК назви амінокислот утворюють із систематичної назви відповідної карбонової кислоти та префікса аміно-. Положення аміногрупи вказують цифрами:
При використанні тривіальних назв кислот, положення аміногрупи у вуглеводневому радикалі вказують літерами грецького алфавіту α-, β-, γ- і т.д.:
Номенклатура
Тривіальні назви амінокислот найчастіше вказують на їх особливі властивості або на джерело виділення. Так, перша амінокислота – гліцин, або як її іноді називають глікокол (гр. glycys – солодкий, colla – клей) дістала назву за свій солодкий смак і була виділена А. Браконно у 1820 р. з желатину. Будову її встановили лише у 1838 р. Цистеїн (гр. kystis – міхур) виділено із каменів сечового міхура у 1810 р. У 1890 р. цистеїн визнано як амінокислоту, котра входить до складу білків. Лейцин (гр. leukos – білий) та тирозин (гр. tyros – сир) виділені із молочного білка казеїну.
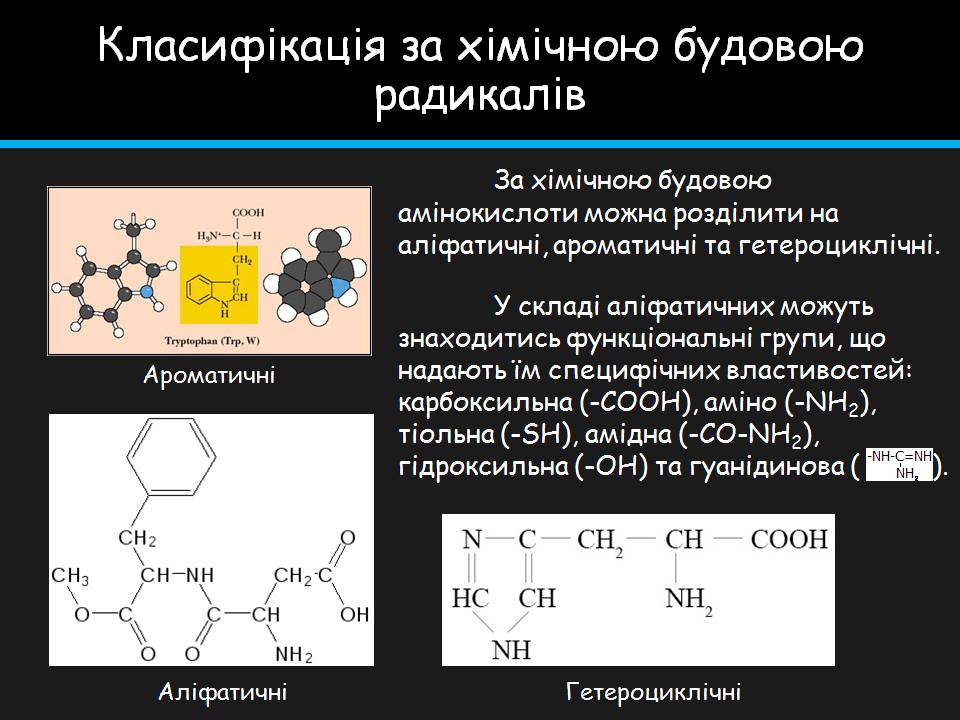
Класифікація за хімічною будовою радикалів
За хімічною будовою амінокислоти можна розділити на аліфатичні, ароматичні та гетероциклічні.
У складі аліфатичних можуть знаходитись функціональні групи, що надають їм специфічних властивостей: карбоксильна (-COOH), аміно (-NH2), тіольна (-SH), амідна (-CO-NH2), гідроксильна (-OH) та гуанідинова ( ).
Ароматичні
Аліфатичні
Гетероциклічні
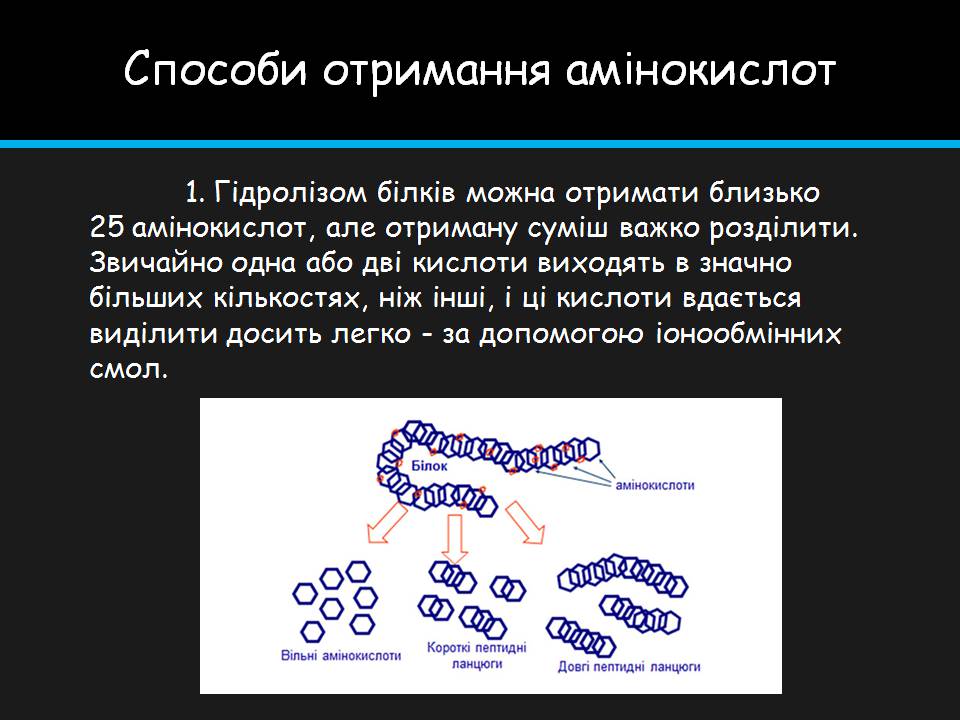
Способи отримання амінокислот
1. Гідролізом білків можна отримати близько 25 амінокислот, але отриману суміш важко розділити. Звичайно одна або дві кислоти виходять в значно більших кількостях, ніж інші, і ці кислоти вдається виділити досить легко - за допомогою іонообмінних смол.
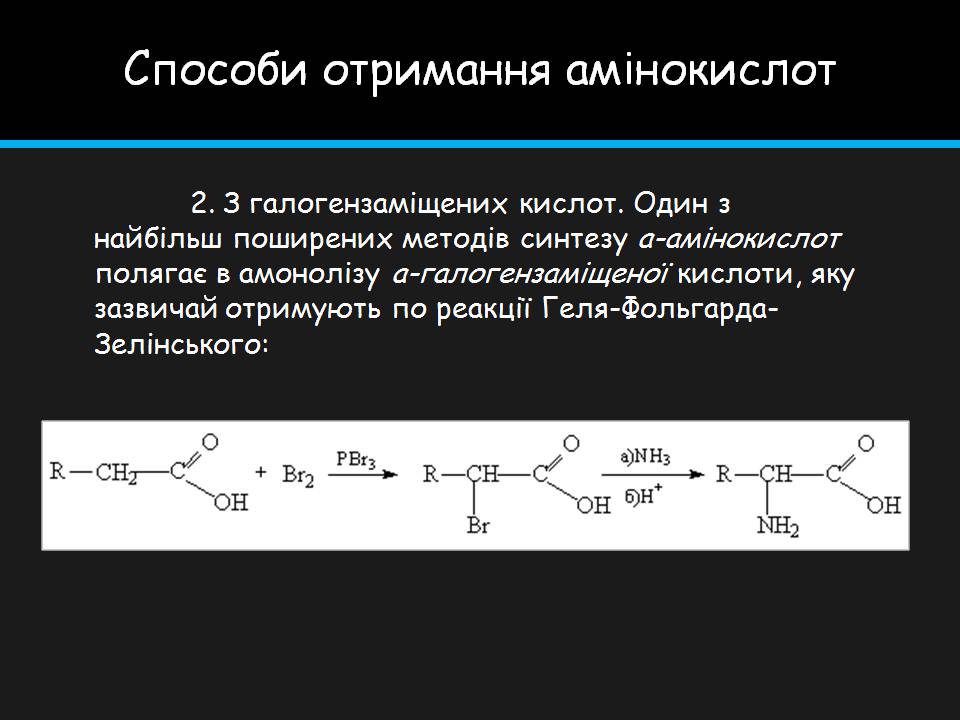
Способи отримання амінокислот
2. З галогензаміщених кислот. Один з найбільш поширених методів синтезу a-амінокислот полягає в амонолізу a-галогензаміщеної кислоти, яку зазвичай отримують по реакції Геля-Фольгарда-Зелінського:

Способи отримання амінокислот
3. З карбонільних сполук (синтез Штреккер). Синтез a-амінокислот за Штреккер полягає в реакції карбонільного з'єднання з сумішшю хлориду амонію і ціаністого натрію (це удосконалення методу запропоновано Н. Д. Зелінським і Г. Л. Стадникова).
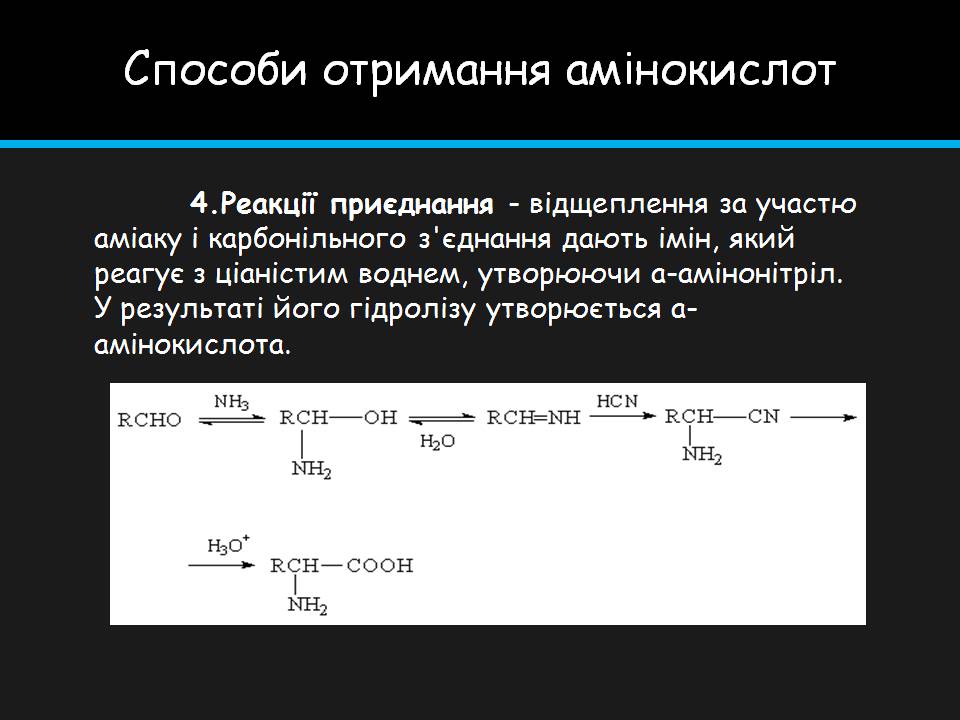
Способи отримання амінокислот
4.Реакції приєднання - відщеплення за участю аміаку і карбонільного з'єднання дають імін, який реагує з ціаністим воднем, утворюючи a-амінонітріл. У результаті його гідролізу утворюється a-амінокислота.

Фізичні властивості
Амінокислоти – безбарвні тверді кристалічні речовини, переважно добре розчинні у воді і практично нерозчинні в органічних розчинниках. Вони мають високі температури плавлення, багато з них солодкі на смак.
Високі температури плавлення, відсутність в спектрі ліній, характерних для карбоксильної та аміно групи, та деякі інші властивості амінокислот пояснюються їх будовою. Амінокислоти являють собою внутрішні солі (біполярні іони):+NH3-CH2-CO-O-Такий іон в кислому середовищі поводить себе як катіон, так як пригнічується дисоціація карбоксильної групи; а в лужній - як аніон: +NH3-CH2-COOH+HOH- +NH3-CH2-COOHO-H+NH2-CH2-COO-

Хімічні властивості
Амінокислоти відносять до гетерофункціональних сполук, тобто сполук, які містять різні функціональні групи. В молекулі таких сполук кожна з функціональних груп, як правило, виявляє властивості, притаманні даному класу. Крім того, функціональні групи можуть впливати на властивості одна одної, що веде до прояву такими сполуками ряду специфічних властивостей, які є наслідком комбінації цих груп у молекулі.
Амінокислоти містять у своєму складі аміно- та карбоксильну групи. Наявність в одній молекулі кислотного (–СООН) та основного (–NH2) центрів веде до того, що амінокислоти в кристалічному стані або у розчині існують у вигляді внутрішніх солей, які називають цвіттер-іонами або біполярними іонами. Саме з існуванням таких солей пов'язують високі температури плавлення амінокислот.

Хімічні властивості
1. Взаємодія з кислотами та лугами. Амінокислоти – типові амфотерні сполуки: взаємодіють з кислотами з утворенням солей за NH2-групою (основні властивості); взаємодіють з лугами, утворюючи солі за СООН-групою (кислотні властивості):

Хімічні властивості
2. Взаємодія зі спиртами. Амінокислоти реагують зі спиртами в присутності газоподібного хлороводню. При цьому утворюються відповідні солі естерів, з яких виділяють вільний естер шляхом додавання слабких основ:

Хімічні властивості
3. Утворення пептидів. Амінокислоти можуть реагувати між собою: одна кислота взаємодіє карбоксильною групою, інша – аміногрупою, при цьому виділяється молекула води. Ці амінокислоти можуть бути однаковими або різними. Зв'язок між амінокислотами здійснюється за рахунок СОNH-групи, яку називають амідною, а в хімії білків – пептидною групою або пептидним зв'язком. Відповідно продукти такої взаємодії називають пептидами. Якщо сполучені між собою дві амінокислоти, вони утворюють дипептид:

Зв'язки амінокислот
Амінокислоти здатні утворювати ряд хімічних звязків з різними реакційноздатними групами.
Пептидний звязок. Цей звязок утворюється в результаті виділення води при взаємодії аміногрупи однієї амінокислота з карбоксильною іншої. Сполука що утворилась внаслідок такої реакції називається дипептид.
Зв'язки амінокислот
Іонний звязок. При схожому значенні pH іонізована аміногрупа може взаємодіяти з іонізованою карбоксильною .в результаті чого утворюється іонний звязок. У водному розчині іонні звязки значно слабкіші ковалентних; івони можуть розриватися при зміні pH середовища.

Зв'язки амінокислот
Дисульфідний звязок. Коли дві молекули цистеїна, їх сульфгідрильні (-SH) групи, знаходяться поруч, вони окислюються утворюючи дисульфідний звязок. Дисульфідні звязки можуть виникати при також між різними поліпептидними ланцюгами. Цей факт грає важливу роль в білковій структурі.
Зв'язки амінокислот
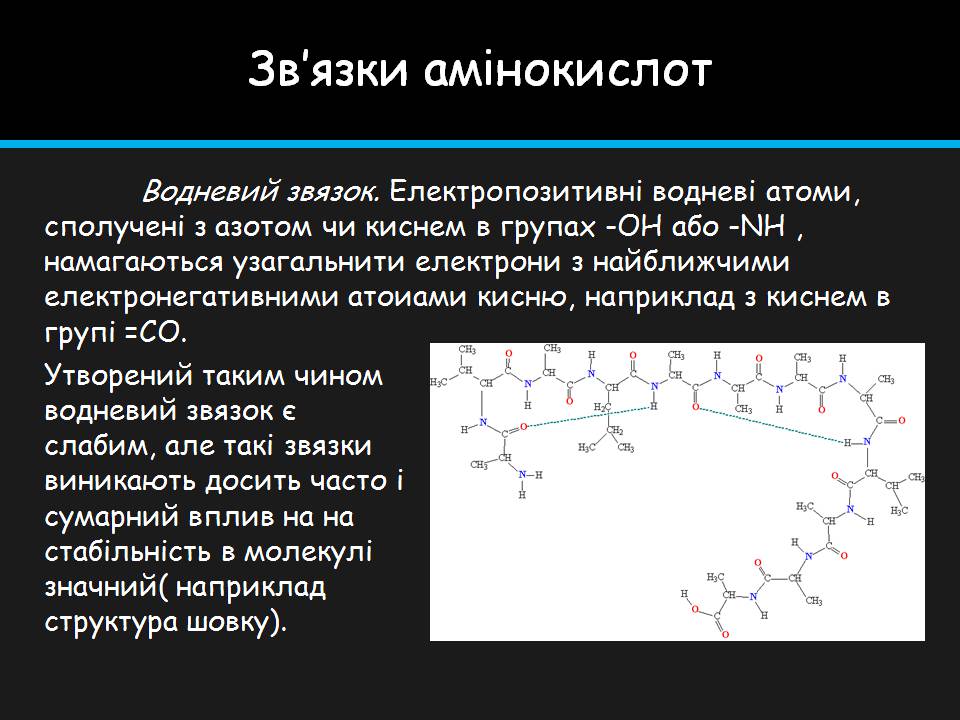
Водневий звязок. Електропозитивні водневі атоми, сполучені з азотом чи киснем в групах -OH або -NH , намагаються узагальнити електрони з найближчими електронегативними атоиами кисню, наприклад з киснем в групі =СО.
Утворений таким чином водневий звязок є слабим, але такі звязки виникають досить часто і сумарний вплив на на стабільність в молекулі значний( наприклад структура шовку).
Представники
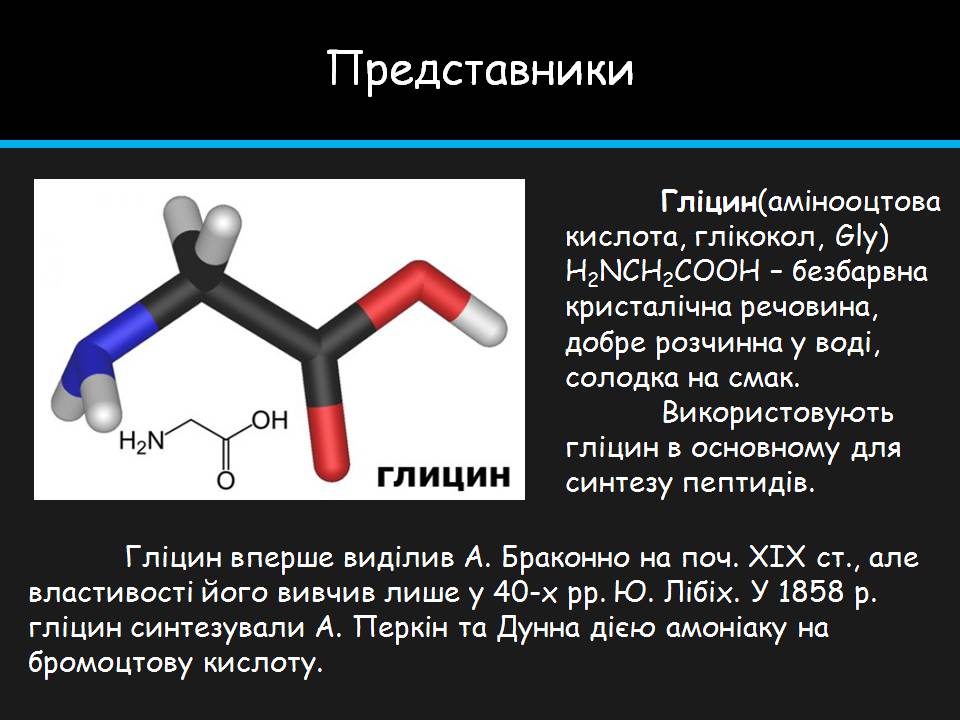
Гліцин(амінооцтова кислота, глікокол, Gly) H2NCH2COOH – безбарвна кристалічна речовина, добре розчинна у воді, солодка на смак. tВикористовують гліцин в основному для синтезу пептидів.
Гліцин вперше виділив А. Браконно на поч. ХІХ ст., але властивості його вивчив лише у 40-х рр. Ю. Лібіх. У 1858 р. гліцин синтезували А. Перкін та Дунна дією амоніаку на бромоцтову кислоту.
Представники
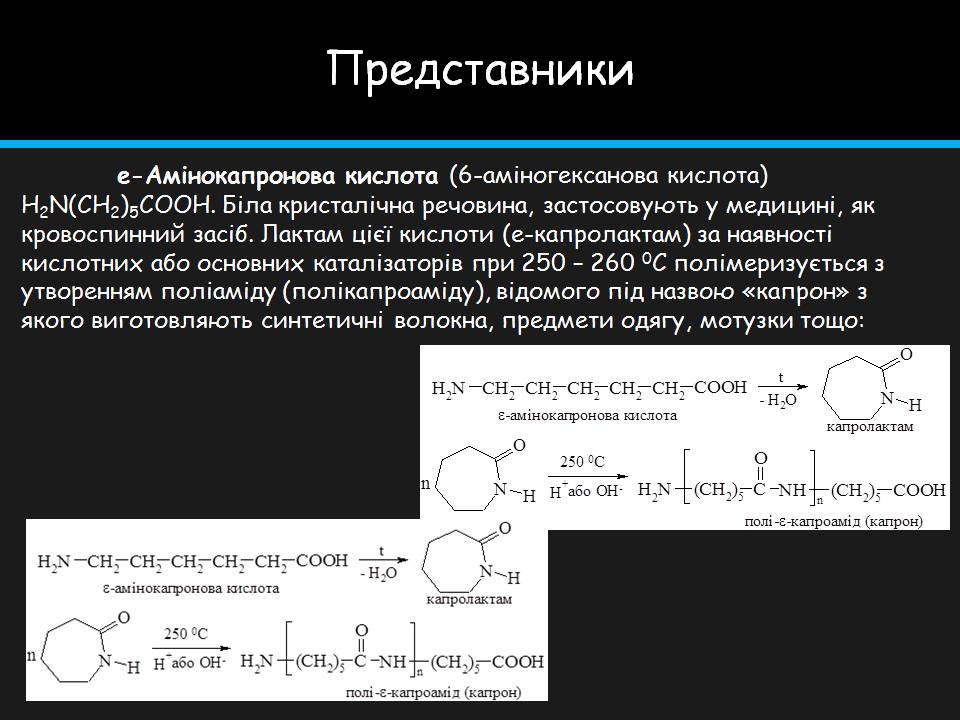
e-Амінокапронова кислота (6-аміногексанова кислота) H2N(CH2)5COOH. Біла кристалічна речовина, застосовують у медицині, як кровоспинний засіб. Лактам цієї кислоти (e-капролактам) за наявності кислотних або основних каталізаторів при 250 – 260 0С полімеризується з утворенням поліаміду (полікапроаміду), відомого під назвою «капрон» з якого виготовляють синтетичні волокна, предмети одягу, мотузки тощо:

Значення амінокислот
Основне корисна властивість амінокислот - це їх необхідність для правильного розвитку організму. Без них тіло просто не впорається з засвоєнням вітамінів, мінералів і поживних речовин. Спортсмени приймають їх і для нарощування м'язової маси, і для збільшення сили, і для вироблення витривалості.
Щоб оцінити, наскільки важливі амінокислоти для організму, варто звернути увагу на області, які вони охоплюють. Амінокислоти необхідні для вироблення таких речовин:
ферменти, які потрібні для біохімічних реакцій;
гормони, які необхідні при метаболічних процесах;
антитіла, які потрібні для здорового функціонування імунної системи;
гемоглобін, який транспортує кисень по всьому організму.
Джерела:
http://zno.academia.in.ua/mod/book/view.php?id=1670
http://ua-referat.com/%D0%90%D0%BC%D1%96%D0%BD%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B8
http://ua-referat.com/%D0%90%D0%BC%D1%96%D0%BD%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B8_2
http://www.e-ng.ru/ximiya/aminokisloti_oderzhannya_vlastivosti_rol.html