Презентація на тему «Аміак» (варіант 3)

Аміак
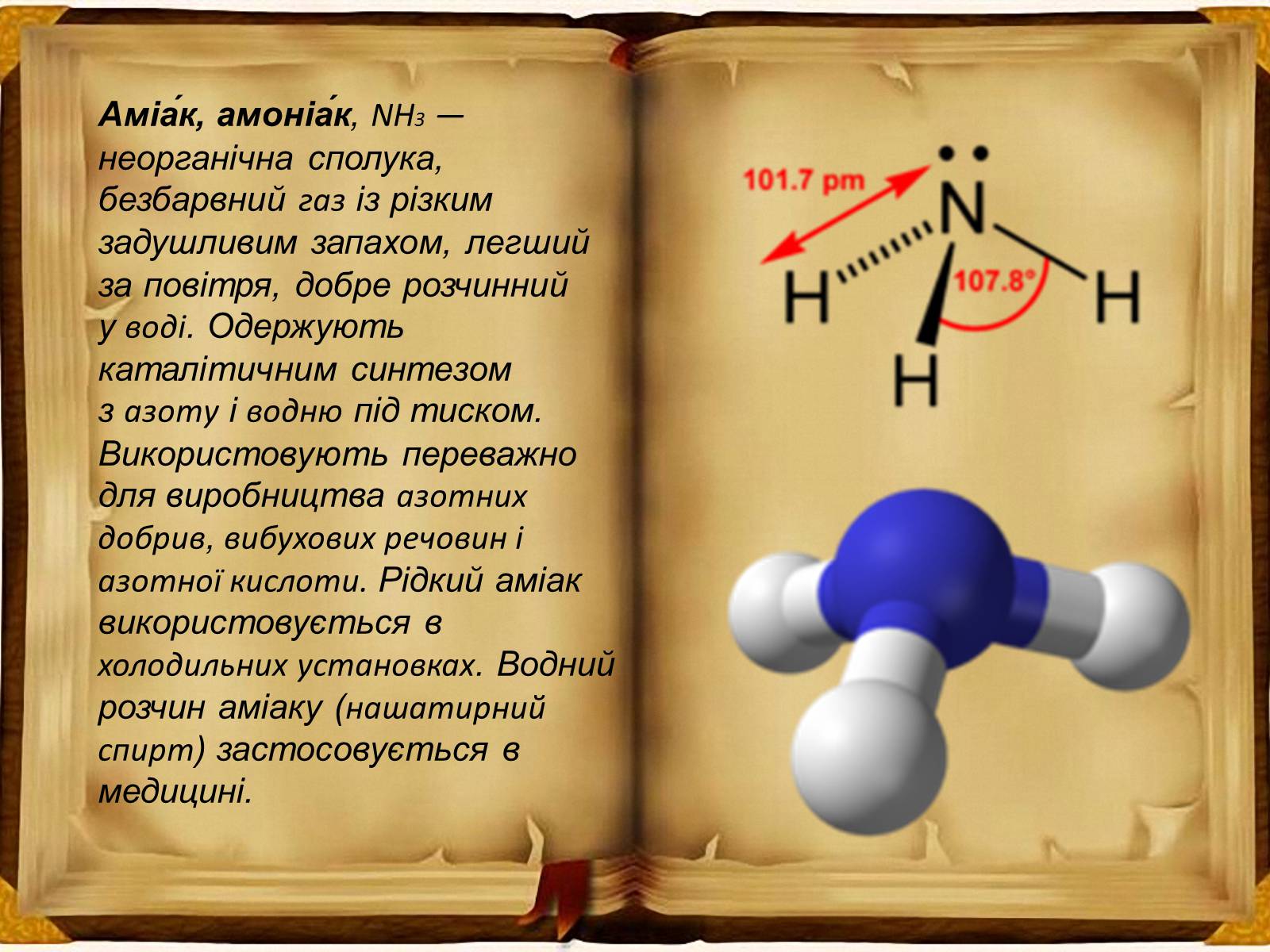
Аміа́к, амоніа́к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді. Одержують каталітичним синтезом з азоту і водню під тиском. Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині.

Властивості
Молекулярна формула
NH3
Молярна маса
17,0306 г/моль
Зовнішній вигляд
Безбарвний газ із різким та сильним запахом
Густина
0,6942
Тпл
−77,73 °С(195,42 К)
Ткип
−33,34 °C (239,81К)
Розчинність (вода)
89,9 г/100 мл при 0 °C
Кислотність (pKa)
38
Основність (pKb)
4,75 (reaction with H2O)

Небезпеки
Класифікація ЄС
Головні небезпеки
Небезпечні гази, кородуючий, їдкий
NFPA 704
Температура спалаху
172
Температура самозаймання
651 °C
1
3

Молекули аміаку утворюються за допомогою ковалентних зв'язків. Електронна і структурна формули молекули аміаку такі:

Зв'язки N — Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому атом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією:4NH3 + 3O2 = 2N2 + 6H2OАмоніак також легко відновлює монооксид міді до металічної міді при високій температурі за реакцією:3CuO + 2NH3 = 3Cu + N2 + 3H2O

При розчиненні аміаку в воді частина його молекул взаємодіє з водневими іонами води з утворенням складного катіона амонію NH+4. Разом з тим відповідна кількість гідроксильних груп OH− води звільняється. Цей процес рівноважний. Його можна зобразити таким рівнянням:

Розчин гідроксиду амонію забарвлює лакмус у синій колір. З кислотами розчин гідроксиду амонію утворює солі, наприклад:NH4OH + HCl = NH4Cl + H2ONH4OH + HNO3 = NH4NO3 + H2O 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O

В лабораторних умовах аміак добувають звичайно нагріванням суміші хлориду амонію NH4Cl з гашеним вапном Ca(OH)2. Процес утворення аміаку при цьому відбувається в дві стадії: спочатку виникає гідроксид амонію, а потім він розкладається з виділенням аміаку:2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2NH4OH = NH3↑ + H2O

Амоніак — один з найважливіших продуктів сучасної хімічної промисловості. Головною галуззю його застосування є виробництво нітратної кислоти і азотних добрив. Крім того, аміак використовують для виробництва багатьох інших хімічних продуктів. Зріджений аміак і водний розчин аміаку застосовують безпосередньо як азотне добриво.
Виконала:студентка 1-го курсу 102-б групиНечипорук Олександра