Презентація на тему «Металічний хімічний зв’язок»

Металічний хімічний зв'язок

Металічний зв'язок — це зв'язок між позитивними йонами металів, що знаходяться у вузлах кристалічних ґрадок, який здійснюється за рахунок електронів, що вільно переміщаються по кристалу.
Що це таке?
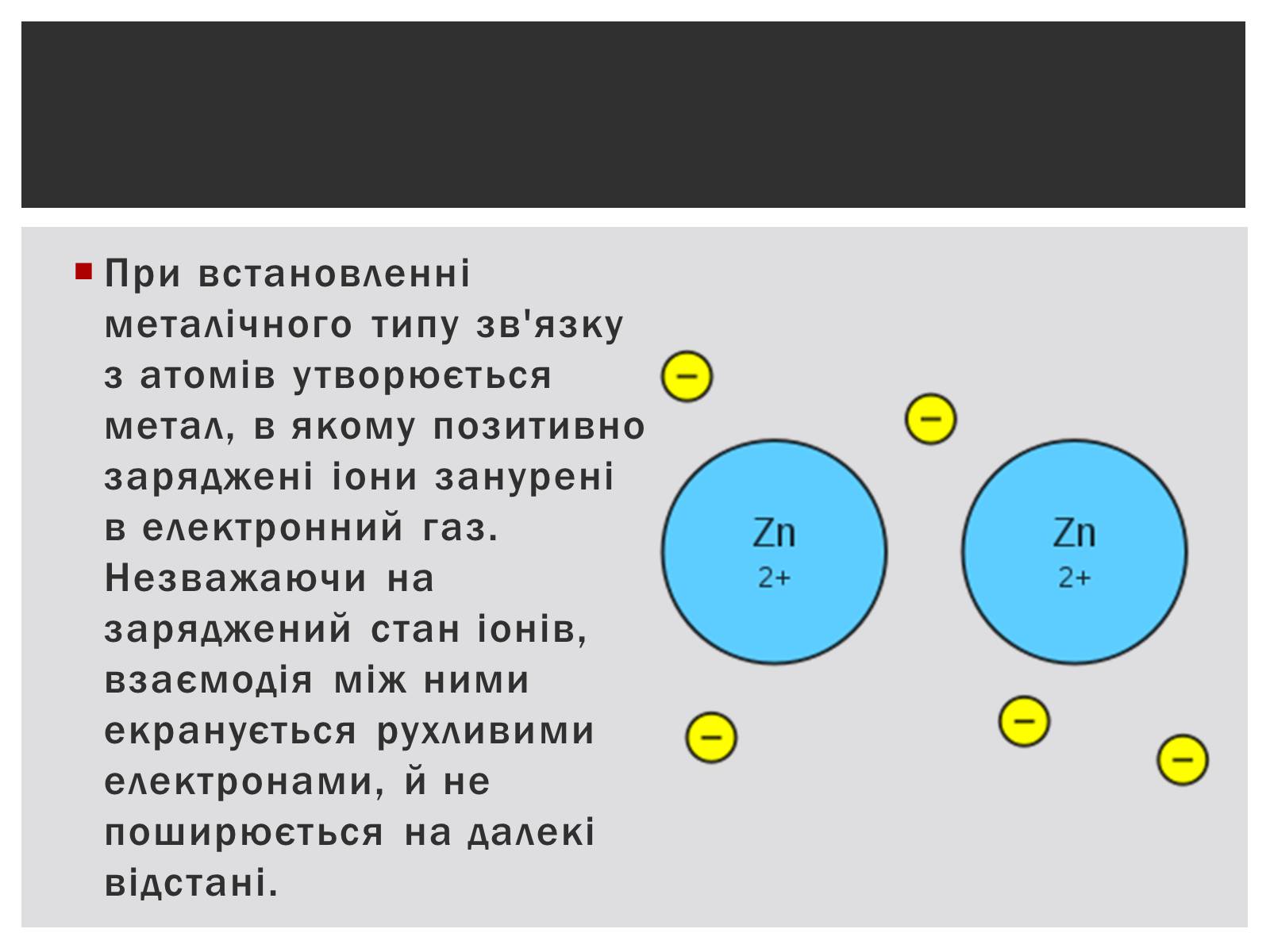
При встановленні металічного типу зв'язку з атомів утворюється метал, в якому позитивно заряджені іони занурені в електронний газ. Незважаючи на заряджений стан іонів, взаємодія між ними екранується рухливими електронами, й не поширюється на далекі відстані.
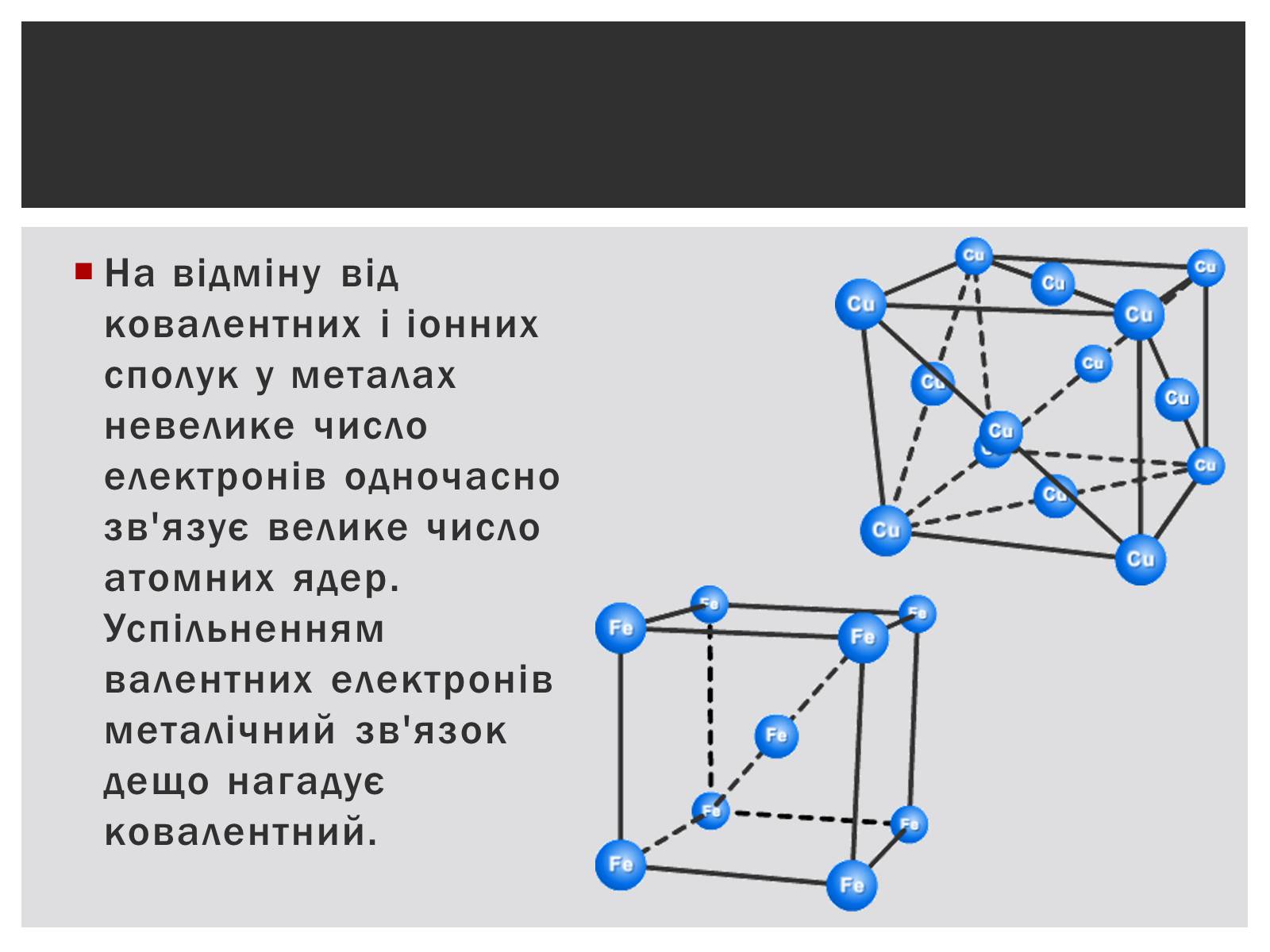
На відміну від ковалентних і іонних сполук у металах невелике число електронів одночасно зв'язує велике число атомних ядер. Успільненням валентних електронів металічний зв'язок дещо нагадує ковалентний.
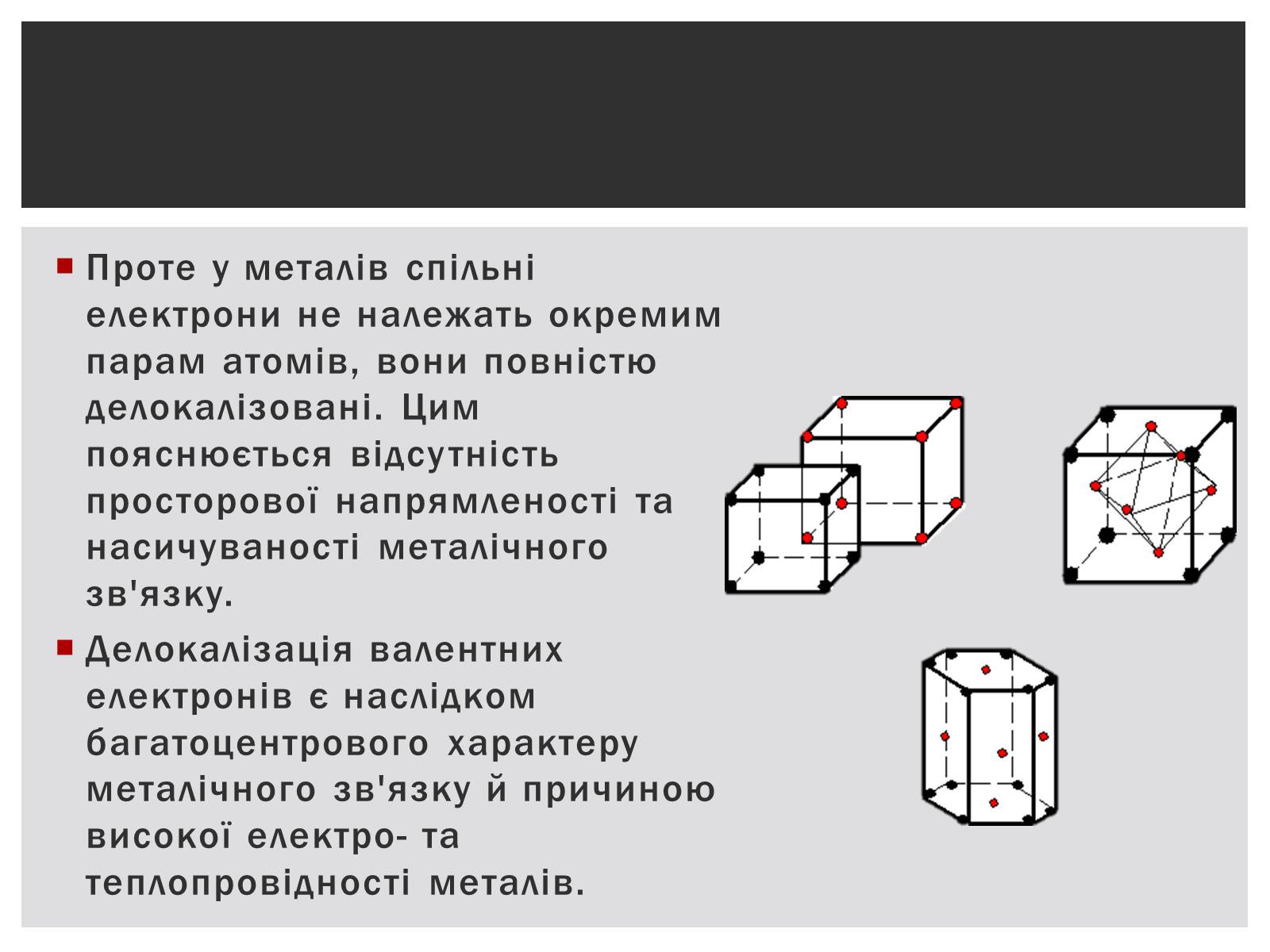
Проте у металів спільні електрони не належать окремим парам атомів, вони повністю делокалізовані. Цим пояснюється відсутність просторової напрямленості та насичуваності металічного зв'язку.
Делокалізація валентних електронів є наслідком багатоцентрового характеру металічного зв'язку й причиною високої електро- та теплопровідності металів.

Метали і сплави
Приклади речовин

Основні частини ґрадок: катіони та вільні електрони
Металічний тип хімічного зв'язку
Температури плавлення різні
Нелеткі(окрім ртуті)
Тверді, пластичні
Електропровідні
Розчинні у воді
Властивості
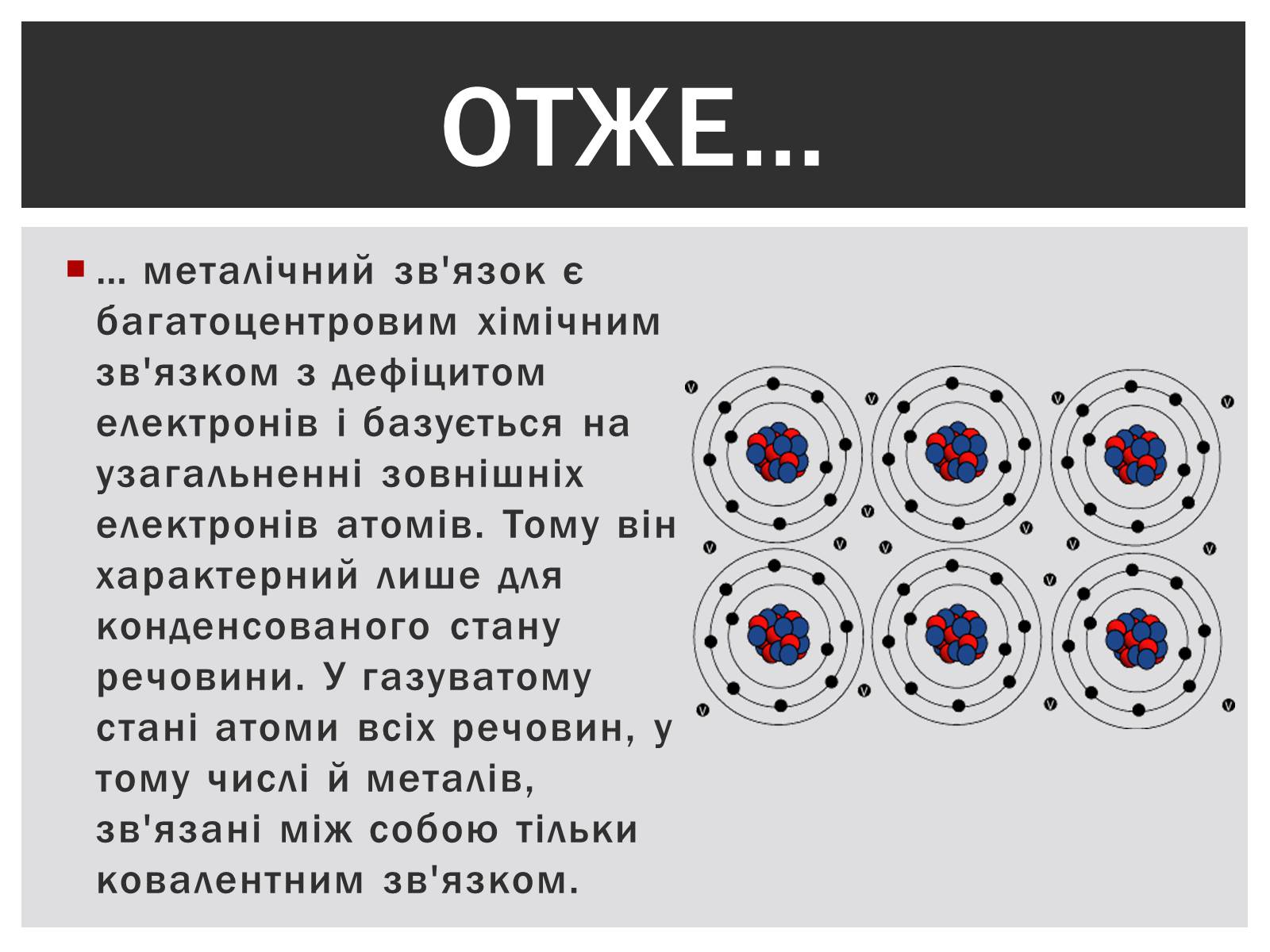
… металічний зв'язок є багатоцентровим хімічним зв'язком з дефіцитом електронів і базується на узагальненні зовнішніх електронів атомів. Тому він характерний лише для конденсованого стану речовини. У газуватому стані атоми всіх речовин, у тому числі й металів, зв'язані між собою тільки ковалентним зв'язком.
Отже…