Презентація на тему «Корозія металів» (варіант 4)

КОРОЗІЯ МЕТАЛІВЗАХИСТ ВІД КОРОЗІЇ

Що таке “ корозія ”?
Корозія (від лат corrosio – роз'їдати) це руйнування металів і сплавів під впливом хімічної чи електрохімічної взаємодії з оточуючим середовищем.
А чи знаєте ви, що швидкість корозії напряму залежить від активності металів. Чим метал активніший, тим швидше він кородує.

Корозійнівластивості металів
1 група - лужні метали - найменша корозійна стійкість. (побічна підгрупа вельми стійкі метали)
2 група - головна підгрупа - малостійкі, побічна - більш стійкі (у присутності кисню утворюють міцні плівки оксидів, що оберігають від подальшого руйнування)

Корозійнівластивості металів
3 група - Алюміній - утворюється міцна оксидна плівка (але вона руйнується в розчинах кислот і лугів) У концентрованої азотної та сірчаної кислотах алюміній пасивується.
4 група - Олово і свинець - стійкі до корозії метали, завдяки міцним оксидним плівкам.

Корозійнівластивості металів
5,6,7,8 групи - метали побічних підгруп мають високу здатність до пасивації, а отже, великою корозійною стійкістю.
Осмій, іридій, платина – найбільш стійкі до корозії

Корозійнівластивості металів
5,6,7,8 групи - метали побічних підгруп мають високу здатність до пасивації, а отже, великою корозійною стійкістю.
Осмій, іридій, платина – найбільш стійкі до корозії

Корозійнівластивості металів
5,6,7,8 групи - метали побічних підгруп мають високу здатність до пасивації, а отже, великою корозійною стійкістю.
Осмій, іридій, платина – найбільш стійкі до корозії

В чому небезпека корозії?
Може призвести до екологічних катастроф: потрапляння природного газу, нафти, небезпечних хімічних продуктів у навколишнє середовище.
Недопустима в авіаційному, нафтовому, атомному, хімічному машинобудуванні тощо.
Негативно впливає на здоров'я людини.

В чому небезпека корозії?
Може призвести до екологічних катастроф: потрапляння природного газу, нафти, небезпечних хімічних продуктів у навколишнє середовище.
Недопустима в авіаційному, нафтовому, атомному, хімічному машинобудуванні тощо.
Негативно впливає на здоров'я людини.

Чим викликається корозія?
Кисень і атмосферна волога.
Кислотні оксиди, що містяться в атмосфері: оксиди Карбону, Сульфуру, Нітрогену.
Морська вода.
Ґрунтова волога.

Чим викликається корозія?
Кисень і атмосферна волога.
Кислотні оксиди, що містяться в атмосфері: оксиди Карбону, Сульфуру, Нітрогену.
Морська вода.
Ґрунтова волога.

Познайомимося з корозією ближче
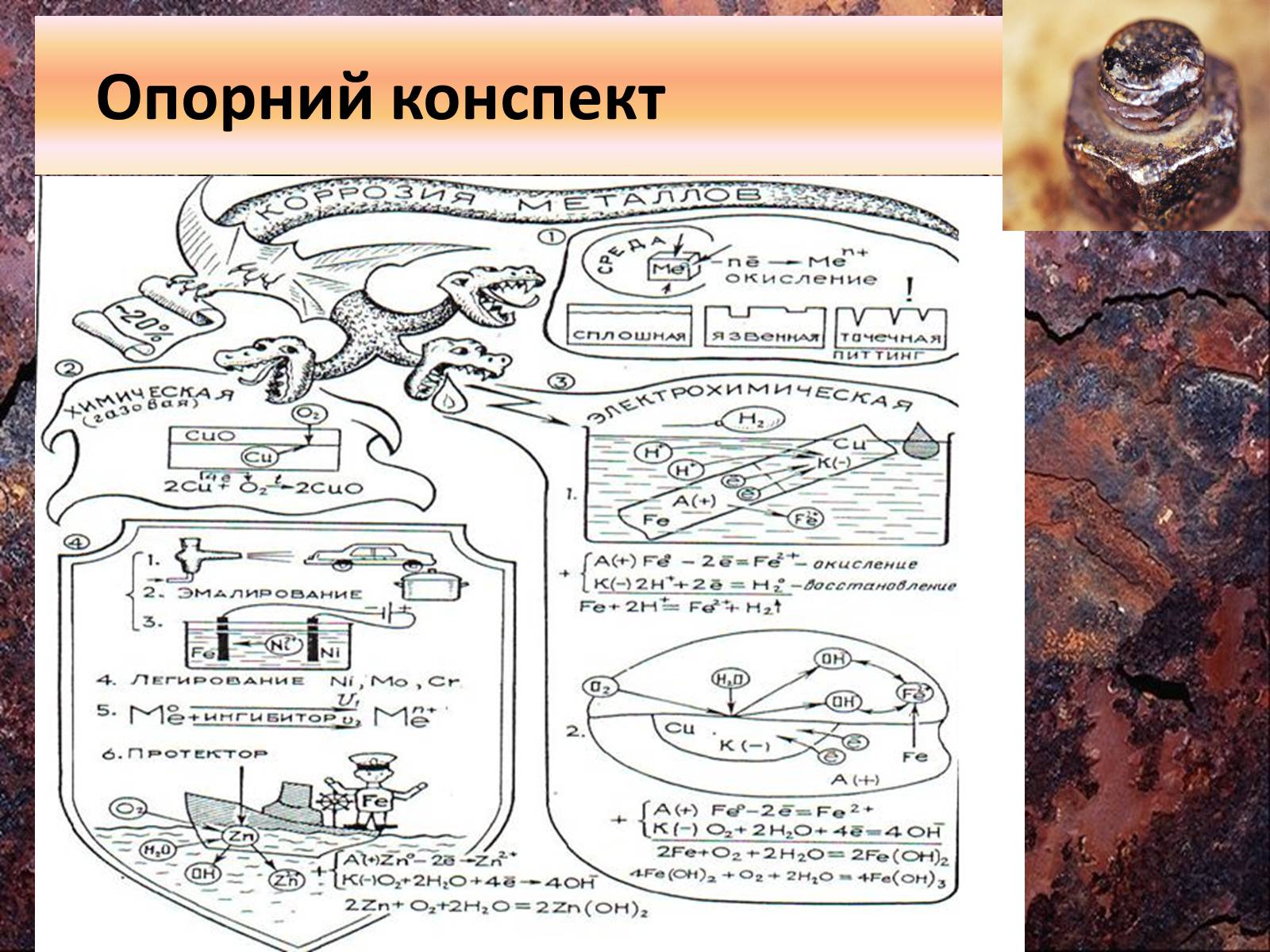
Хімічна корозія
Характеризується хімічними процесами, які відбуваються між металом і агресивними речовинами оточуючого середовища.
Електрохімічна корозія
Руйнування металу супроводжується виникненням електричного струму у водному середовищі електроліта.

Що сприяє електрохімічній корозії
Положення металів у ряду активності: чим далі один від одного вони розміщені, тим швидше відбувається корозія.
Чистота металу (домішки прискорюють корозію).
Нерівності поверхні, мікротріщини.
Висока температура і вологість.
Дія мікроорганізмів, грибів, лишайників.
Грунтові води, морська вода, розчини електролітів.

Що сприяє електрохімічній корозії
Положення металів у ряду активності: чим далі один від одного вони розміщені, тим швидше відбувається корозія.
Чистота металу (домішки прискорюють корозію).
Нерівності поверхні, мікротріщини.
Висока температура і вологість.
Дія мікроорганізмів, грибів, лишайників.
Грунтові води, морська вода, розчини електролітів.

Шляхи захисту від корозії
Захисні покриття: лакування, фарбування, емолювання.
Покриття виробу іншими металами, стійкішими до корозії: позолота, хромування, цинкування тощо.
Створення нових антикорозійних сплавів.
Протекторний захист.
Використання інгібіторів корозії.
Опорний конспект

Виконали: Учні 10Б класу СЗШ №75 Колодій МаксимКінах РоманЯким Ростислав