Презентація на тему «Фізичні властивості етилену й ацетилену»

Фізичні властивості етилену й ацетилену.
Отримання алкенів та алкінів.
Хімічні властивості: відношення до розчинів кислот, лугів, калій перманганату, повне і часткове окиснення, термічний розклад, галогенування, приєднання водню.

Мета.
Ознайомити з основними хімічними властивостями вуглеводнів: відношення до розчинів кислот, лугів, окисників, повними і частковим окисненням, термічним розкладом, галогенуванням.
Формувати уміння складати рівняння реакцій, що характеризують хімічні властивості насичених вуглеводнів, називати галогенопохідні згідно до їх формул.

Фізичні властивості етилену й ацетилену.

Фізичні властивості АЛКЕНІВ ТА АЛКІНІВ
Алкени погано розчиняються у воді, а добре в органічних розчинниках. Алкіни краще розчиняються у водіта мають специфічний аромат
Із зростанням карбонового ланцюа збільшується температура кіпіння та плавлення, а такаж густина
С2– С4 - гази
С5– С16 - рідини
С17… - тверді речовини

Отримання алкенів та алкінів
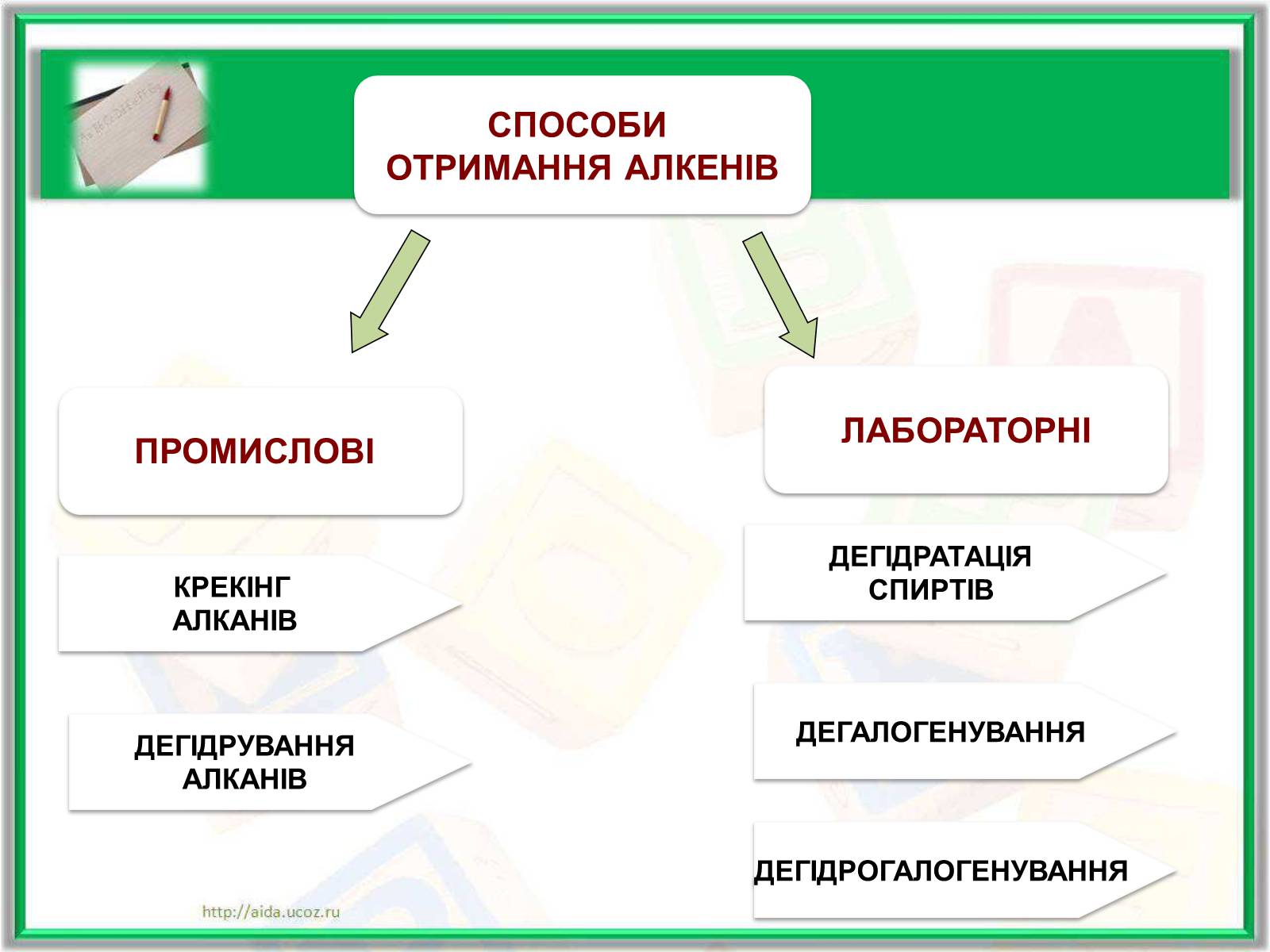
ПРОМИСЛОВІ
СПОСОБИ
ОТРИМАННЯ АЛКЕНІВ
ЛАБОРАТОРНІ
КРЕКІНГ
АЛКАНІВ
ДЕГІДРУВАННЯ
АЛКАНІВ
ДЕГІДРАТАЦІЯ
СПИРТІВ
ДЕГАЛОГЕНУВАННЯ
ДЕГІДРОГАЛОГЕНУВАННЯ
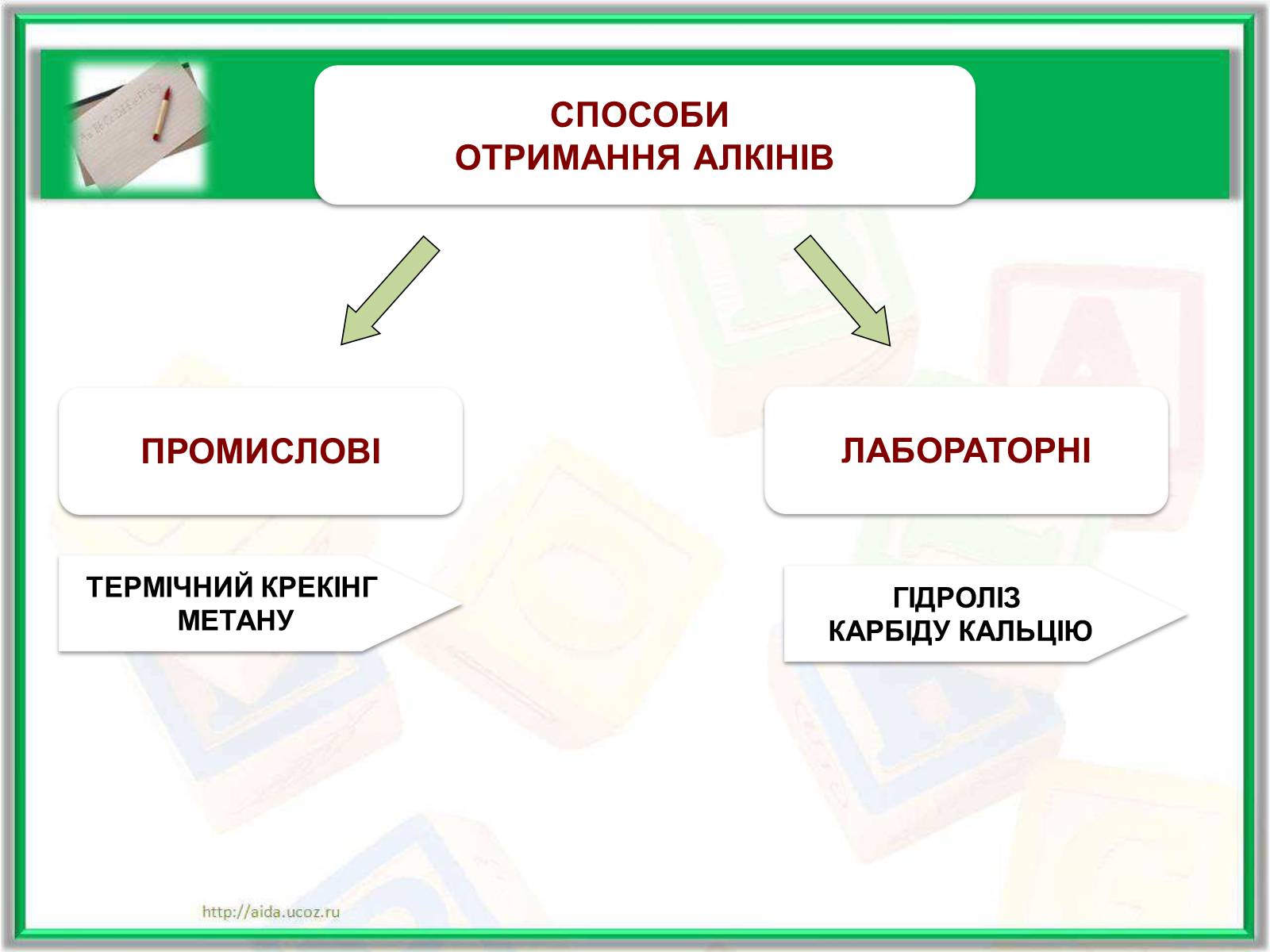
ПРОМИСЛОВІ
СПОСОБИ
ОТРИМАННЯ АЛКІНІВ
ЛАБОРАТОРНІ
ТЕРМІЧНИЙ КРЕКІНГ
МЕТАНУ
ГІДРОЛІЗ
КАРБІДУ КАЛЬЦІЮ

Хімічні властивості: відношення до розчинів кислот, лугів, калій перманганату, повне і часткове окиснення, термічний розклад, галогенування, приєднання водню.

Обвуглювання при горінні
Деревина
М'ясо
Цукор
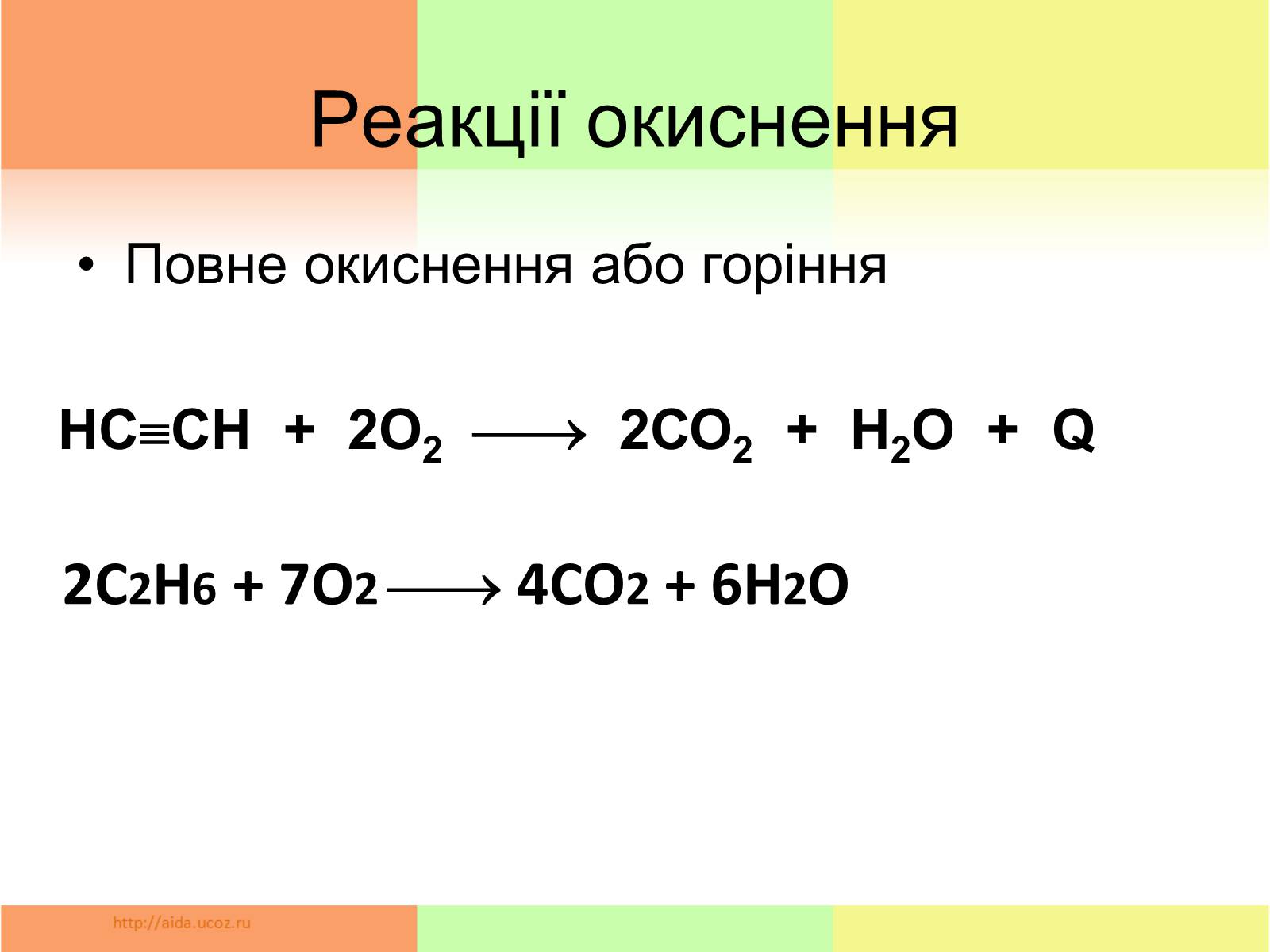
Реакції окиснення
Повне окиснення або горіння
HCCH + 2О2 2СО2 + Н2О + Q
2С2Н6 + 7О2 4СО2 + 6Н2О

Реакції окиснення
Часткове реакція Вагнера
Алкени- взаємодія з розчином ПЕРМАНАГАНАТУ КАЛІЮ
Н2С=СН2 + [O] + H2O H2C - CH2
OH OH
этиленгліколь (этандиол-1,2)
! Якісна реакція
Алкіни- взаємодія з розчином ПЕРМАНАГАНАТУ КАЛІЮ з утворенням карбонових кислот:
RCCR' + 3[O] + H2O RCOOH + R'COOH
! Якісна реакція

Реакції заміщення
Взаємодія з аміачним розчином гідроксиду срібла
HCCH+2[Ag(NH3)2]OH AgCCAg +4NH3+2H2O
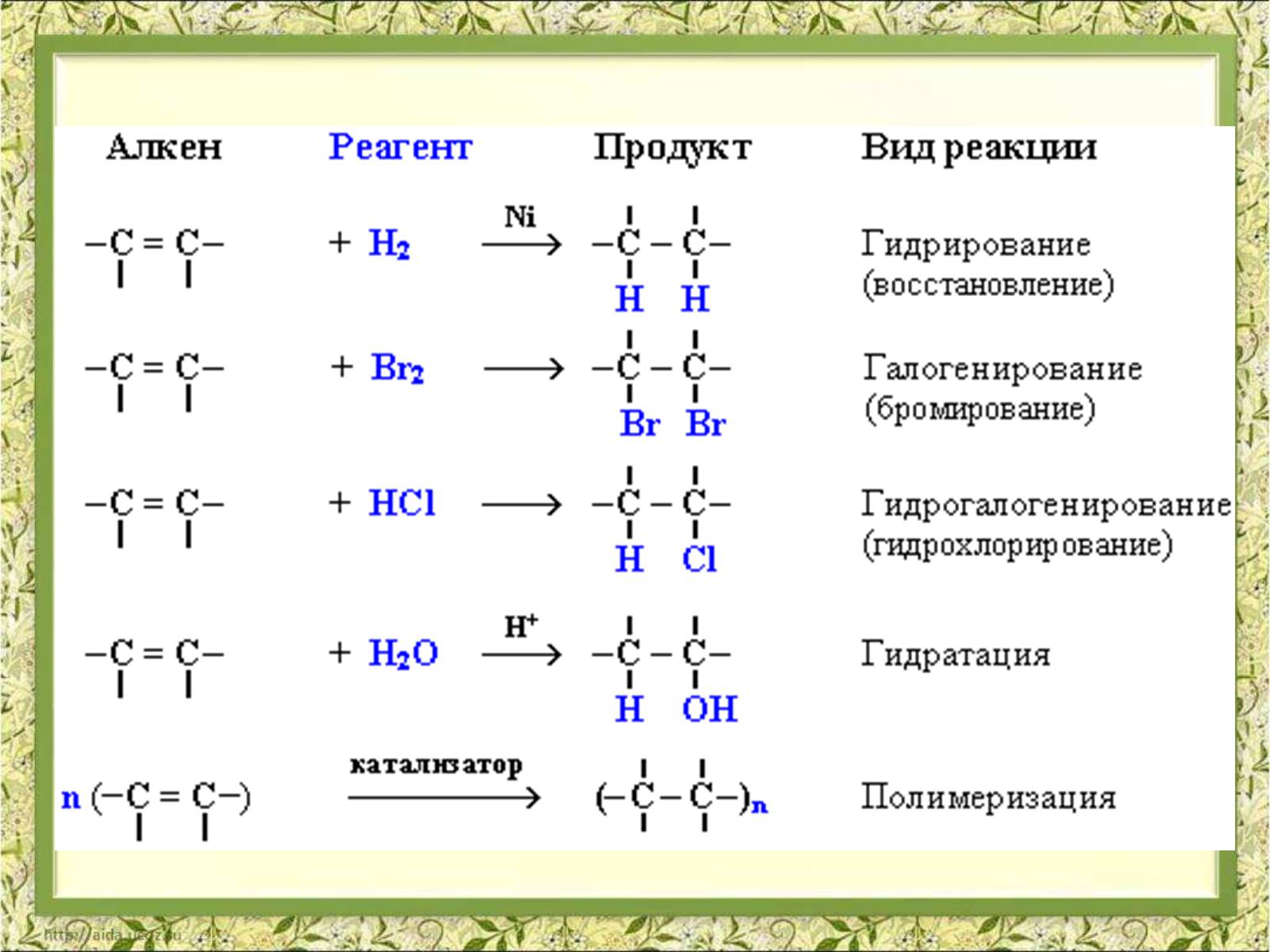
АЛКЕН
РЕАГЕНТ
ПРОДУКТ
ВИД РЕАКЦІЇ
ПРАКТИЧНЕ ЗНАЧЕННЯ РЕАКЦІЇ
Н Н
Н-С=С-Н
+ Н2
→
Н Н
Н-С - С-Н
? ?
ГІДРУВАННЯ
НЕ МАЄ ПРАКТИЧНОГО ЗНАЧЕННЯ
Н Н
Н-С=С-Н
+ Br2
→
Н Н
Н-С - С-Н
? ?
ГАЛОГЕНУВАННЯ
РОЗПІЗНУВАННЯ НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ
ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ,
Н Н
Н-С=С-Н
+ HCl
→
Н Н
Н-С - С-Н
? ?
ПРИЕДНАННЯ ГАЛОГЕНВОДНЮ
ОТРИМАННЯ ХЛОРЕТАНУ ЯКИЙ ВИКОРИСТОВУЮТЬ ДЛЯ МІСЦЕВОЇ АНЕСТЕЗІЇ, ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ, ТА ОБЕЗЗАРАЖЕННЯ ЗЕРНОСХОВИЩ
Н Н
Н-С=С-Н
+ H2O
→
Н Н
Н-С - С-Н
? ?
ГІДРАТАЦІЯ
ОТРИМАННЯ ЕТИЛОВОГО СПИРТУ, РОЗЧИННИКІВ, ДЛЯ ВИРОБНИЦТВА КАУЧУКА
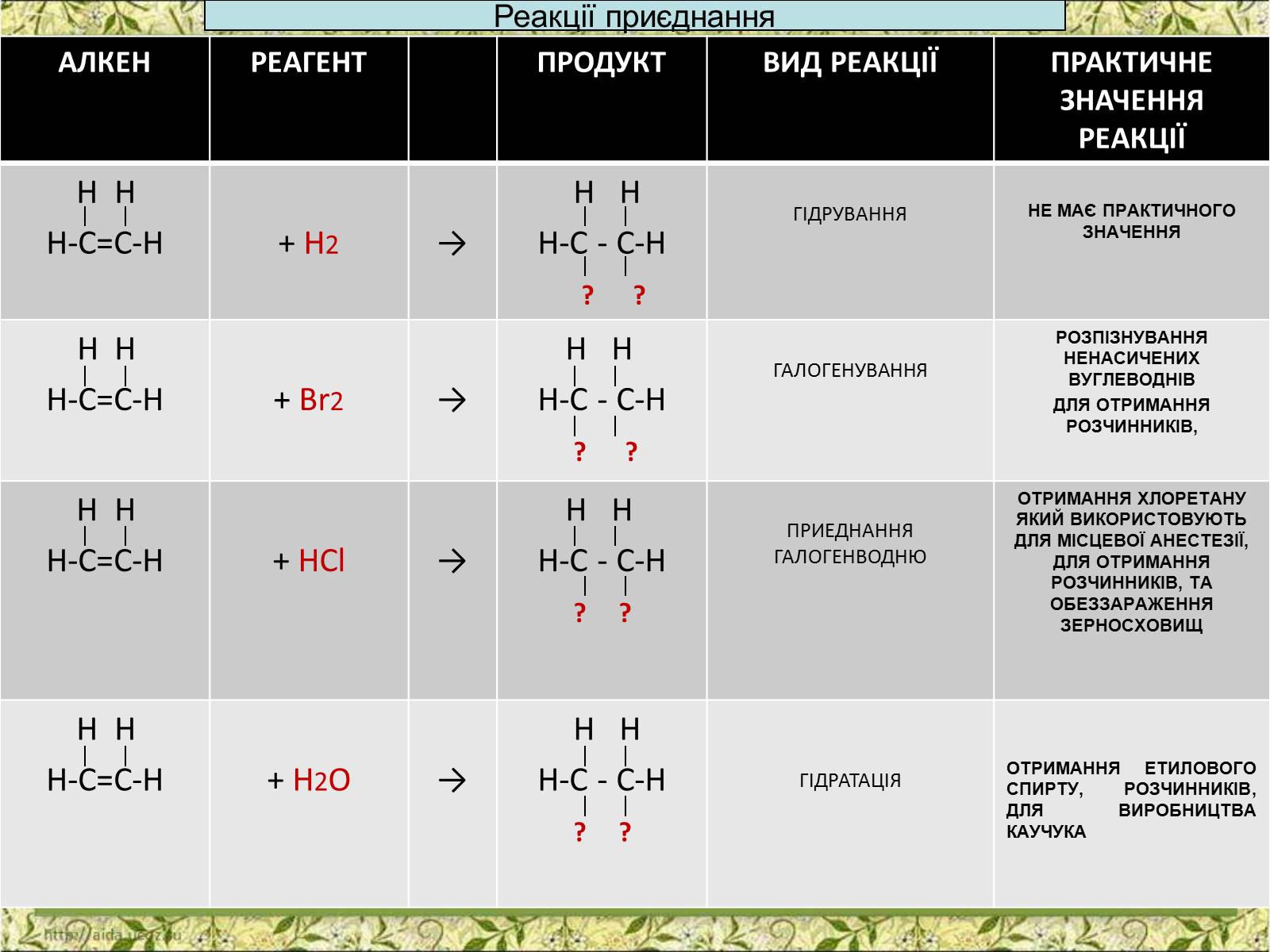
Реакції приєднання
АЛКЕН
РЕАГЕНТ
ПРОДУКТ
ВИД РЕАКЦІЇ
ПРАКТИЧНЕ ЗНАЧЕННЯ РЕАКЦІЇ
Н Н
Н-С=С-Н
+ Н2
→
Н Н
Н-С - С-Н
? ?
ГІДРУВАННЯ
НЕ МАЄ ПРАКТИЧНОГО ЗНАЧЕННЯ
Н Н
Н-С=С-Н
+ Br2
→
Н Н
Н-С - С-Н
? ?
ГАЛОГЕНУВАННЯ
РОЗПІЗНУВАННЯ НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ
ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ,
Н Н
Н-С=С-Н
+ HCl
→
Н Н
Н-С - С-Н
? ?
ПРИЕДНАННЯ ГАЛОГЕНВОДНЮ
ОТРИМАННЯ ХЛОРЕТАНУ ЯКИЙ ВИКОРИСТОВУЮТЬ ДЛЯ МІСЦЕВОЇ АНЕСТЕЗІЇ, ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ, ТА ОБЕЗЗАРАЖЕННЯ ЗЕРНОСХОВИЩ
Н Н
Н-С=С-Н
+ H2O
→
Н Н
Н-С - С-Н
? ?
ГІДРАТАЦІЯ
ОТРИМАННЯ ЕТИЛОВОГО СПИРТУ, РОЗЧИННИКІВ, ДЛЯ ВИРОБНИЦТВА КАУЧУКА
Реакції приєднання
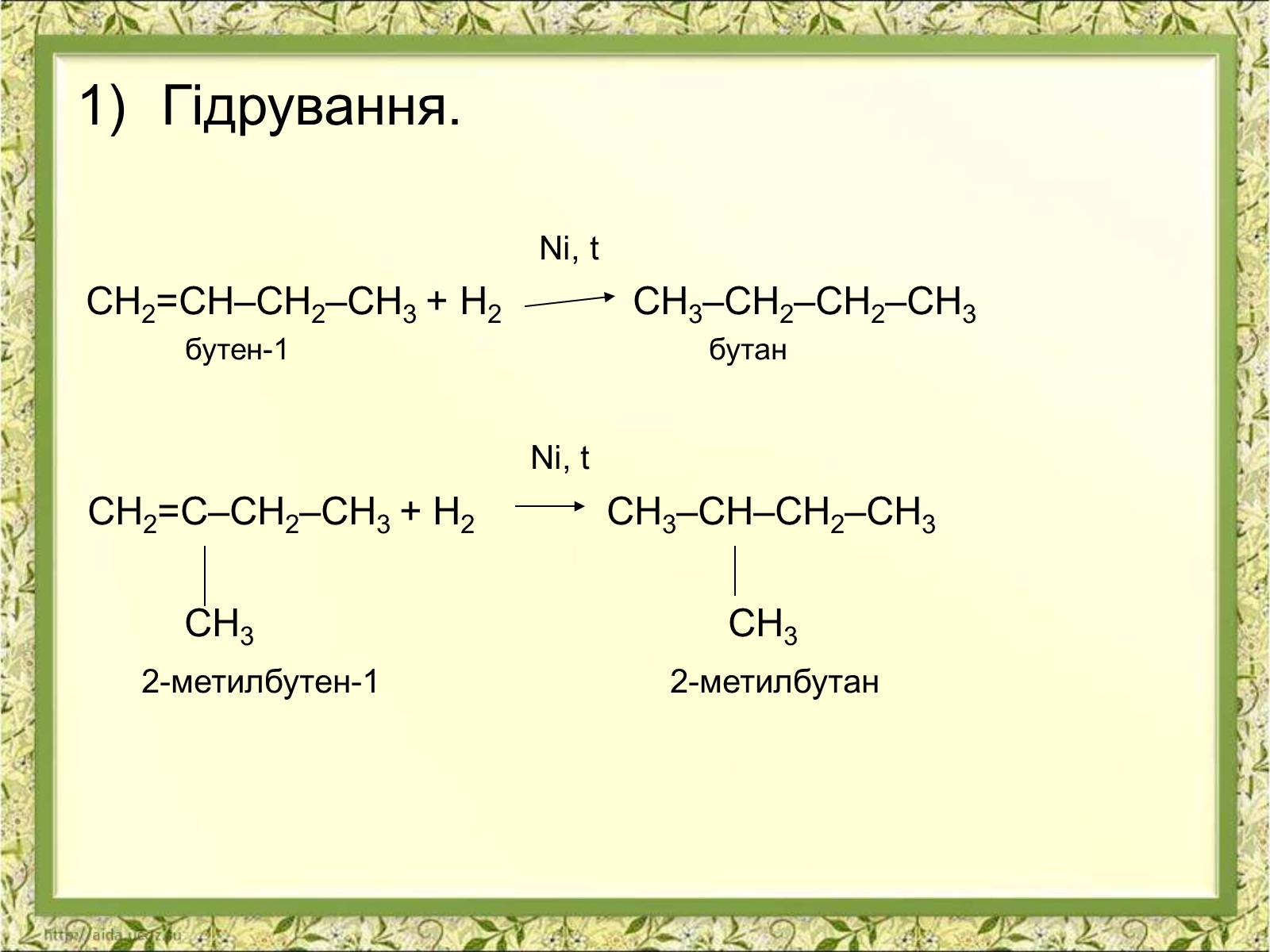
Гідрування.
Ni, t
СН2=СН–СН2–СН3 + Н2 СН3–СН2–СН2–СН3
бутен-1 бутан
Ni, t
СН2=С–СН2–СН3 + Н2 СН3–СН–СН2–СН3
СН3 СН3
2-метилбутен-1 2-метилбутан

2) Галогенування.
СН2=СН2 + Br2 СН2–СН2
этилен
Br Br
1, 2-дибромэтан

4.Гідрогенгалогенування
Правило Марковнікова
Російський хімік-органік.
В реакціях приеднання полярних молекул до несиметричних алкенів, водень приеднуеться до більш гідрогенізованого атому карбону при подвійному звязку .
15.05.2014
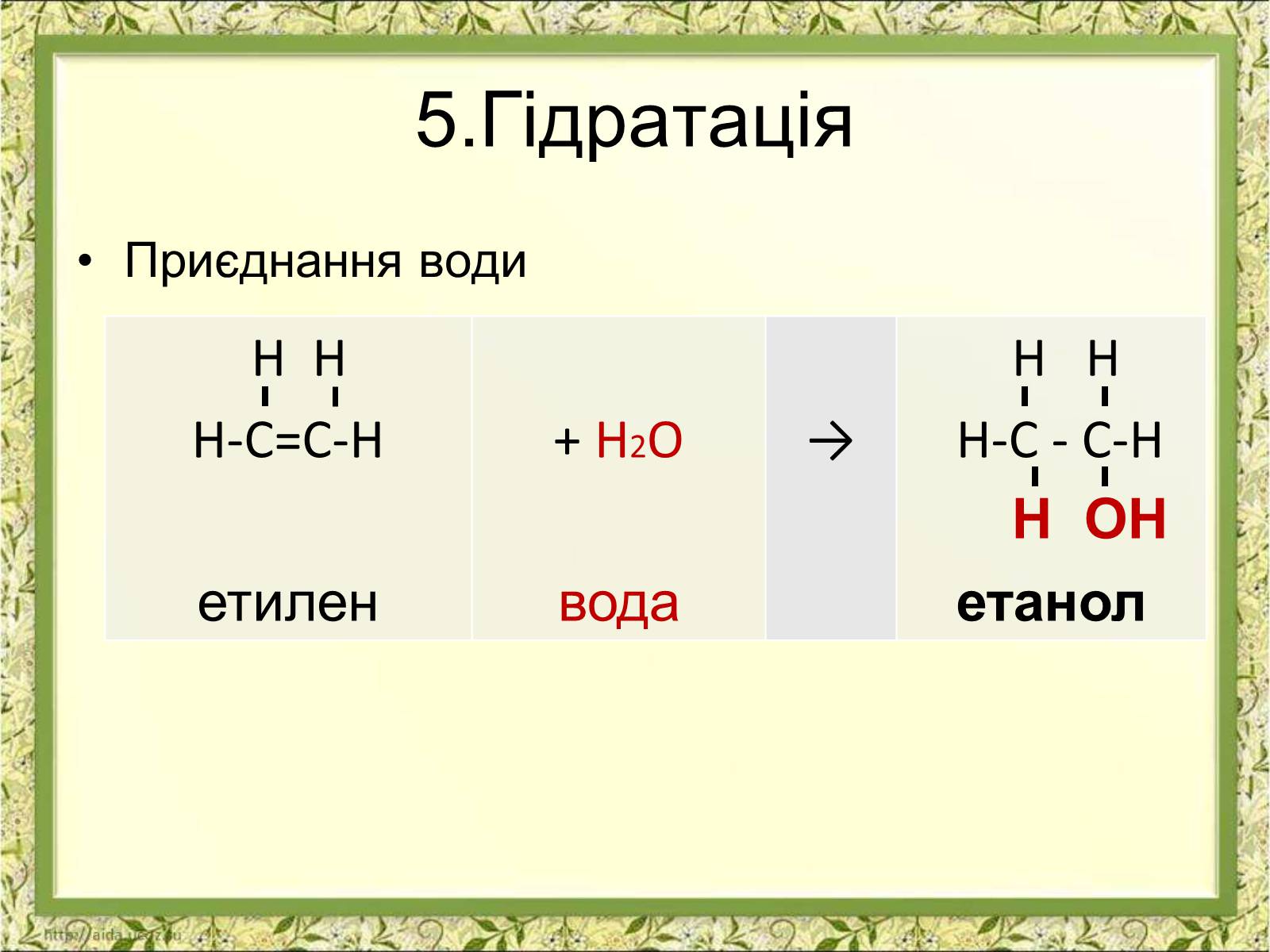
5.Гідратація
Приєднання води
Н Н
Н-С=С-Н
етилен
+ H2O
вода
→
Н Н
Н-С - С-Н
Н ОН
етанол
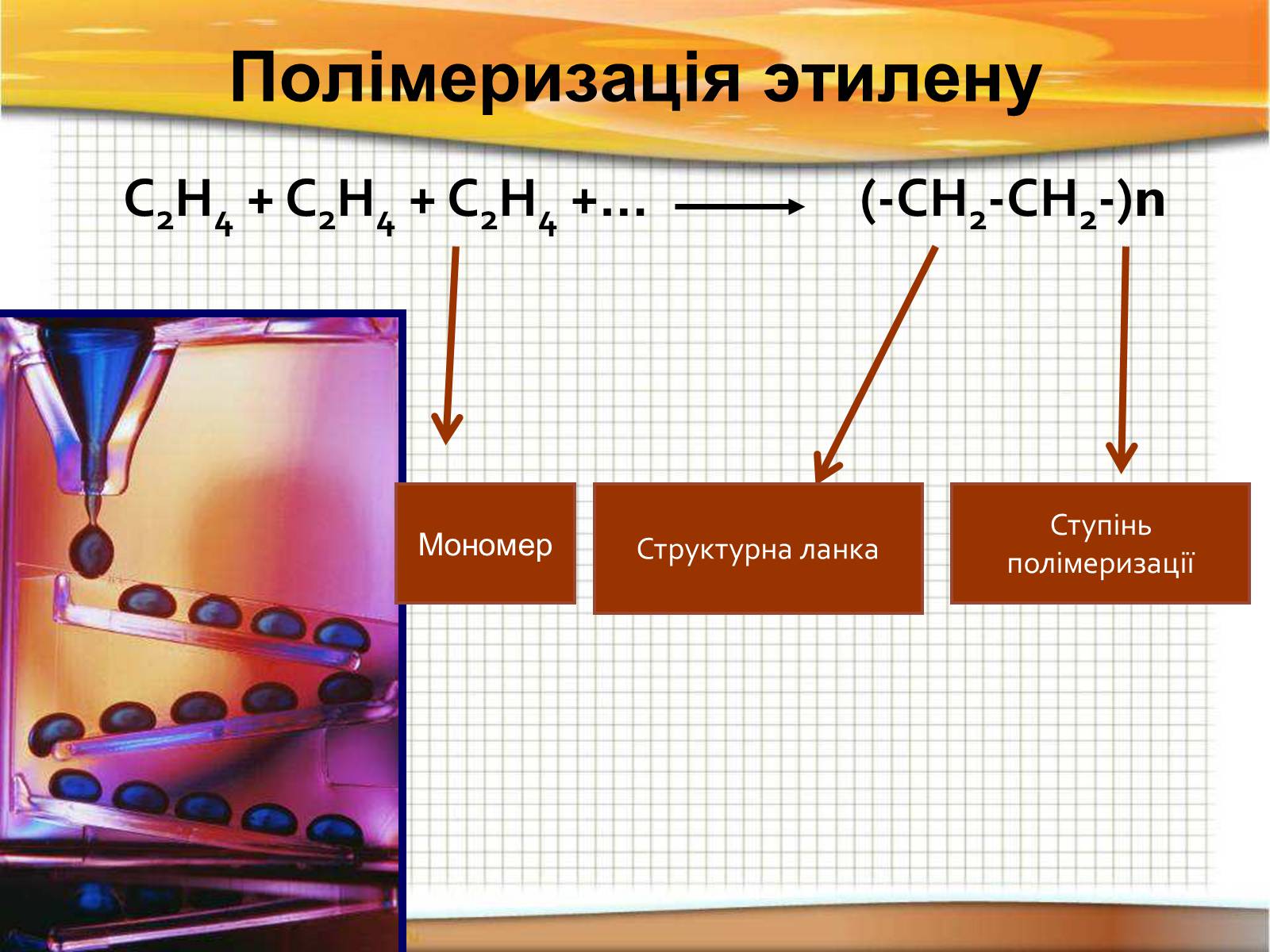
Полімеризація этилену
С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n
Структурна ланка
Ступінь полімеризації
Мономер

Полімеризація этилену
С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n
Структурна ланка
Ступінь полімеризації
Мономер

Полімеризація этилену
С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n
Структурна ланка
Ступінь полімеризації
Мономер

Полімеризація этилену
С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n
Структурна ланка
Ступінь полімеризації
Мономер

Полімеризація этилену
С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n
Структурна ланка
Ступінь полімеризації
Мономер
