Презентація на тему «Сполуки неметалічних елементів з Гідрогеном»

Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємодія амоніаку та хлороводню з водою. Солі амонію. Якісна реакція на йони амонію та хлорид-іони. Оксиди неметалічних елементів. Кислотний характер оксидів та гідратів оксидів неметалічних елементів.

Мета: .
Ознайомити зі складом та особливостями будови молекули аміаку та хлорводню.
Розглянути лабораторні способи добування та фізичні властивості.
Підкреслити необхідність додержання правил техніки безпеки.
Дослідити розчинення аміаку та хлорводню у воді та дію цього розчину на індикатори.
Формувати уміння складати рівняння реакцій, що характеризують хімічні властивості аміаку як основи та відновника.
Повторити і розширити уявлення про солі та їх загальні властивості з урахуванням солей амонію.
Сформувати поняття про донорно-акцепторний механізм утворення ковалентного зв'язку.
Ознайомити із специфічними властивостями солей амонію. Формувати вміння складати рівняння реакцій для солей амонію, що характерні для всіх солей (дисоціація, взаємодія з кислотами, солями) та виявляють специфічні властивості (взаємодія з лугами, термічний розклад), пояснювати рівняння реакцій з позицій теорії електролітичної дисоціації.
Ознайомити з добуванням солей амонію.

Демонстрації:
1. Якісна реакція на хлорид-іон.
2. Добування амоніаку і розчинення його у воді (“фонтан”), випробування розчину фенолфталеїном.
3. Утворення амоній хлориду з амоніаку і хлороводню.
4. Якісна реакція на йон амонію.
Лабораторні досліди:
2. Виявлення хлорид-іонів у розчині.
3. Виявлення йонів амонію в розчині.

Сполуки неметалічних елементів з Гідрогеном.

Склад і назви сполук.
Сполуки з Гідрогеном відомі для більшості неметалічних елементів;
їх не утворюють лише інертні елементи.
Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко.
Щоб з'ясувати значення валентності елемента в такій сполуці, потрібно від числа 8 відняти номер групи періодичної системи, в якій міститься елемент.
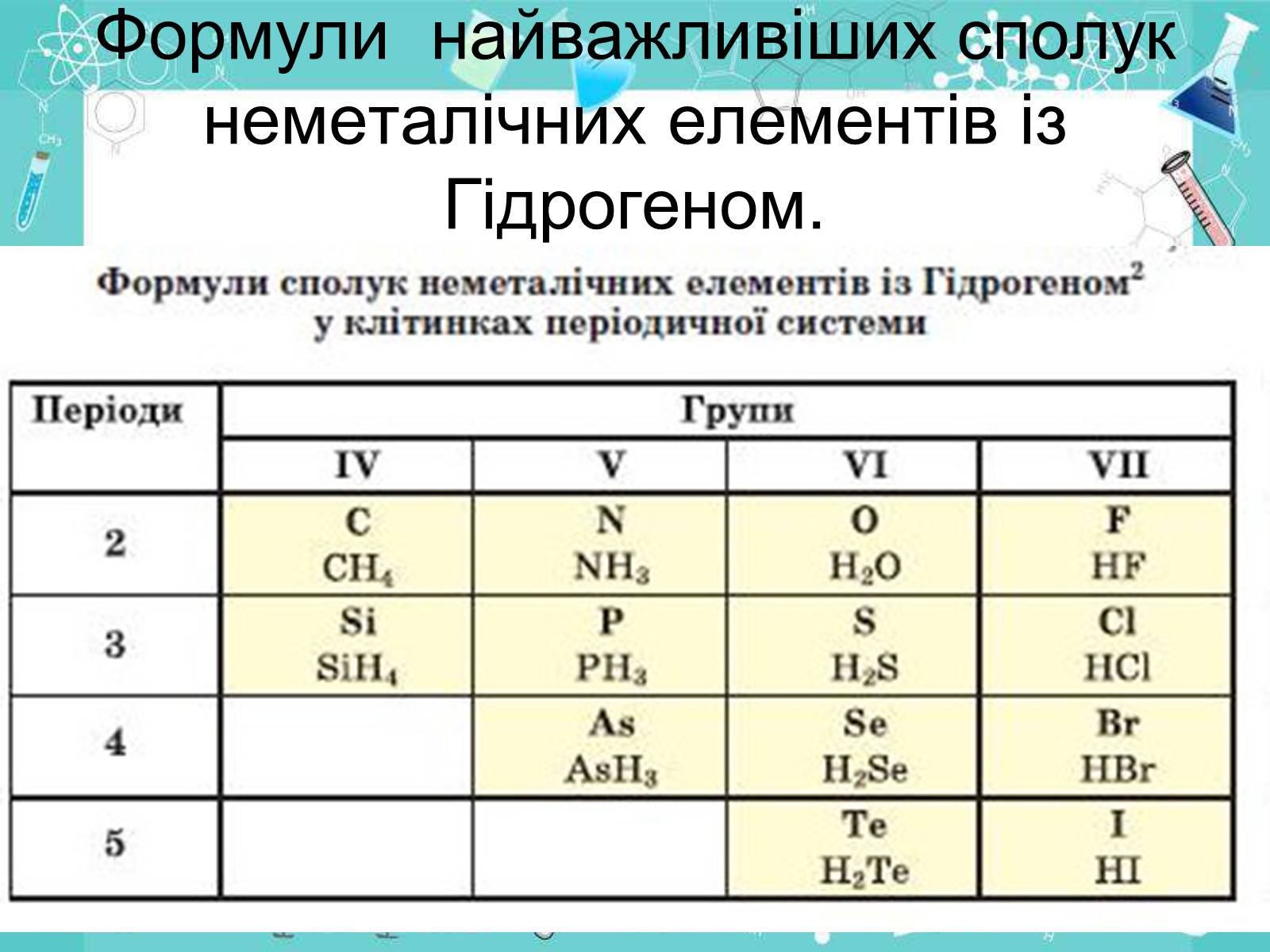
Формули найважливіших сполук неметалічних елементів із Гідрогеном.

Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НnЕ і ЕНn.
Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним.
Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку

Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви
амоніак,
метан,
вода,
хлороводень,
сірководень та ін.),
іноді — хімічні
гідроген хлорид,
гідроген сульфід тощо.
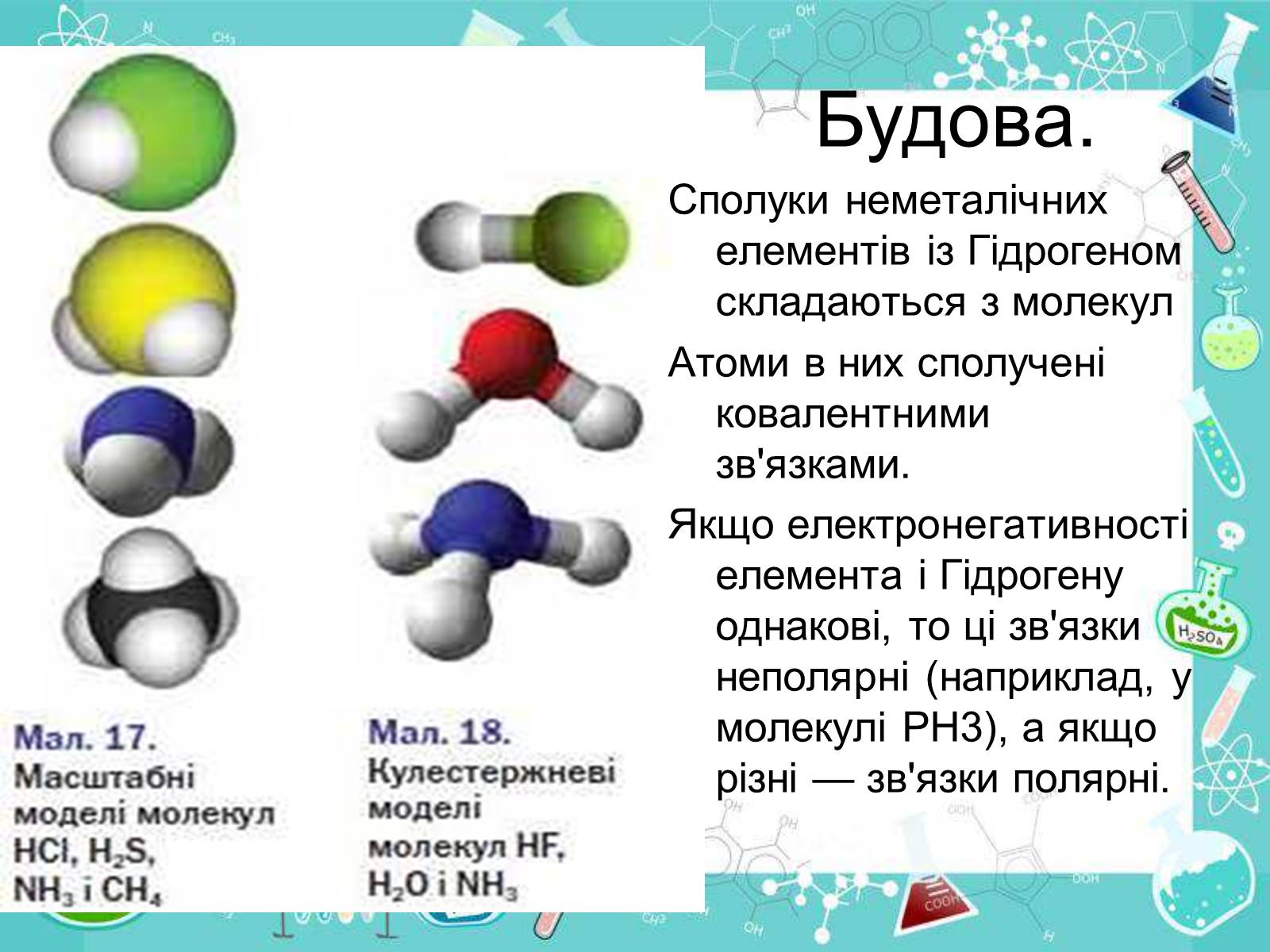
Будова.
Сполуки неметалічних елементів із Гідрогеном складаються з молекул
Атоми в них сполучені ковалентними зв'язками.
Якщо електронегативності елемента і Гідрогену однакові, то ці зв'язки неполярні (наприклад, у молекулі РН3), а якщо різні — зв'язки полярні.

Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4).
В іншому разі в одній частині молекули зосереджується невеликий негативний заряд, а в протилежній — позитивний заряд.
Така молекула полярна; вона має два електричні полюси і називається диполем.
Полярними є молекули НF, Н2О, NН3
- +

Фізичні властивості.
Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НF (за температури нижче 19,5 °С) і вода — рідинами.
Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким.
Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності
Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами

Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С).
Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині.
Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації.
Розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном у воді виявляють властивості кислот.
Водні розчини НСL, НВг і НІ поводяться як сильні одноосновні кислоти, НF — як кислота середньої сили, а Н2S — як слабка двохосновна кислота.

Метан СН4 інертний щодо води (за звичайних умов).
Водний розчин амоніаку NН3, на відміну від розчинів інших сполук неметалічних елементів із Гідрогеном, має лужну реакцію
Вам відомо, що вода є слабким електролітом. Мізерна частка її молекул дисоціює з утворенням йонів Н+ і ОН~:
Отже, воду можна вважати дуже слабкою кислотою і водночас дуже слабкою основою.
Водні розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном виявляють властивості кислот.

Нітроген

Історія вікриття нітрогену:
У 1772 р. Англієць Д. Резерфорд встановив, що повітря, що залишився під дзвоном, де жила кілька днів миша, звільнений від вуглекислоти, не підтримує горіння і дихання.
Це повітря він назвав «отруйним повітрям». У тому ж році Прістлі Дж. отримавши «отруйний повітря» іншим шляхом, назвав його «флогістрованому» повітрям.
У 1773 році К.В. Шіле встановив, що повітря складається з двох газів. Він назвав газ, який не підтримує горіння і дихання «Поганим» або «зіпсованим» повітрям.
У 1776 р. Лавуазьє, докладно досліджуючи «Отруйний», «флогістрованому» і«Поганий» повітря, встановив тотожність між ними.
У 1787 р. Лавуазьє запропонував назвати цей газ «азотом» (від грец. Слова «а» -заперечення і «Зое»-життя).
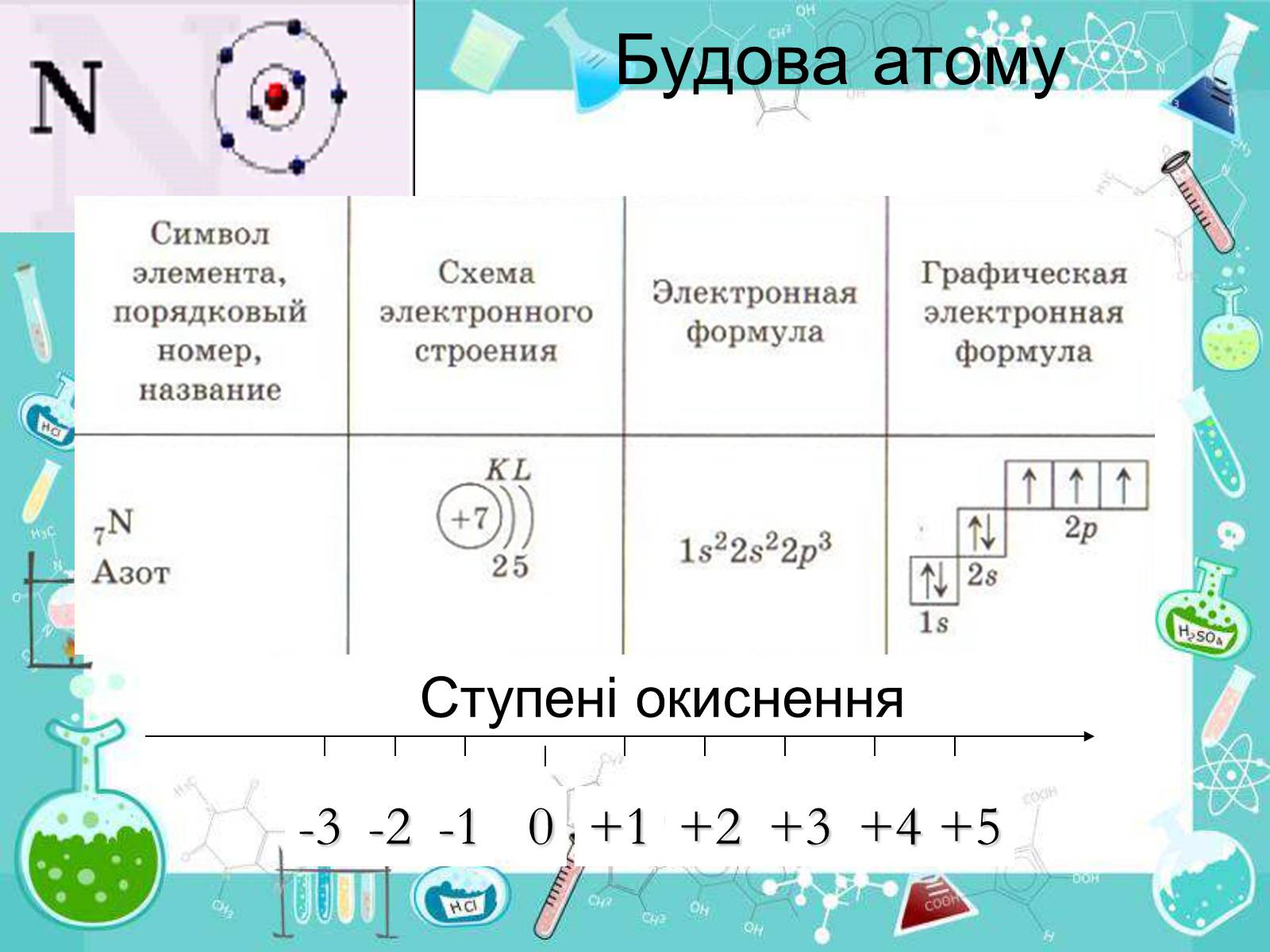
Будова атому
Ступені окиснення
-1
+1
-2
-3
+2
+3
+4
+5

Яким чином можна пояснити хімічну інертність молекули азоту?
?
2 атома азоту з'єднані в молекулу потрійний ковалентного неполярної зв'язком, цим пояснюється міцність молекули і як наслідок її хімічна інертність.

Отримання :
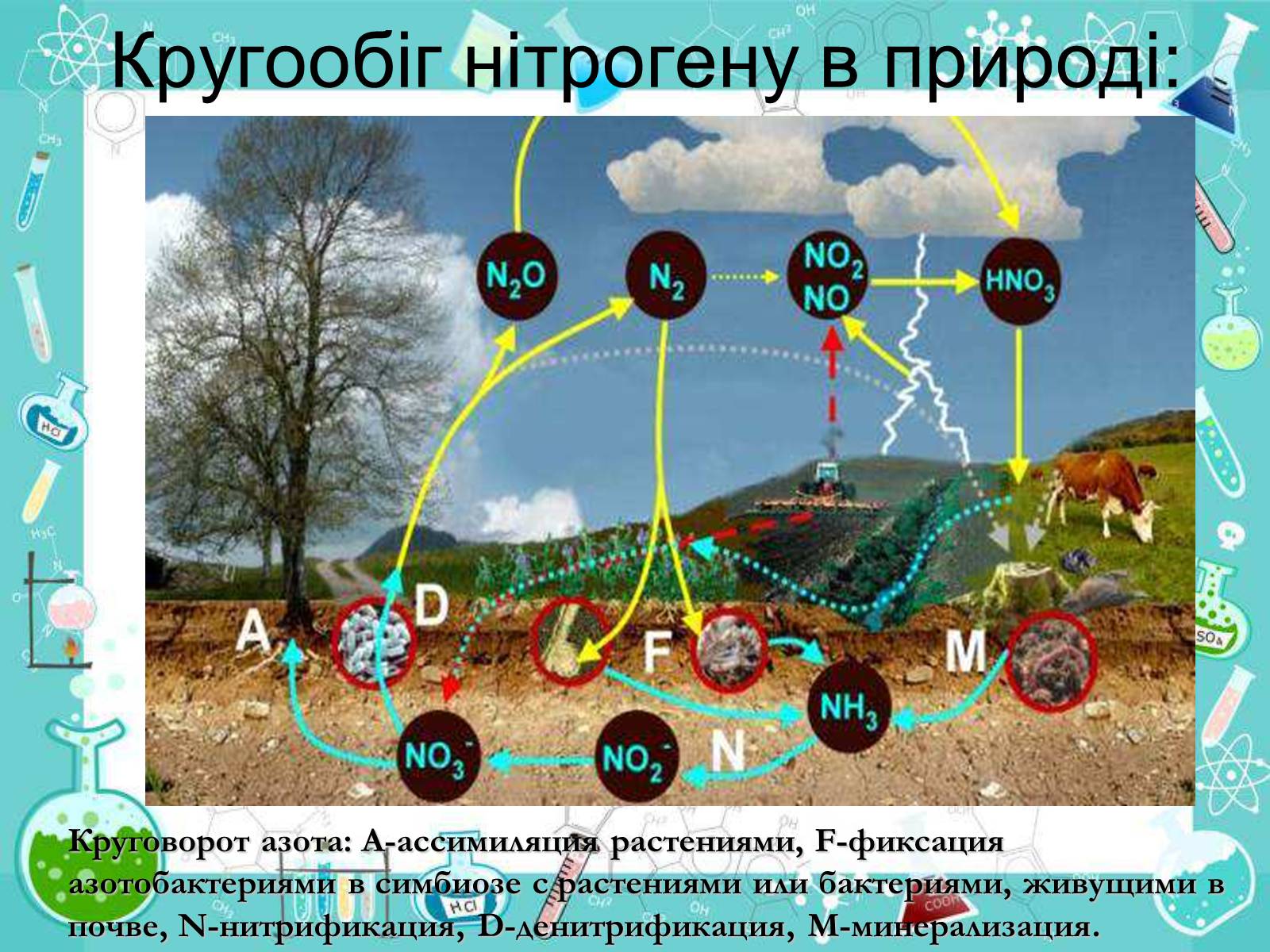
Кругообіг нітрогену в природі:
Круговорот азота: А-ассимиляция растениями, F-фиксация азотобактериями в симбиозе с растениями или бактериями, живущими в почве, N-нитрификация, D-денитрификация, М-минерализация.
Амоніак

Амоніак
Будова молекули.
Молекула аміаку NH3 являє собою диполь: спільні електронні пари дуже зміщені до атома Нітрогену
.. ..
NH3 H :N: H N
..
N H H H

Властивості амоніаку.
Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за – 33,4ОС, він переходить у рідкий стан.
Маса 1 л амоніаку за нормальних умов дорівнює 0,77 г.
При охолодженні до 33,4ºС амоніак під звичайним тиском перетворюється у прозору рідину, що твердне при – 77,8ºС.
Амоніак добре розчинний у воді: 1:700. Розчинність амоніаку у воді зумовлена утворенням водневим зв'язків між їхніми молекулами

Для амоніаку характерні реакції приєднання і окислення.
1.Взаємодіє з водою і утворює гідрати NH3.H2O, NH3+H2O=NH4OH. Лужна реакція розчину амоніаку наявністю . Водний розчин NH3 – амоній гідроксид (слабка основа). Фенолфталеїн – малинове забарвлення, розчин NH3 10% нашатирний спирт.
2. Взаємодія з кислотами.
Утворюються солі амонію: NH3+HCl=NH4Cl; 2NH3+H2SO4=(NH4)2SO4
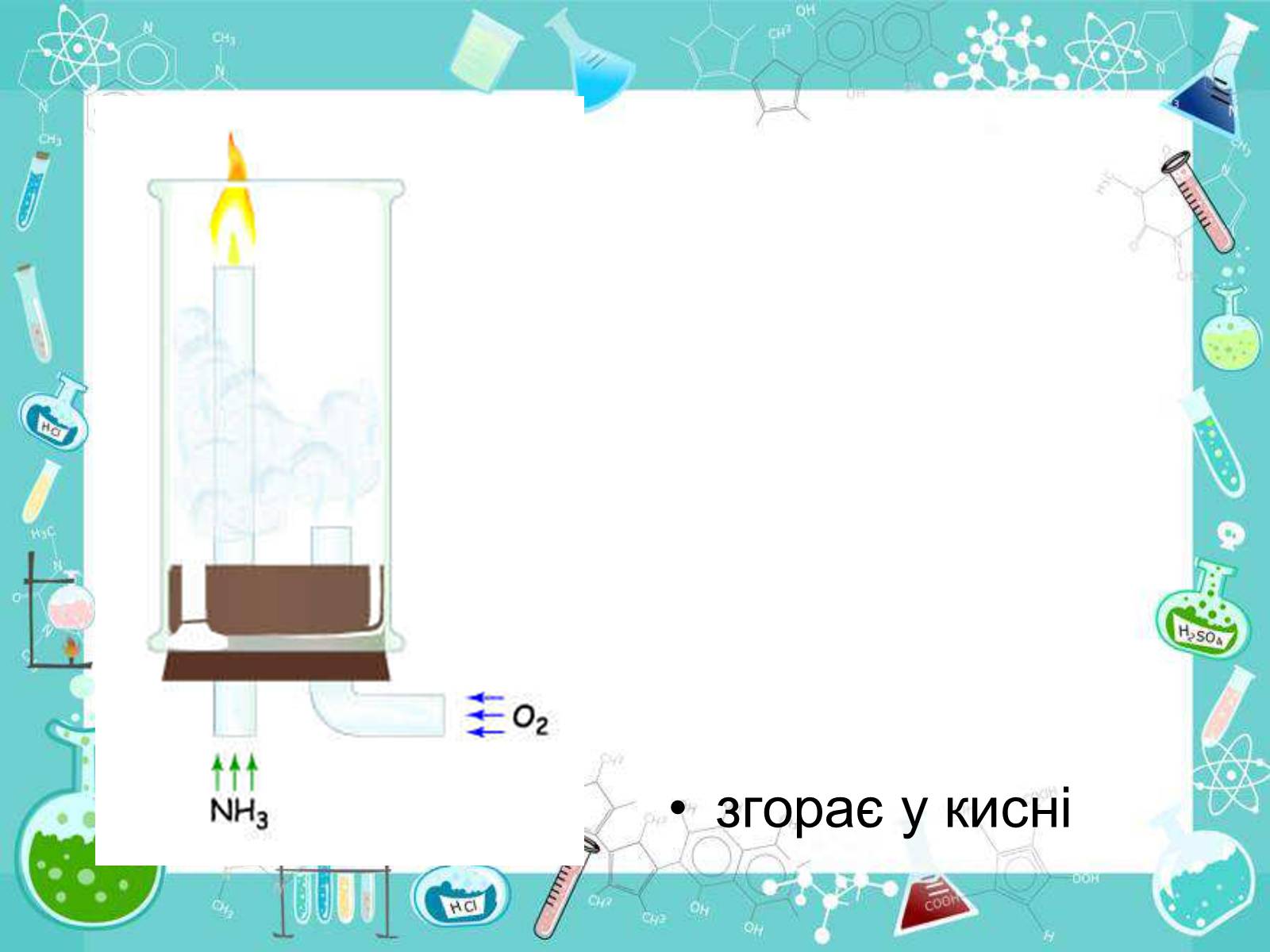
3.Відновні властивості (при нагріванні).
а) згорає у кисні: 4NH3+3О2=2N2+6Н2О; б)каталітичне окислення: 4NH3+5О2=4NО+6Н2О; в)реагує з окислювачами: 4H3N +3Br2=6НBr+3N2; 2NH3+3CuO=3Cu+N2+3H2O.
згорає у кисні

Якісна реакція на NH
1) взаємодія з лугами: _ +
NH ОН =NH3 +H2O
Реакцію проводять: у пробірку з сіллю або розчином, що аналізують, додають розчин лугу і суміш обережно нагрівають.
При наявності NH виділяється амоніак.

Добування
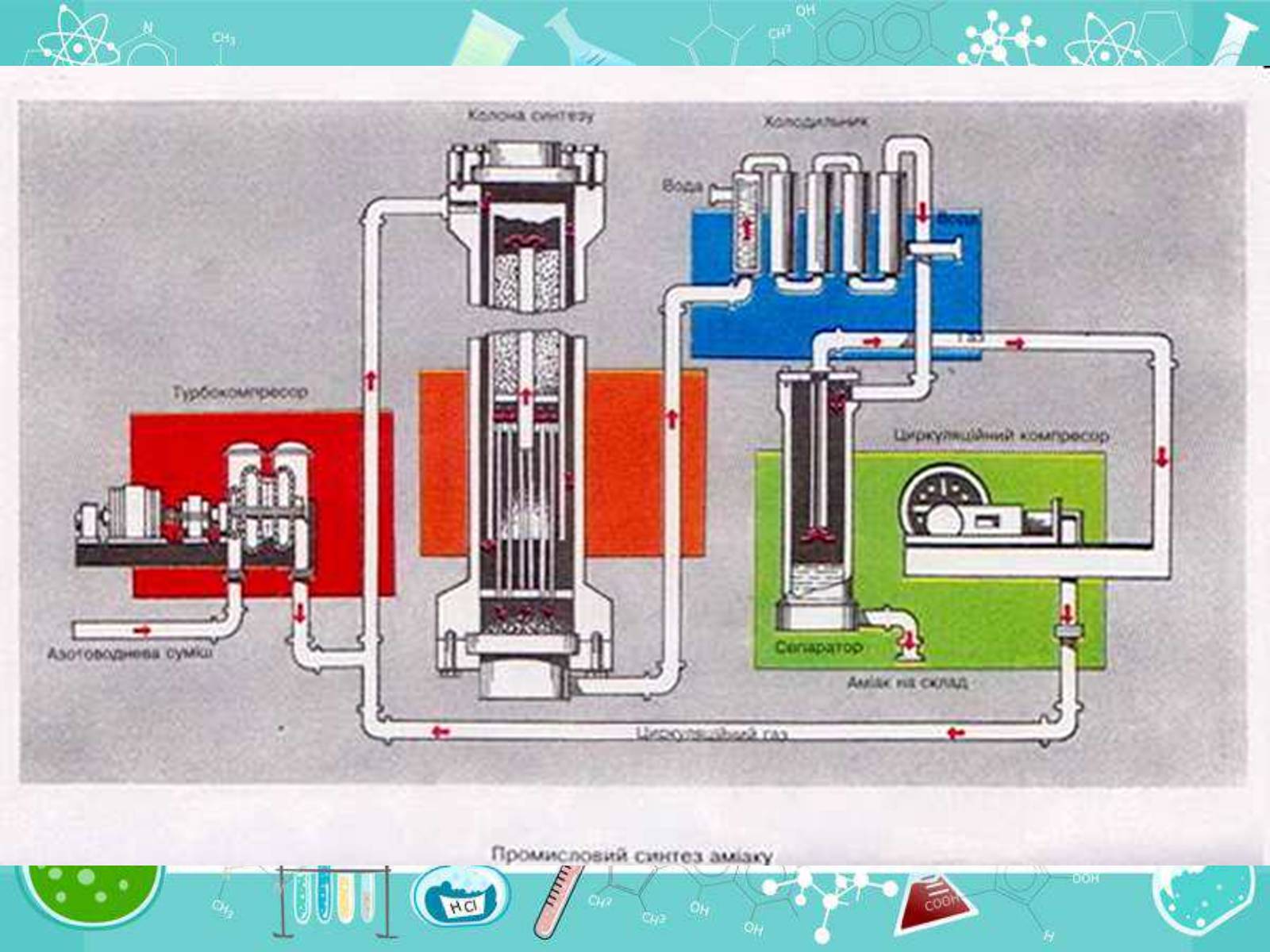
У лабораторії амоніак добувають, нагріваючи амоній хлорид гашеним вапном. 2NH4Cl+Ca(OH)2=CaCl2+H2O+2NH3 Амоніак, що утворився висушують СаО.
У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція азоту з воднем екзотермічна, вона відбувається із виділенням теплоти.
Добування
У лабораторії амоніак добувають, нагріваючи амоній хлорид гашеним вапном. 2NH4Cl+Ca(OH)2=CaCl2+H2O+2NH3 Амоніак, що утворився висушують СаО.
У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція азоту з воднем екзотермічна, вона відбувається із виділенням теплоти.
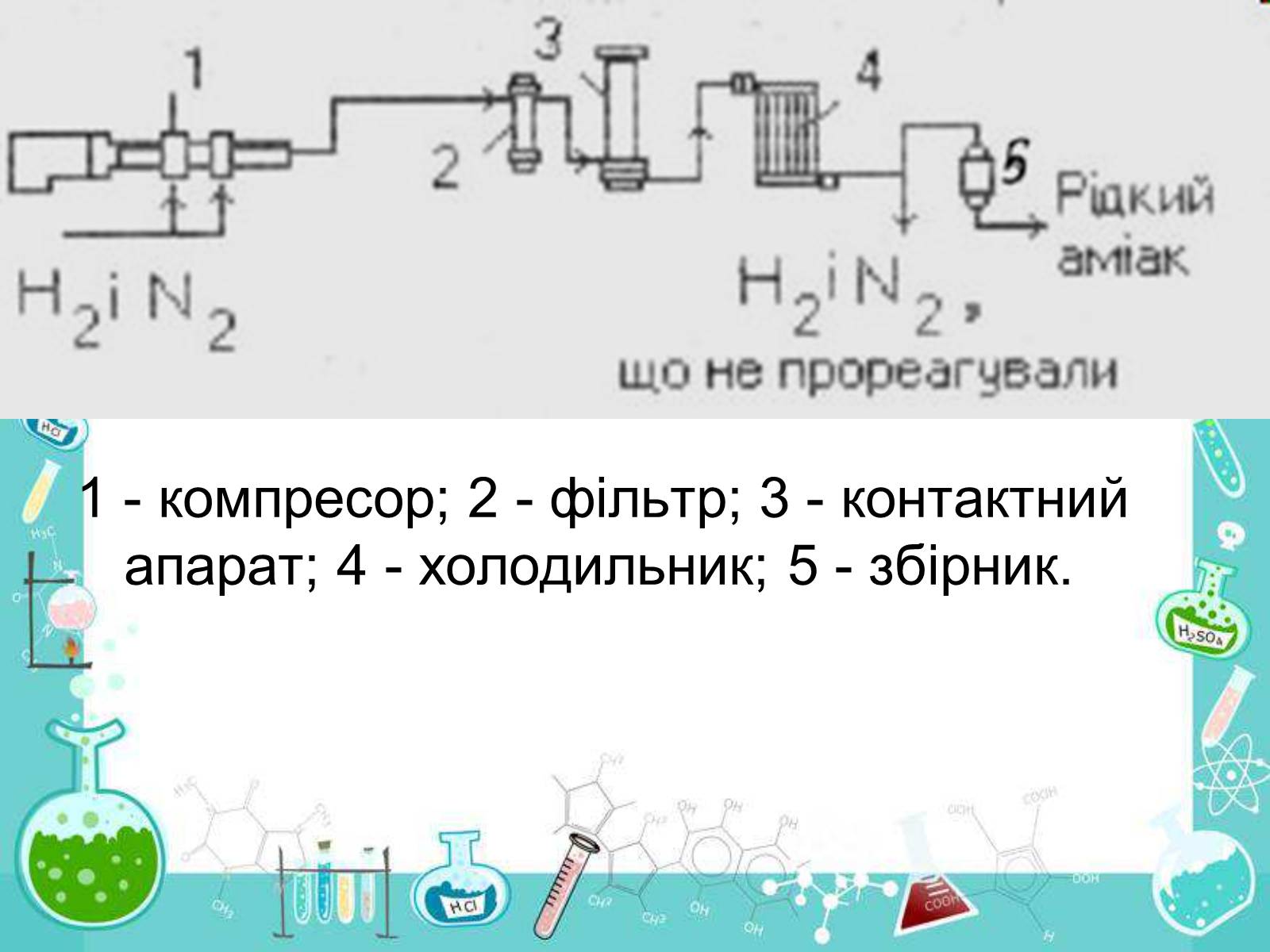
1 - компресор; 2 - фільтр; 3 - контактний апарат; 4 - холодильник; 5 - збірник.

Застосування.
Аміак — важливий продукт хімічної промисловості.
Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди.
Як холодоагент аміак застосовують у холодильниках.
У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO.
Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
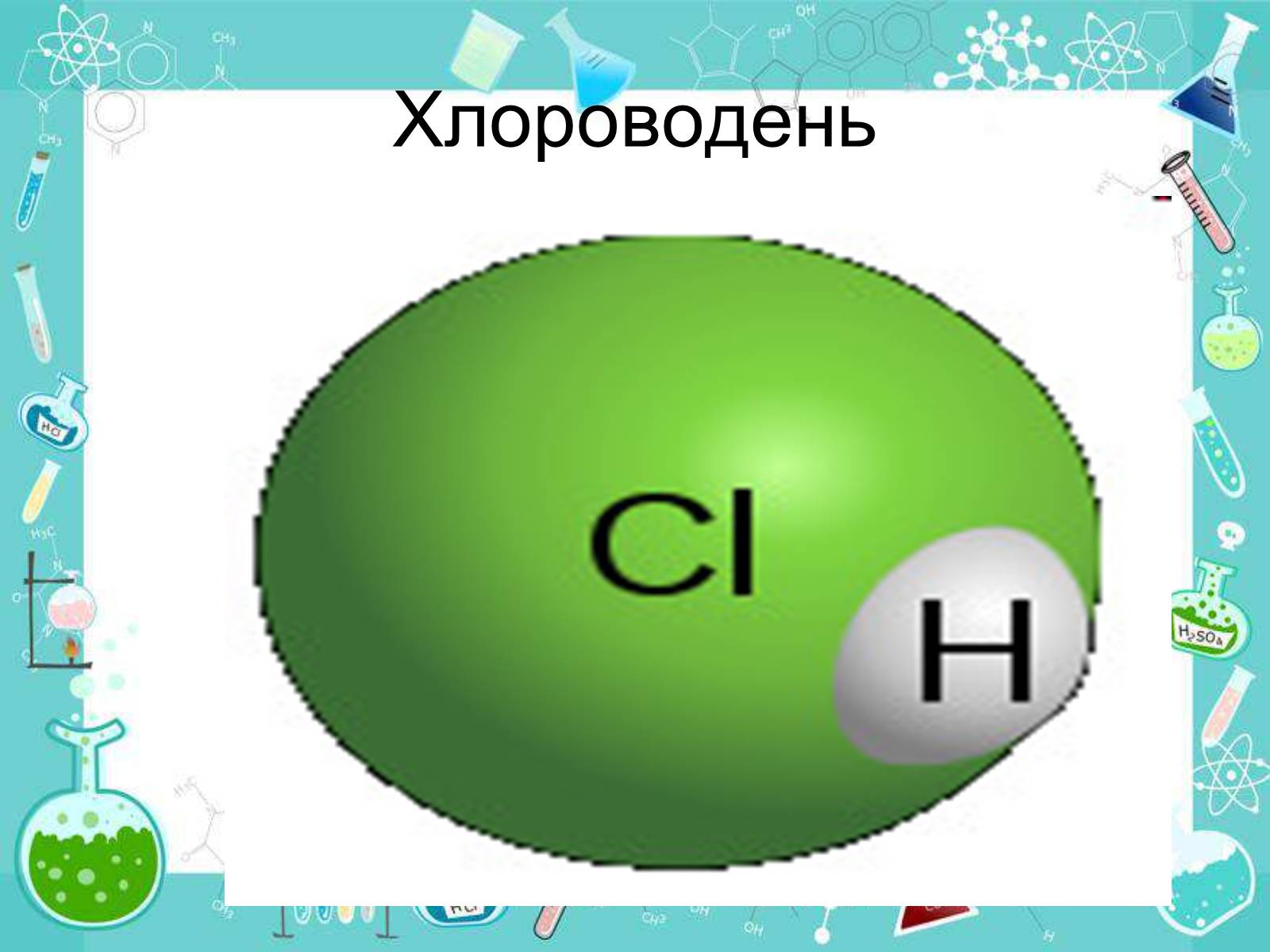
Хлороводень

Електронна і графічна формули молекули хлороводню:

Хлороводень (HCl) — безбарвний задушливий газ з різким запахом.
Температура розплавлення: −115 °C (158 K), температура кипіння: −85 °C (188 K), молекулярна маса — 70,9 а. о. м
У лабораторних умовах хлороводень одержують при дії концентрованої сульфатної кислоти на хлорид натрію при сильному нагріванні:2NaCl + Н2SO4 = Na2SO4 + 2HCl ↑
У промисловості його добувають звичайно спалюванням водню в атмосфері хлору у спеціальних пальниках: H2 + Cl2 = 2HCl

Розчин хлороводню у воді називають хлоридною, або соляною, кислотою.
Поява кислотних властивостей хлороводню в розчині обумовлюється тим, що полярна будова молекул HCl під впливом дуже полярних молекул води переходить в іонну, внаслідок чого молекули хлориду водню у розчині дисоціюють:

Хімічні властивості.
Хлоридна кислота реагує:
• з металами з виділенням водню
• з основними й амфотерними оксидами
• з основами й амфотерними гідроксидами
• із більшістю солей

Добування гідроген хлориду і хлоридної кислоти.
У промисловості гідроген хлорид добувають спалюванням водню в атмосфері хлору

Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою:
Таким способом раніше добували хлороводень і в промисловості.

ВЗАЄМОДІЯ АМОНІАКУ ТА ХЛОРОВОДНЮ З ВОДОЮ.
Аміак добре розчиняється у воді утворюючи аміачну воду (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH3). Висока розчинність аміаку пояснюється тим, що він реагує з водою.
Водний розчин гідроген хлориду називають хлоридною кислотою. Тривіальна назва цього розчину — соляна кислота.

Солі амонію.

СОЛІ АМОНІЮ — це кристалічні речовини з йонним типом зв'язку.
До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.
Фізичні властивості.
Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів.
У воді добре розчиняються.

Нітрат амонію

Солі амонію добувають при взаємодії амоніаку або амоній гідроксид з кислотами: NH3+NHО3=NH4NО3; 2NH3+H2SO4=(NH4)2SO4;
NH4OH+HNO3=NH4NO3+H2O.
У катіоні NH є чотири ковалентні зв'язки: донор акцептор

Хімічні властивості солей
Сіль і метал
Сіль і основа
СільtttСіль і кислота
Сіль і сіль
+ Me
+ луг
+кислота
+сіль

Солі амонію виявляють загальні властивості солей:
1) взаємодіють з лугами: NH4Cl+NaOH=NaCl+NH4OH (NH3 +H2O)
2) взаємодіють з кислотами: 2NH4Cl+H2SO4=(NH4)2SO4+2HCl
3) взаємодіють із солями: (NH4)2SO4+BaCl2=2NH4Cl+BaSO4
Всі амонійні солі добре розчиняються у воді. У водних розчинах солі добре гідролізують. NH +H2O=NH4OН+ H

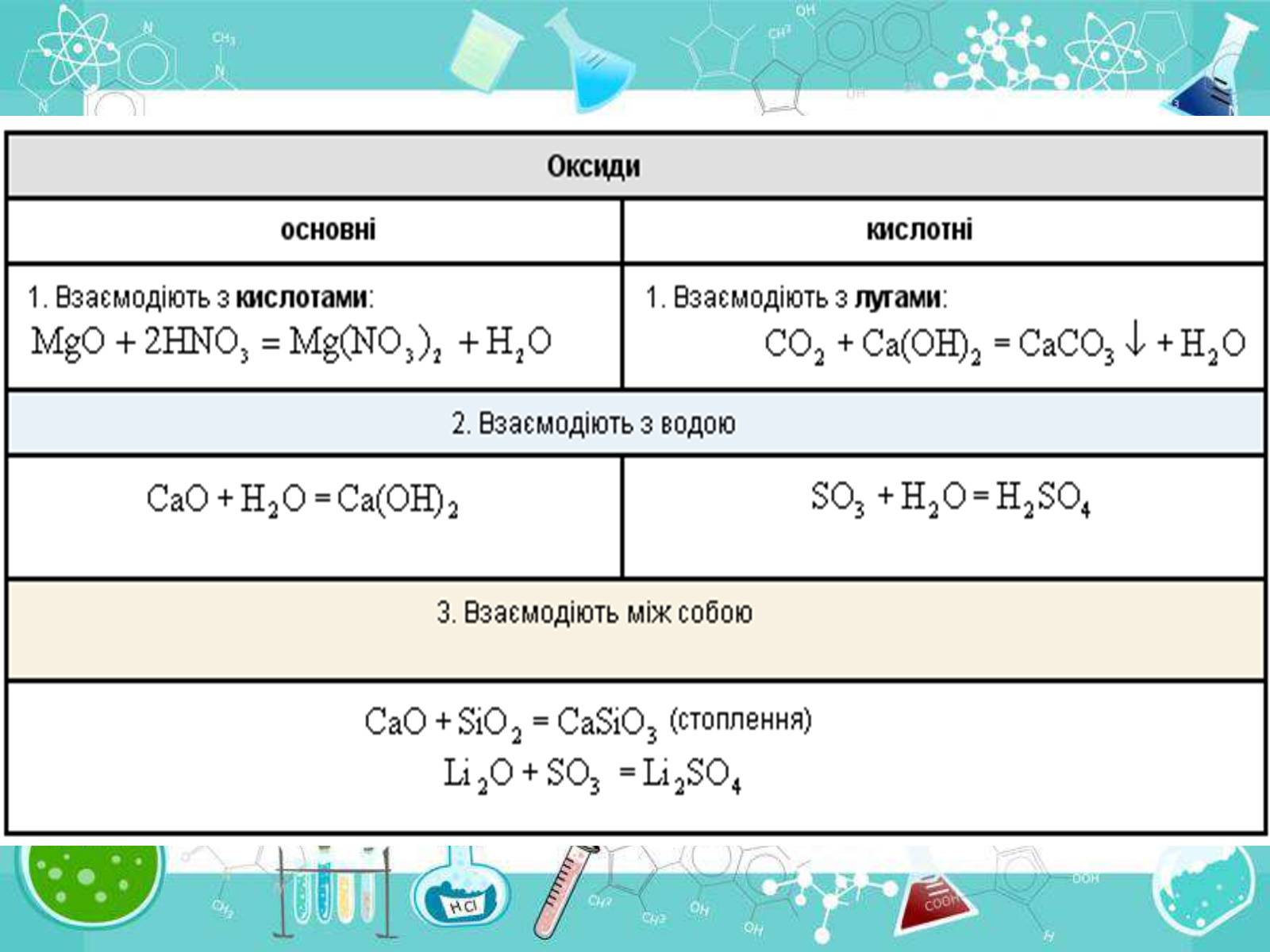
Оксиди неметалічних елементів.
Мають кислотний характер
Оксиди неметалічних елементів.
Мають кислотний характер

СУЛЬФУР утворює два кислотні оксиди:
оксид сульфуру (ІV) S02
і оксид сульфуру(VI) S03

Оксид сульфуру(IV) SO2 (діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Токсичний
Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S02).
Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S02 з водою, внаслідок чого утворюється сульфітна кислота:
S02 + Н20 = H2S03
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
Оксид сульфуру (VІ) S03(триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали.
Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки.
Зберігають його у запаяних скляних посудинах.
Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
S03 + Н20 = H2S04
Добувають оксид сульфуру(VI) у результаті окиснення S02 киснем повітря

НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
+1 +2 +3 +4 +5
N20, NO, N203, N02, N2O5
Усі оксиди нітрогену дуже отруйні, за винятком N20.

Оксид нітрогену (І) N20 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N20 у суміші з киснем використовується в медицині для наркозу. Не отруйний.
Оксид нітрогену (ІІ) NO — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів.
На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N02:
2NO + 02 = 2N02
Оксид нітрогену (IV) N02 — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної
2N02 + Н20 = HN03 + HN02
Оксид нітрогену(ІІІ) N203 — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту:
N2О3 + Н2О = 2HN02
Оксид нітрогену(V) N205 — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту: N205 + H2О = 2HN03
Нітратна кислота являє собою сильну одноосновну кислоту.
Її солі — нітрати

З оксидів фосфору
Р205 і Р203
найбільше значення має оксид фосфору(V).

Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів.
Типовий кислотний оксид.
Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
Р205 + Н20 = 2НР03
холодна метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча ортофосфатна
кислота

ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди —
С02 і СО.
С02 — оксид карбону(IV), діоксид карбону, вуглекислий газ;
СО — оксид карбону(II), монооксид карбону, чадний газ.

Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря. Чадний газ СО — дуже отруйний.
Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!

Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє.
Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
2. Взаємодія з основами і основними оксидами.
Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
2СО + О = 2С02, ΔH = -572 кДж,
через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві);
б) здатність відновлювати метали з оксидів (під час нагрівання):
Fe304 + 4СО = 3Fe + 4С02↑
Зазначена властивість використовується під час виплавляння металів із руд.

Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.

Для елемента Силіцію характерним є SiO2 —оксид силіцію(IV), діоксид силіцію, кремнезем.

Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).

Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.