Презентація на тему «Залізо» (варіант 1)

Залізо
Ферум (Fe)
Виконала
учениця 10-А класу
Чайка Ірина

Ферум
Ферум належить до восьмої групи періодичної системи елементів Менделєєва. Його атоми на зовнішній електронній оболонці мають по два електрони, а на передостанній — 14 електронів. Атоми феруму можуть легко втрачати два електрони і перетворюватись у двовалентні катіони Fe2+. Вони можуть втрачати і три електрони (один з передостанньої оболонки) і перетворюватись у тривалентні катіони Fe3+. Таким чином, залізо утворює два ряди сполук. Сполуки тривалентного феруму стійкіші.
Це сріблясто-сірий, пластичний і ковкий метал, який легко окиснюється, утворюючи оксиди феруму у вигляді товстої плівки (іржі), що сповільнюють подальше руйнування заліза. Залізо електропровідний метал. На повітрі окиснюється, вкриваючись іржею FeO·nH2O. Серед інших породоутворюючих елементів має максимальну атомну масу.

Хімічні властивості:
1. На повітрі легко окисyюється в присутності вологи (ірзавіння)
4Fe+3O2 +6H2O→4Fe(OH)3
2. Залізний дріт горить у кисні, утворюючи окалину – оксид феруму (ІІ, ІІІ)
3Fe+2O2→Fe3O4
3.При високій температурі (700-900 С) реагує з парою води:
3Fe+4H2O→Fe3O4 +4H2 ↑
4. Реагує з неметалами при нагріванні
2Fe+3Br2→ →2FeBr3
Fe+S→FeO
5.Легко розчиняється в хлорид ній і розведеній сульфатній кислотах
Fe+2HCl→FeCl2 +H2 ↑
Fe+H2SO4 (розв.)→FeSO4 +H2 ↑
У концентрованих кислотах-окисниках залізо розчиняється тільки при нагріванні.
2Fe+6H2SO4 (конц.) → →Fe2(SO4)3 +3SO2↑+6H2O
Fe+6HNO3 (конц.) → →Fe(NO3)3 +3NO2↑+3H2O.
(6. Витісняє метали, що стоять правіше від нього в ряді напруг, із розчинів їх солей:
Fe+CuSO4→FeSO4+Cu↓

7.У сухому повітрі за звичайної температури залізо досить стійке, але у вологому швидко іржавіє, вкриваючись товстим шаром іржі. Іржа є сумішшю оксидів і гідроксидів феруму... Процес ржавіння заліза можна зобразити такими приблизними рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2
4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
8.Іржа досить крихка і пориста. Тому вона не може ізолювати метал від атмосфери, через що процес ржавіння відбувається безперервно. При високій температурі залізо легко сполучається з киснем, ; утворюючи окалину Fe3O4.
9.Але з концентрованою нітратною і концентрованою сульфатною кислотами без нагрівання залізо не реагує. Воно стає «пасивним», вкриваючись тонкою оксидною плівкою, яка не розчиняється в кислотах і ізолює метал від дії кислоти. Завдяки цьому концентровану нітратну і концентровану сульфатну кислоту можна зберігати і транспортувати в залізній тарі.

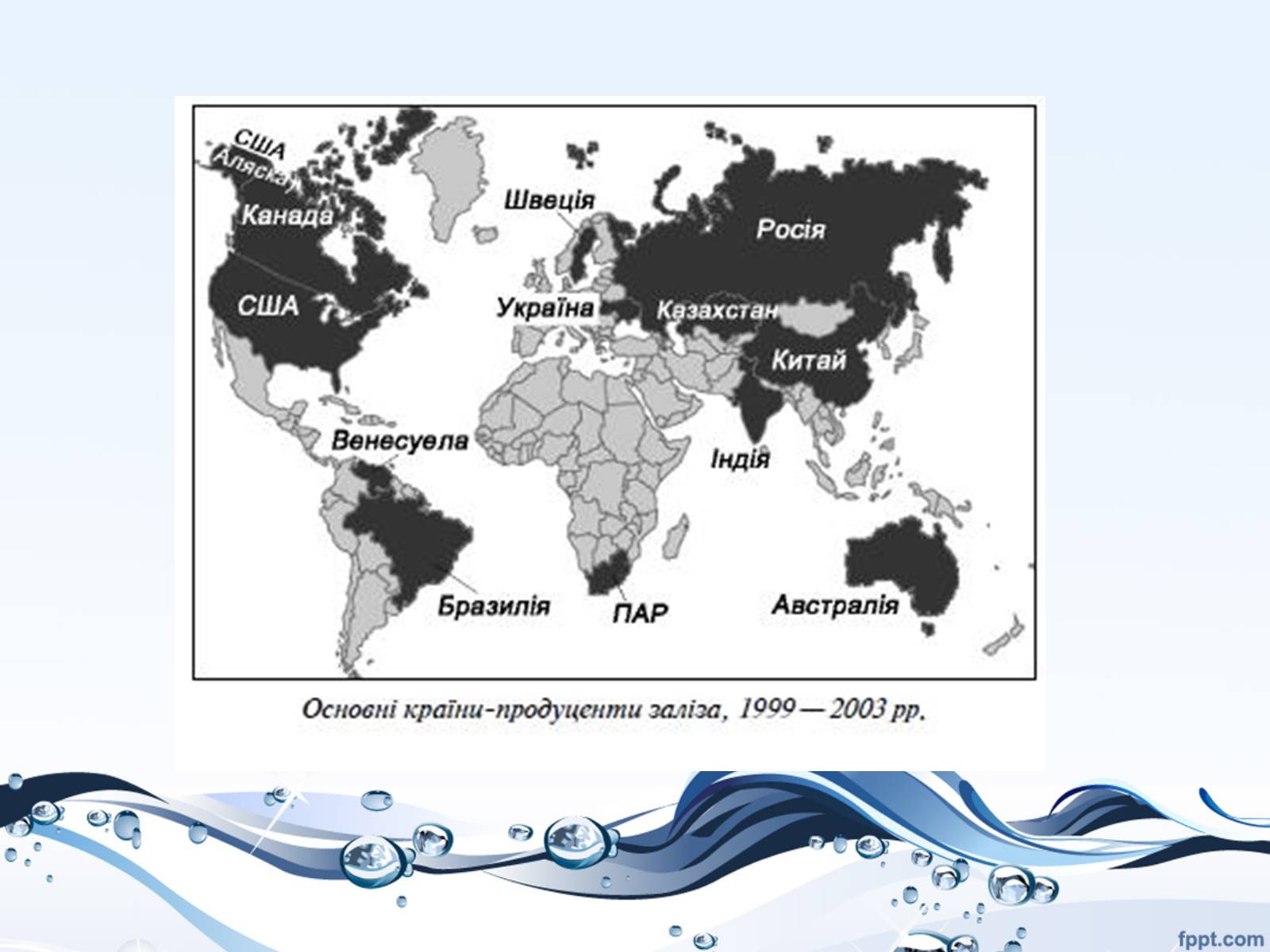
Поширеність
За поширеністю у природі ферум посідає друге місце серед металів (після алюмінію). На нього припадає 5,10 % маси земної кори. За вмістом у земній корі ферум посідає 4-е місце. Зустрічається він виключно у вигляді сполук. Вільне залізо знаходять лише в метеоритах.
Найважливішими природними сполуками феруму, що мають промислове значення є:
Магнітний залізняк(Магнетит)
Fe3O4
Червоний залізняк (Гематит)
Fe2O3
Пірит FeS2.
Оксиди феруму служать рудами, з яких добувають залізо, а пірит — сировиною для сульфатно-кислотного виробництва.

Застосування
Чисте залізо має досить обмежене застосування. Його використовують при виготовленні сердечників електромагнітів та якорів електромашин, як каталізатор хімічних процесів, для виготовлення анодних пластин залізо-нікелевих акумуляторів. Карбонільне залізо використовують для нанесення найтонших плівок і шарів на магнітофонні стрічки і диски носіїв постійної пам'яті, як антианемічний засіб та ін. Залізний порошок використовують при зварюванні, а також для цементації міді.
Чаву́н — сплав заліза з вуглецем, який може містити від 2,14 до 4,3% вуглецю і більше
Ста́ль чи криця — сплав заліза з вуглецем, який містить до 2,14 % вуглецю і домішками (кремній, марганець, сірка, фосфор та гази).

Ферум життєво важливий хімічний елемент для всіх організмів. Нестача феруму в організмі може призводити до анемії.
Входить в склад дихальних пігментів, бере участь в переносі кисню до тканин в організмі тварин і людини, стимулює функцію кровотворних органів. В якості лікарського засобу приймається при анемічних і деяких інших патологічних станах.
Організм дорослої людини містить в середньому 4-5 г феруму, з них близько 70% знаходиться в складі гемоглобіну. Залізо, існуюче в плазмі крові, є транспортною формою заліза, яке зв‘язане з білком трансферином. Вміст заліза в плазмі крові підпорядкований добовим коливанням – він знижується в другій половині дня, обмін заліза в організмі багато в чому залежить від нормального функціонування печінки. Основними джерелами заліза в харчових продуктах є продукти тваринного походження (м‘ясо, риба, печінка).
Біологічна роль

Цікаві факти і вислови
:«Рудокопи заліза видобувають для людини найкраще й найзлісніше знаряддя. Цим знаряддям прорізаємо ми землю, висаджуючи кущі, оброблюємо плодоносні сади й, обрізуючи дикі виноградні лози, примушуємо їх щоразу омолоджуватися. Цим знаряддям зводимо ми будівлі, руйнуємо камінь і використовуємо залізо на всі подібні потреби. Але тим же самим залізом вчиняємо війни, битви, грабунки й користуємося як зброєю не тільки обличчям до обличчя з ворогом, але й як летючим снарядом, що я вважаю злочинною підступністю людської винахідливості, бо для того, щоб смерть настигла людину, ми зробили її крилатою й надали залізу крила. Хай вина за це буде приписана людині, а не природі».
Письменник і вчений пізньої античності Пліній так висловився про роль заліза:

Отримання
У промисловості залізо отримують із залізної руди, в основному з гематиту, також з піриту та магнетиту (Fe2O3) і магнетиту (FeO · Fe2O3).
Існують різні способи отримання заліза з руд. Найпоширенішим є доменний процес.
Перший етап виробництва — відновлення заліза вуглецем у доменній печі за температури 2000 °C. У доменну піч вуглець (у вигляді коксу), залізна руда (у вигляді агломерату або окатишів) і флюс (наприклад, вапняк) подаються зверху, а знизу нагнітається гаряче повітря.
Залізна руда

Гідротермальне джерело з високим вмістом заліза
Хімічно чисте залізо добувають електролізом розчинів його солей.(Шматок заліза високої (99,97 %) чистоти )
Гідротермальне джерело з високим вмістом заліза
Хімічно чисте залізо добувають електролізом розчинів його солей.(Шматок заліза високої (99,97 %) чистоти )

Лепідокрокіт FeO(OH)
Слюдка рубінова, мінерал класу гідроксидів, одноосновний оксид заліза шаруватої будови. Містить (%): Fe2О3 – 89,86 і Н2O – 10,14. Домішки MnO, Al2O3, SiO2, CaO, MgO

Вироби з заліза

Вироби з заліза

Дякую за увагу