Презентація на тему «Кількість речовини. Молярна маса. Молярний об’єм»

“Кількість речовини.Молярна маса.Молярний об'єм”
Урок хімії у 8 класі
КЗ Верхівцевського НВК
Учитель Кукса Наталія Миколаївна.

Цілі:
1.Розібрати поняття:
Кількість речовини. Моль.
Число Авогадро.
Молярна маса.
Молярний об'єм.
Закон Авогадро.
Відносна густина газів.
2.Навчитися робити розрахунки за формулами.

Мета :
1. Сформувати в ході уроку поняття «кількість речовини», «число Авогадро»,Молярна маса,молярний об'єм,відносна густина газів.
2. Сформувати вміння розв'язувати задачі з використанням понять «кількість речовини», «число Авогадро».
3. Продовжити розвивати експериментальні навички роботи з речовинами, вміння спостерігати, аналізувати, робити висновки, виділяти потрібну інформацію.
4. Продовжити формувати комунікативні навички, вміння працювати в групі.

Існує фізична величина, прямо пропорційна числу частинок, складових даної речовини, які входять у взяту порцію цієї речовини, яку називають кількістю речовини (n).

Кількість речовини - фізична величина, що характеризує кількість однотипних структурних одиниць, які містяться в речовині. Під структурними одиницями розуміються будь-які частки, з яких складається речовина (атоми, молекули, іони або будь-які інші частинки). Одиницею виміру кількості речовини служить моль. Потрібно знати, що моль містить стільки ж структурних частинок, скільки міститься атомів у 12г карбону
Число Авогадро (NA) = 6,02 * 1023моль-1.

Дата рождения:
9 августа 1776
Место рождения:
Турин
Дата смерти:
9 июля 1856 (79 лет)
Место смерти:
Турин
Научная сфера:
Химия
Известен как:
Закон Авогадро
.
Амедео Авогадро, граф Куаренья и Черрето
Дата рождения:
9 августа 1776
Место рождения:
Турин
Дата смерти:
9 июля 1856 (79 лет)
Место смерти:
Турин
Научная сфера:
Химия
Известен как:
Закон Авогадро
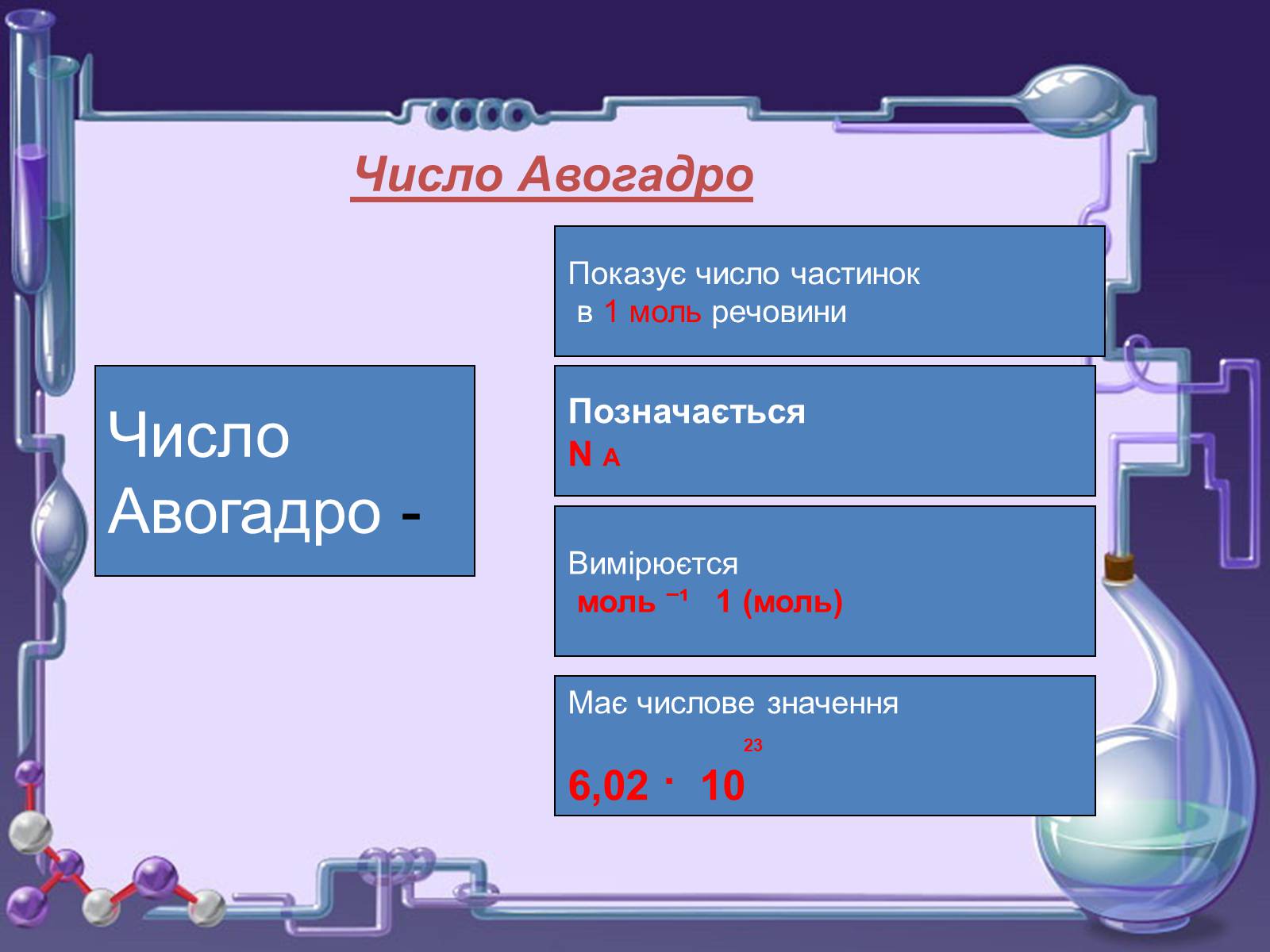
Число Авогадро
Число
Авогадро -
Показує число частинок
в 1 моль речовини
Позначається
N A
Вимірюєтся
моль ¯¹ 1 (моль)
Має числове значення
23
6,02 · 10

Молярна маса
-це маса одного моль речовини.
М = [г / моль]
(Молярна маса чисельно дорівнює молекулярній масі)
звідки

Молярна маса.
Молярня маса –
фізична величина,
яка
Показує масу 1 моля
речовини
Позначаєтся
М
Вимірюється
г/моль

Молярний об'єм. Закон Авогадро (1811 г.)
Молярний об'єм -
фізична величина,
яка
Показує об'єм, який займає
будь-який газ кількістю речовини 1 моль
Поозначаєтся Vm
Вимірюється л/моль
В рівних об'ємах різних газів при однакових умовах міститься
однакове число молекул - закон Авогадро
Нормальні умови (н.у.) - температура О ° С і тиск 1атм (101,325 кПа)
При н.у. Vm = 22,4 л / моль
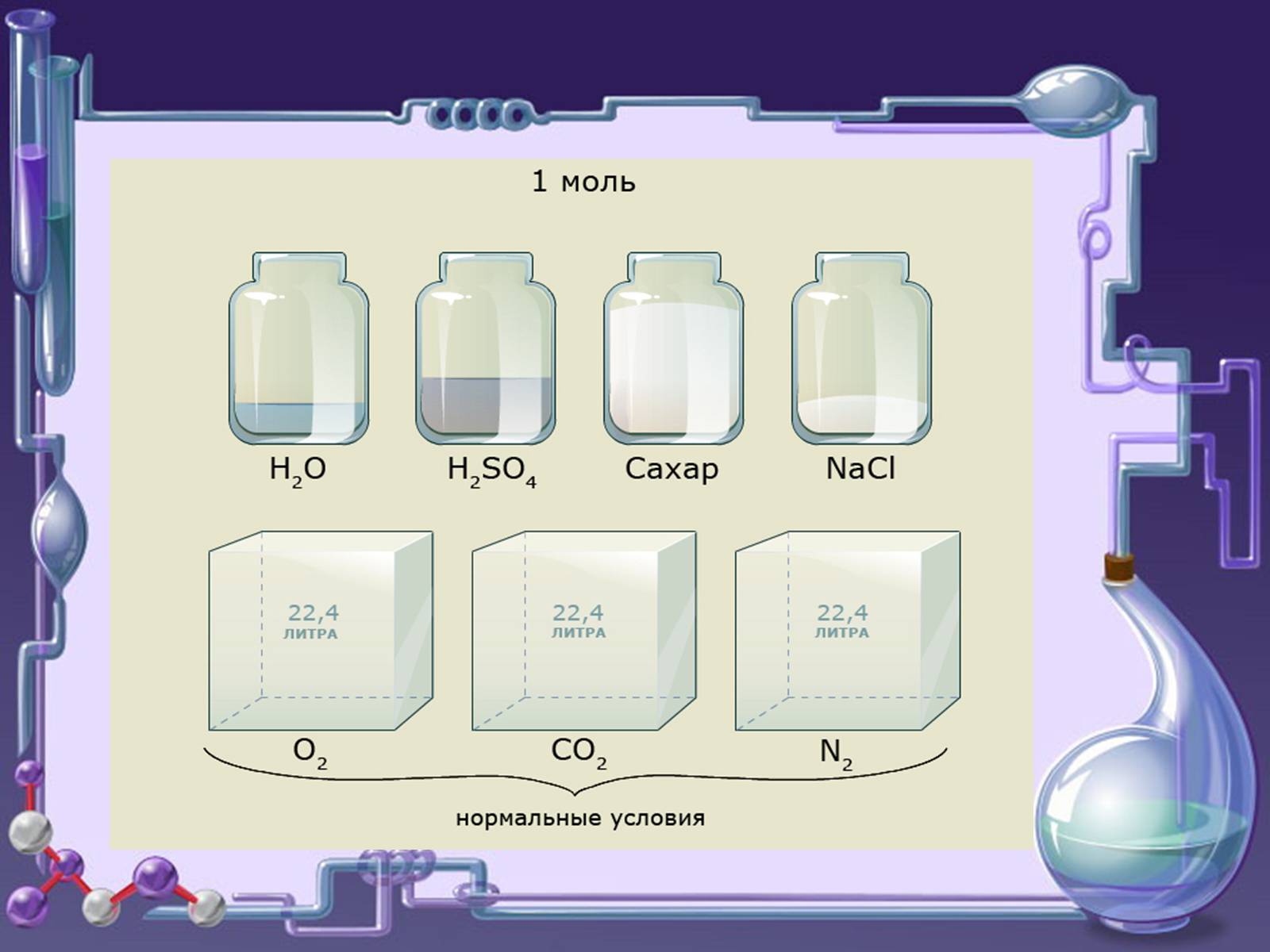
Молярний об'єм. Закон Авогадро (1811 г.)
Молярний об'єм -
фізична величина,
яка
Показує об'єм, який займає
будь-який газ кількістю речовини 1 моль
Поозначаєтся Vm
Вимірюється л/моль
В рівних об'ємах різних газів при однакових умовах міститься
однакове число молекул - закон Авогадро
Нормальні умови (н.у.) - температура О ° С і тиск 1атм (101,325 кПа)
При н.у. Vm = 22,4 л / моль

Відносна густина газів -
фізична величина,
яка
Показує, у скільки разів 1 моль
одного газу важче або легше 1молю
іншого газу
Позначається D
Безрозмірна величина
Відносна густина газів

Відношення маси певного об'єму одного газу до маси такого ж об'єму іншого газу, взятого при тих же умовах, називається відносною густиною газів
Одне і те ж число молекул різних газів при однакових умовах займає однакові об'єми.
При н.у. 1 моль будь-якого газу займає об'єм 22,4 л.

о
Закон об'ємних співвідношень
Вимірюючи об'єми газів, в результаті реакцій Ж.Л. Гей-Люссак
відкрив закон газових (об'ємних) співвідношень :
Ж.Л. Гей-Люссак
1808
«При постійному тиску і температурі об'єми газів,що вступають в реакцію, відносяться один до одного як невеликі прості цілі числа»

Химическая реакция
Отношение объемов газов
Н2+Cl22HCl
1:1:2
2CH4C2H2+3H2
2:1:3
2C+O22CO
1:2
Напрклад
Хімічна реакція
Співвідношення об'ємів газів
Н2+F22HF
1:1:2
2CH4C2H2+3H2
2:1:3
2C+O22CO
1:2

Закон об'ємних співвідношень дозволив італійському вченому А. Авогадро припустити, що молекули простих газів складаються з двох однакових атомів (Н2, N2, Cl2, О2, F2 ...)
Всього лише вісім елементів у природі існують у вигляді двохатомних молекул : H2; N2 ; O2.
И всі галогени: F2 ; Cl2 ; Br2 ; I2 ; At2.
Молекула азоту має такий вид:

Де n- кількість речовини(моль)
Рівняння зв'язку

Задачи (закрепление)
Найдите число молекул в 2 молях водорода.
Найдите массу 3 моль углекислого газа (СО2 )
Рассчитайте массу 112 л водорода (н.у.)
Что тяжелее: 2 моль СО2 или 2 моль СаО ?
Найдите количество вещества серной кислоты (H2SO4) массой 4,9 г
Какой объем займет сернистый газ (SO2) , масса которого равна 3,2 г?