Презентація на тему «Неметалічні елементи» (варіант 1)

Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і Карбону.
Презентацію виконала:
Учениця 10-А класу
Школи 1-3 ступенів №90
Чумакова Ірина

Атоми хімічних елементів сполучаються між собою, утворюючи всю різноманітність речовин, або хімічних сполук.
Усі речовини вважаються хімічними сполуками, оскільки атоми, з яких вони складаються, утримуються один з одним хімічними зв'язками.

Речовини
Речовина— вид матерії, яка на відміну від поля, характеризується масою.
Речовина складається з елементарних частинок із масою найчастіше — з електронів, протонів та нейтронів, які утворюють атоми і молекули
Вся різноманітність фізичних та хімічних властивостей речовин зумовлюється взаємодією між електронами та атомними ядрами, а також між атомами, молекулами, йонами.
Вилучення речовин
Речовини поділяють на прості й складні.
Прості речовини – форма існування хімічних елементів у вільному стані.
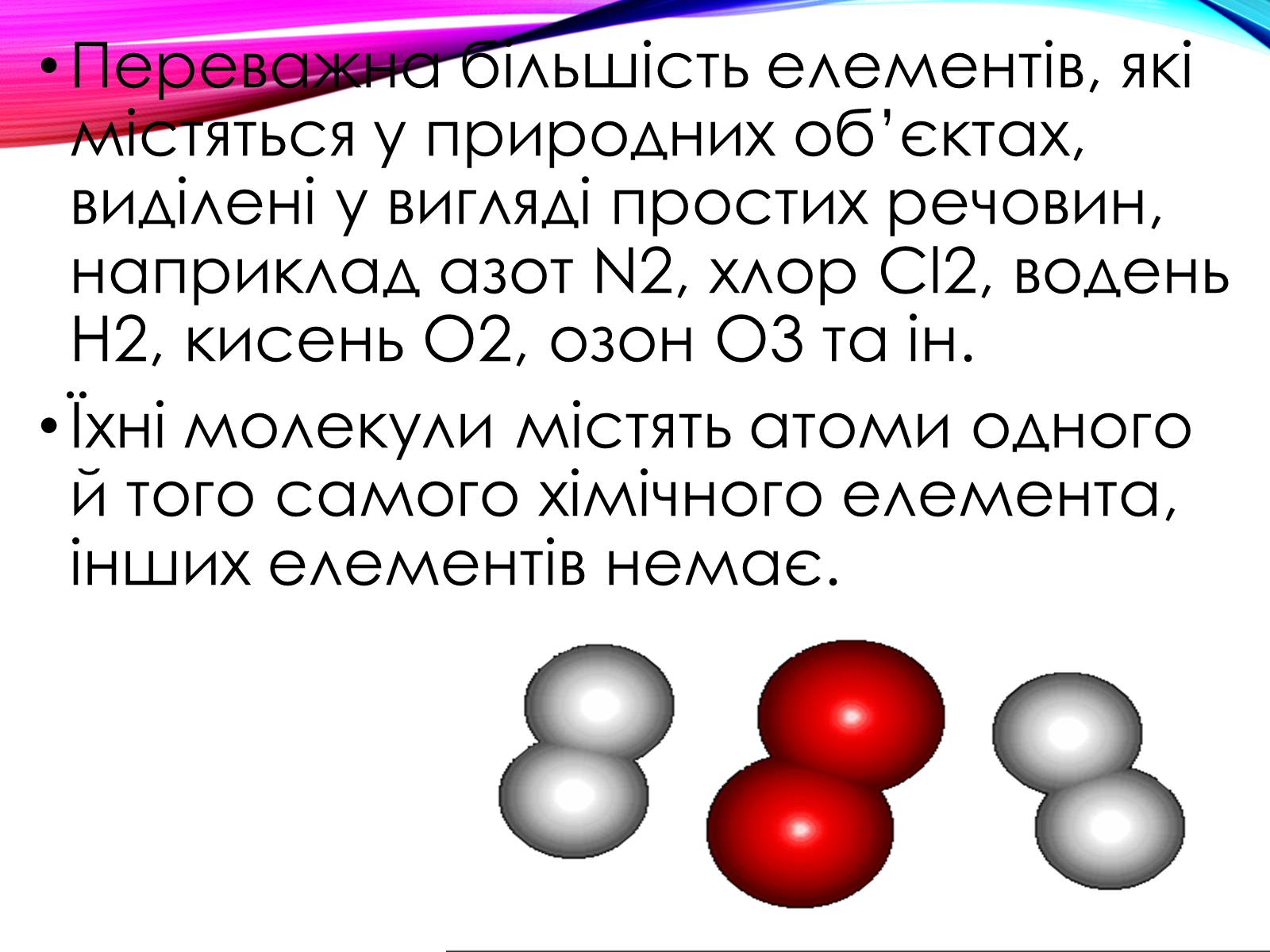
Переважна більшість елементів, які містяться у природних об'єктах, виділені у вигляді простих речовин, наприклад азот N2, хлор Cl2, водень Н2, кисень О2, озон О3 та ін.
Їхні молекули містять атоми одного й того самого хімічного елемента, інших елементів немає.
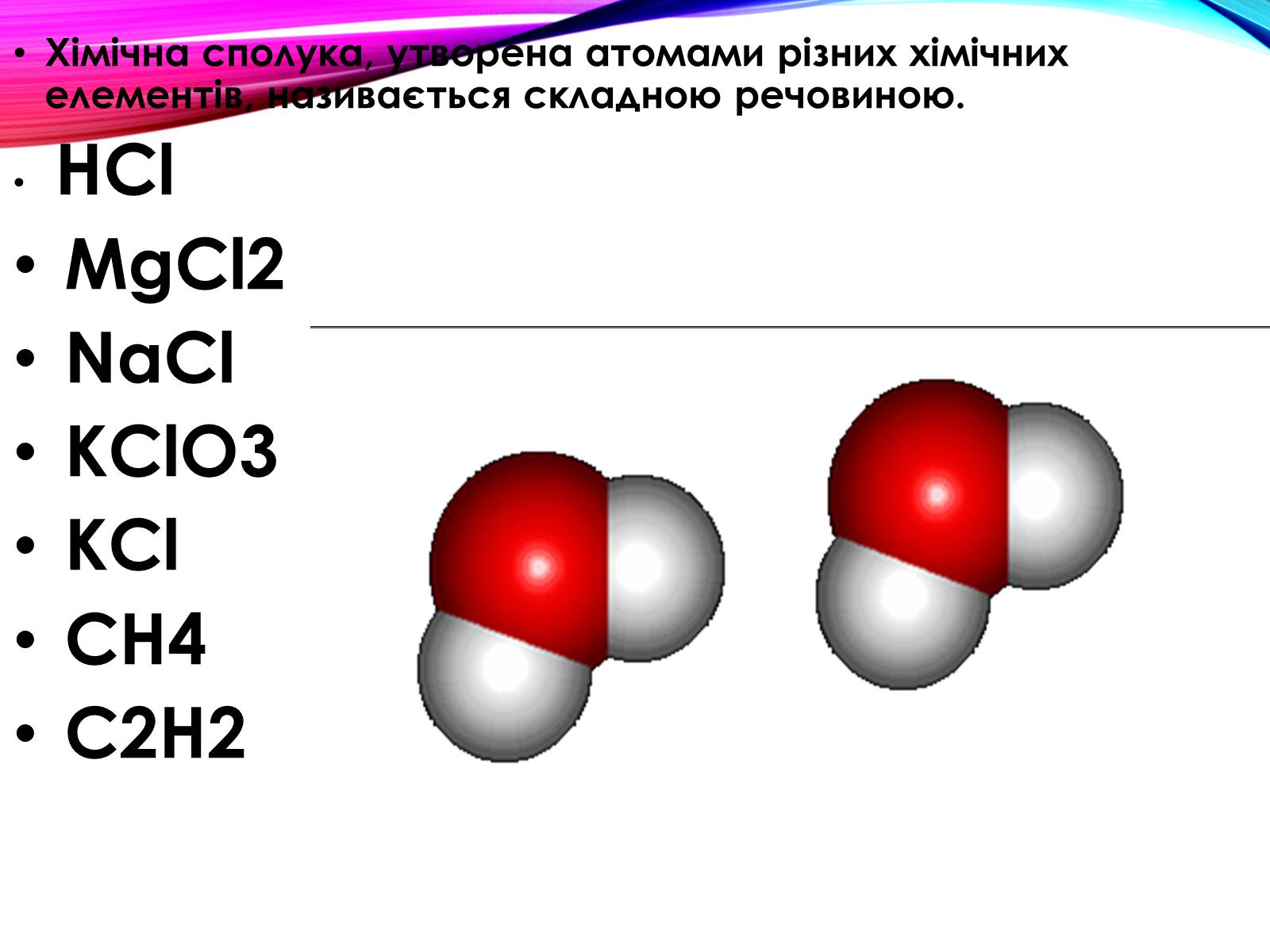
Хімічна сполука, утворена атомами різних хімічних елементів, називається складною речовиною.
HCl
MgCl2
NaCl
KClO3
KCl
CH4
C2H2
Прості речовини поділяють на:
метали (натрій Na, цинк Zn, барій Ва, магній Mg)
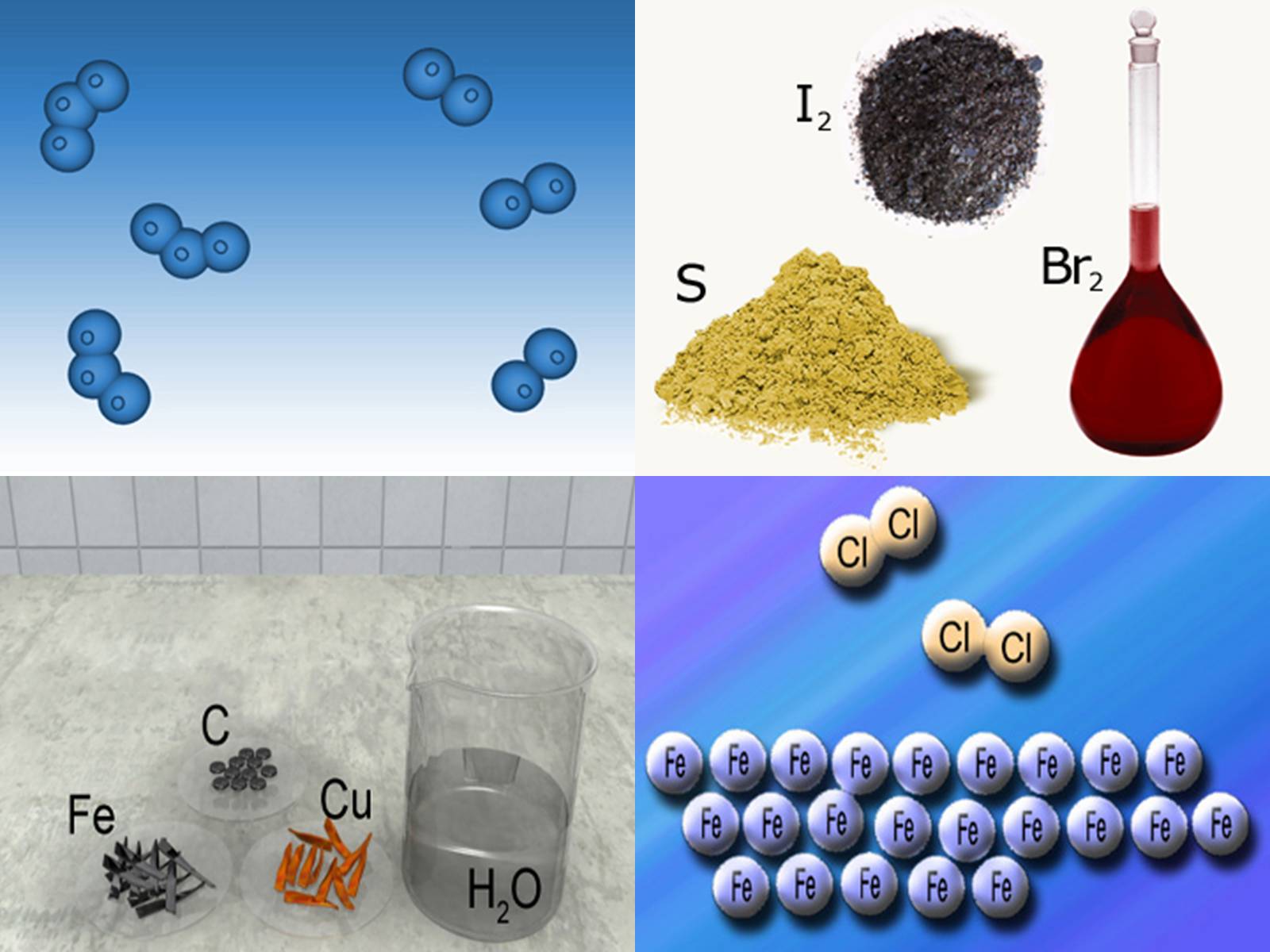
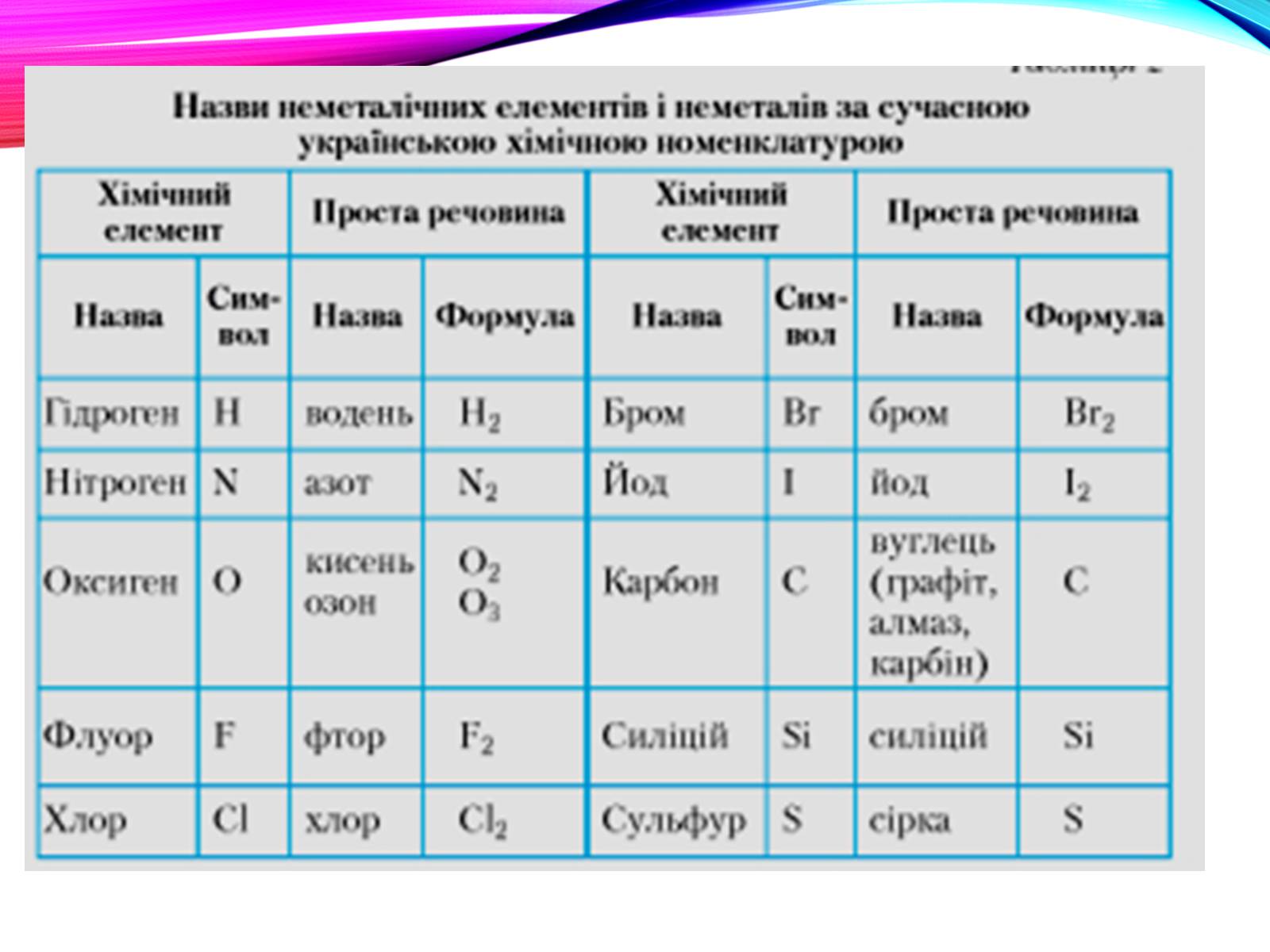
неметали (сірка S, фосфор Р, йод І2, бром Br2).
Прості речовини поділяють на:
метали (натрій Na, цинк Zn, барій Ва, магній Mg)
неметали (сірка S, фосфор Р, йод І2, бром Br2).
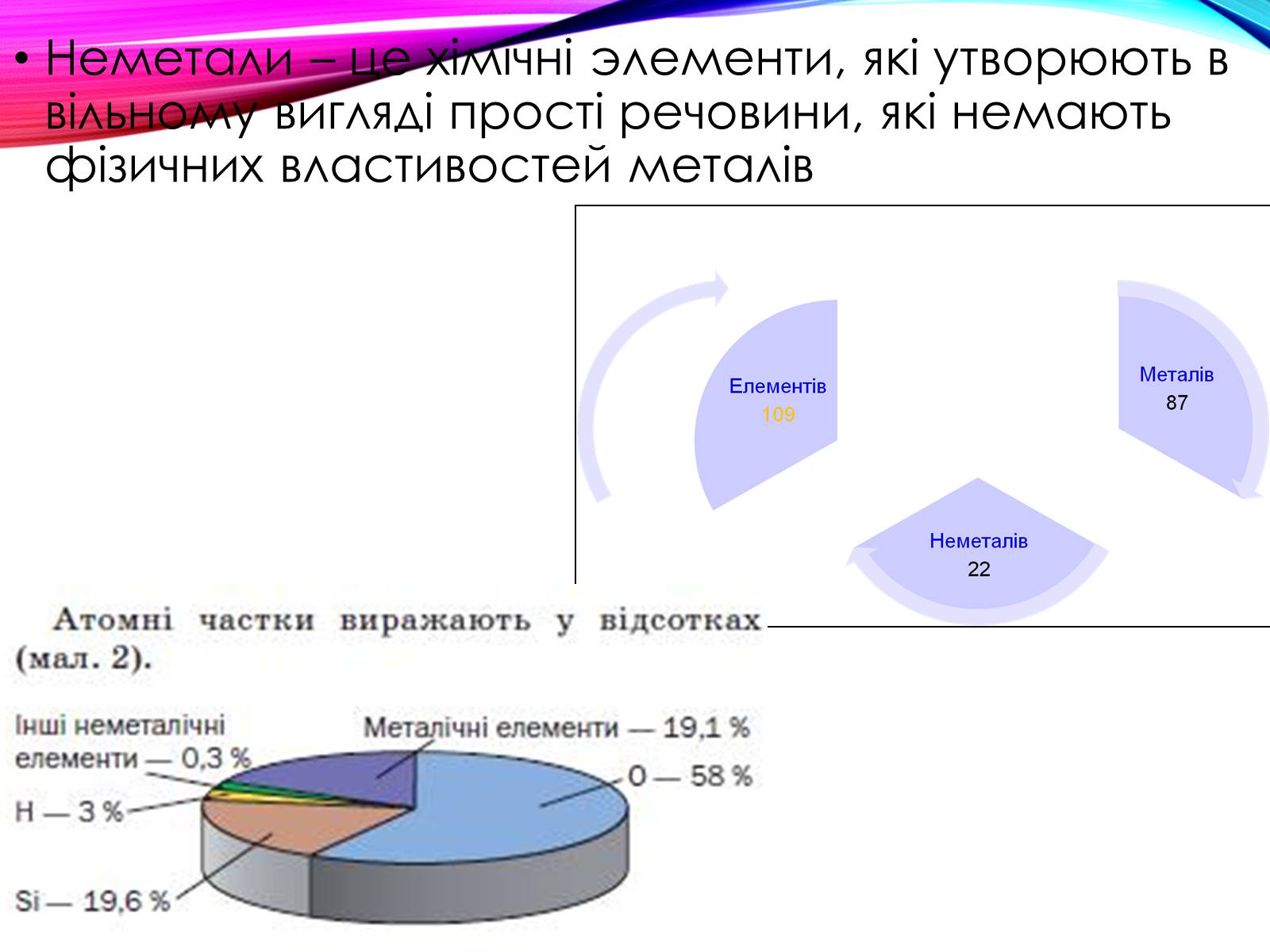
Неметали – це хімічні элементи, які утворюють в вільному вигляді прості речовини, які немають фізичних властивостей металів

Неметали
Неметали – прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для кування, погано проводять тепло, електричний струм.
У хімічних реакціях атоми неметалів, як правило, одержують електрони.
До типових неметалів зараховують 22 елементи: водень (гідроґен), азот, кисень (оксиґен), флуор, хлор, інертні гази, бром, карбон, фосфор, сулфур, селен, йод, астат, телур, бор.
Типові оксиди неметалів є ангідридами.
Різкої межі між металами, металоїдами та неметалами немає.

Неметали

Властивості неметалів
Неметали можуть мати як молекулярну, так і немолекулярну структури.
Вони погано проводять теплоту й електричний струм, крихкі, мають різний колір.
Так, фосфор червоного кольору, сірка — жовтого, графіт — чорного, водень — безбарвний газ.

Сірка
Фосфор
Углерод
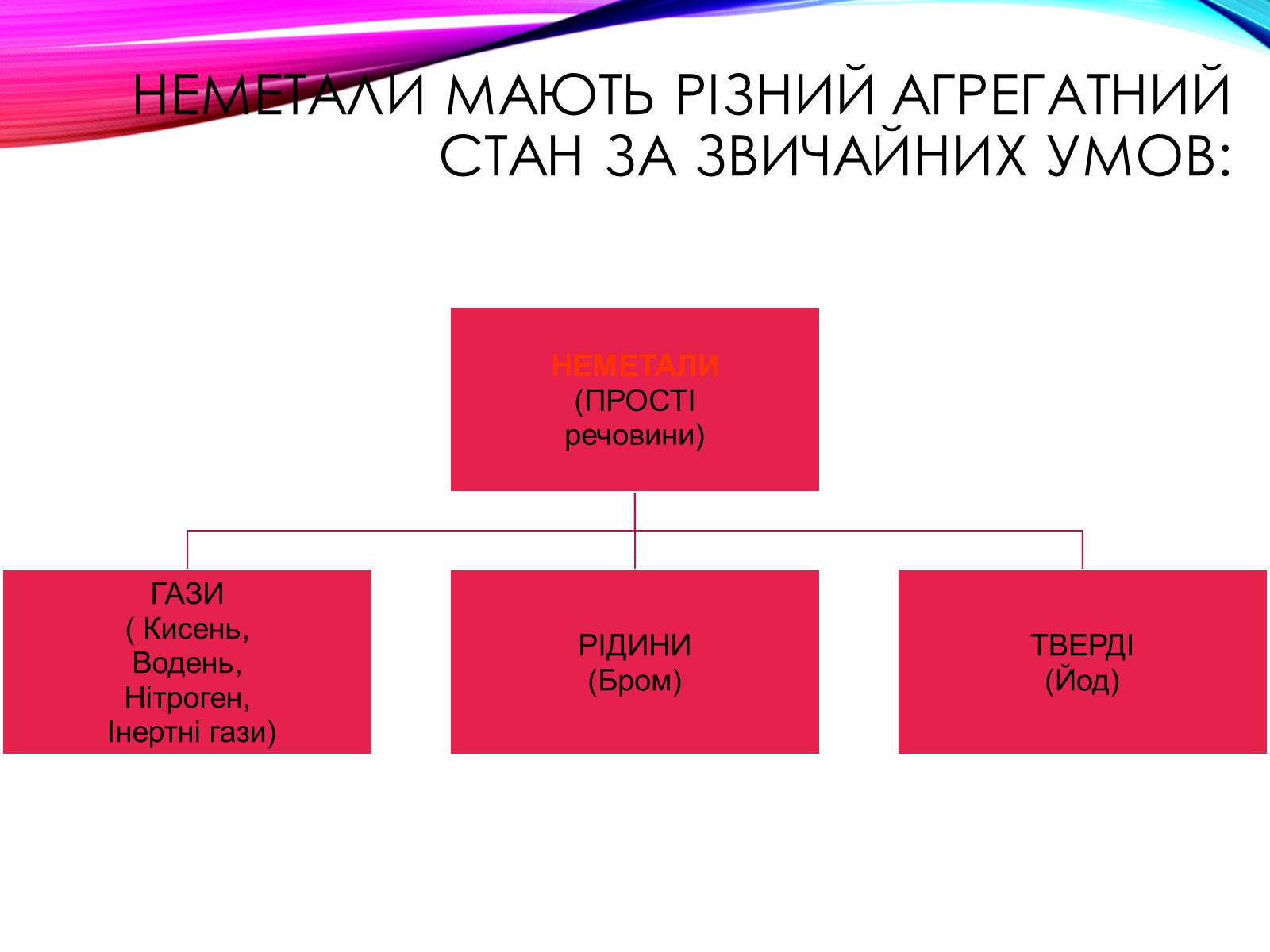
Неметали мають різний агрегатний стан за звичайних умов:

Азот
Сіліцій
Бром
гелій
Азот
Сіліцій
Бром
гелій

Положення неметалів в ПС
Неметали розташовані в основному в правому верхньому куті ПС, умовно обмеженому діагоналлю бор-Астат. Найактивнішим є флуор.
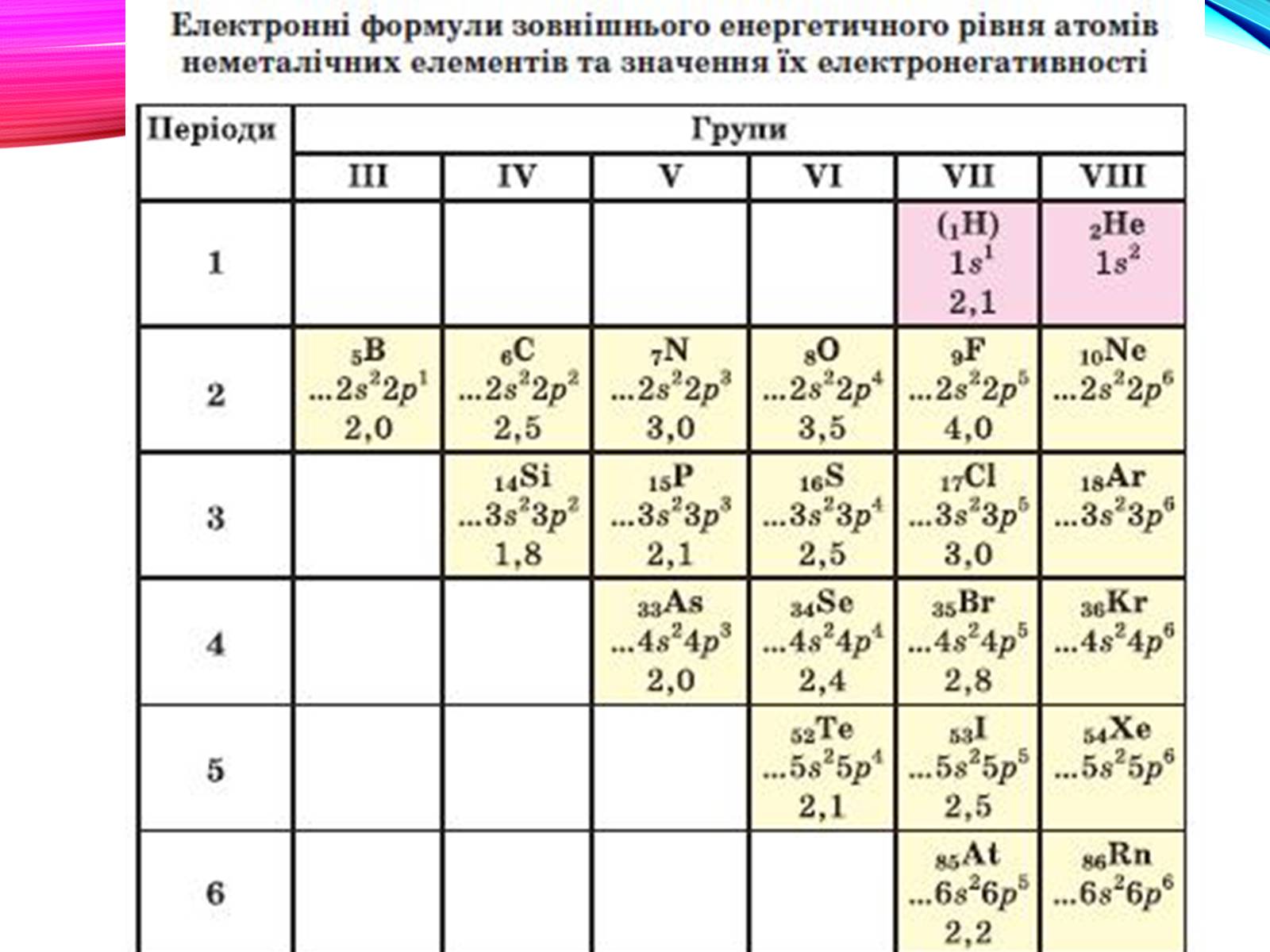
Положення неметалів в ПС
Неметали розташовані в основному в правому верхньому куті ПС, умовно обмеженому діагоналлю бор-Астат. Найактивнішим є флуор.

Особливості будови атомів неметалів.
Атоми неметалічних елементів на зовнішньому енергетичному рівні мають, як правило, від 4 до 8 електронів.
Майже всі вони можуть приєднувати певну кількість електронів і перетворюватися на негативно заряджені йони — аніони .
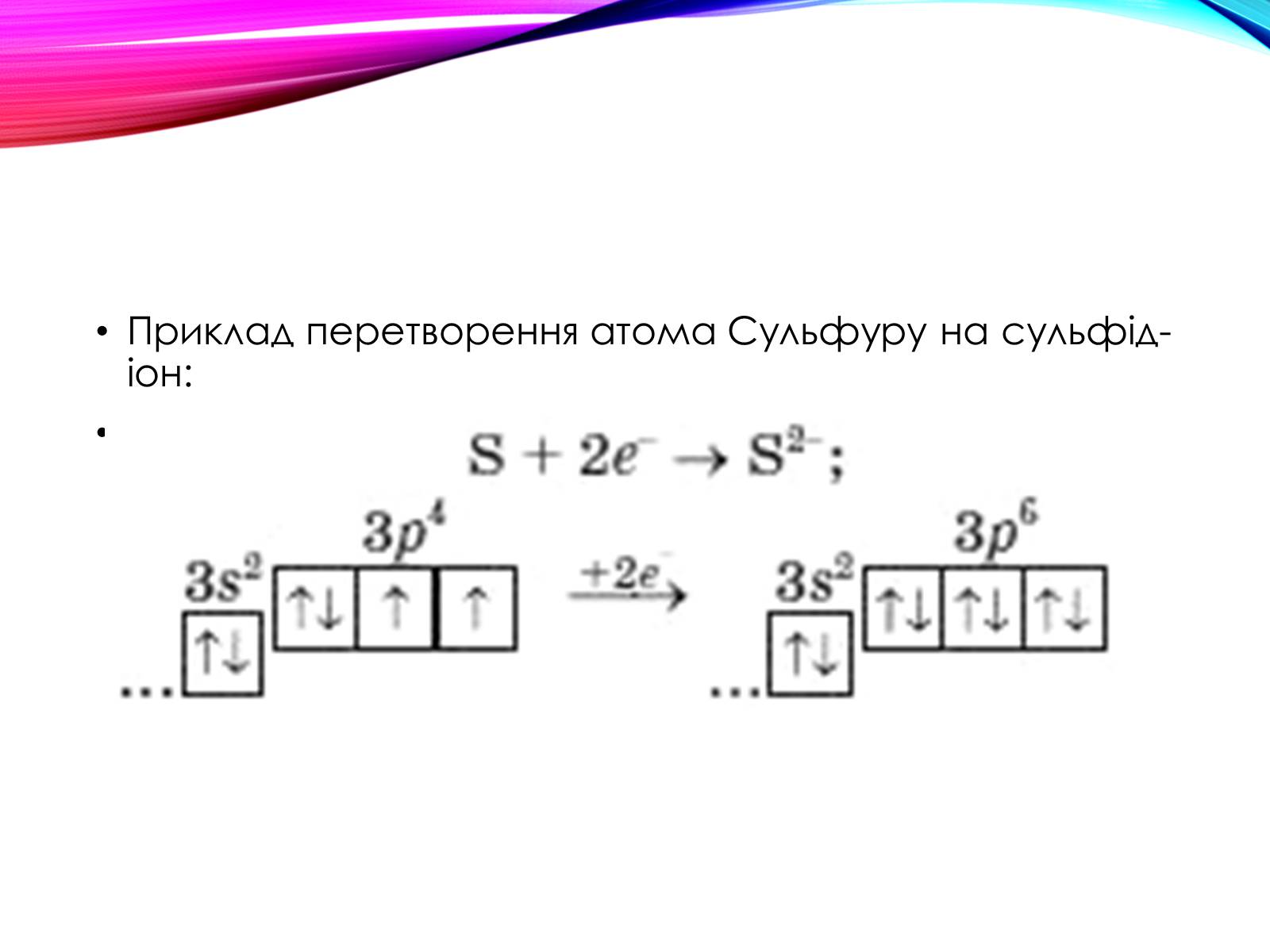
Приклад перетворення атома Сульфуру на сульфід-іон:

Елементи - неметали більш здатні, в порівнянні з металами, до Алотропії.
Здатність атомів одного хімічного елемента утворювати кілька простих речовин називається Алотропія, а ці прості речовини - алотропні видозміни або модифікаціями.
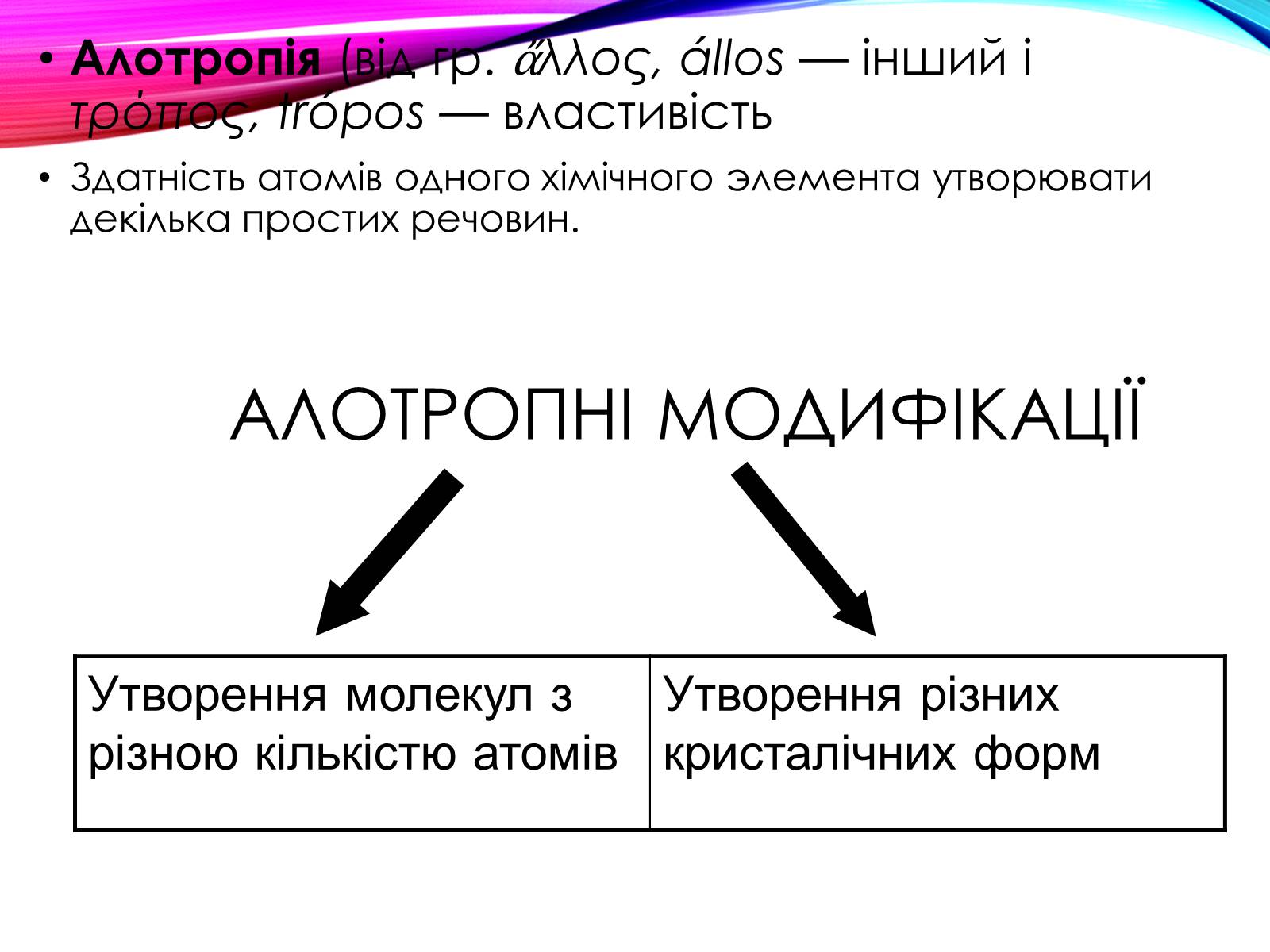
Алотропні модифікації
Утворення молекул з різною кількістю атомів
Утворення різних кристалічних форм
Алотропія (від гр. ἄλλος, állos — інший і τρόπος, trópos — властивість
Здатність атомів одного хімічного элемента утворювати декілька простих речовин.

Поширення в природі.
Оксиген – найпоширеніший елемент у природі. Входить до складу води, багатьох мінералів і гірських порід, а також органічних речовин і живих організмів. Половина маси земної кори припадає на Оксиген. Оксиген утворює дві алотропні модифікації – кисень O2 та озон O3 .
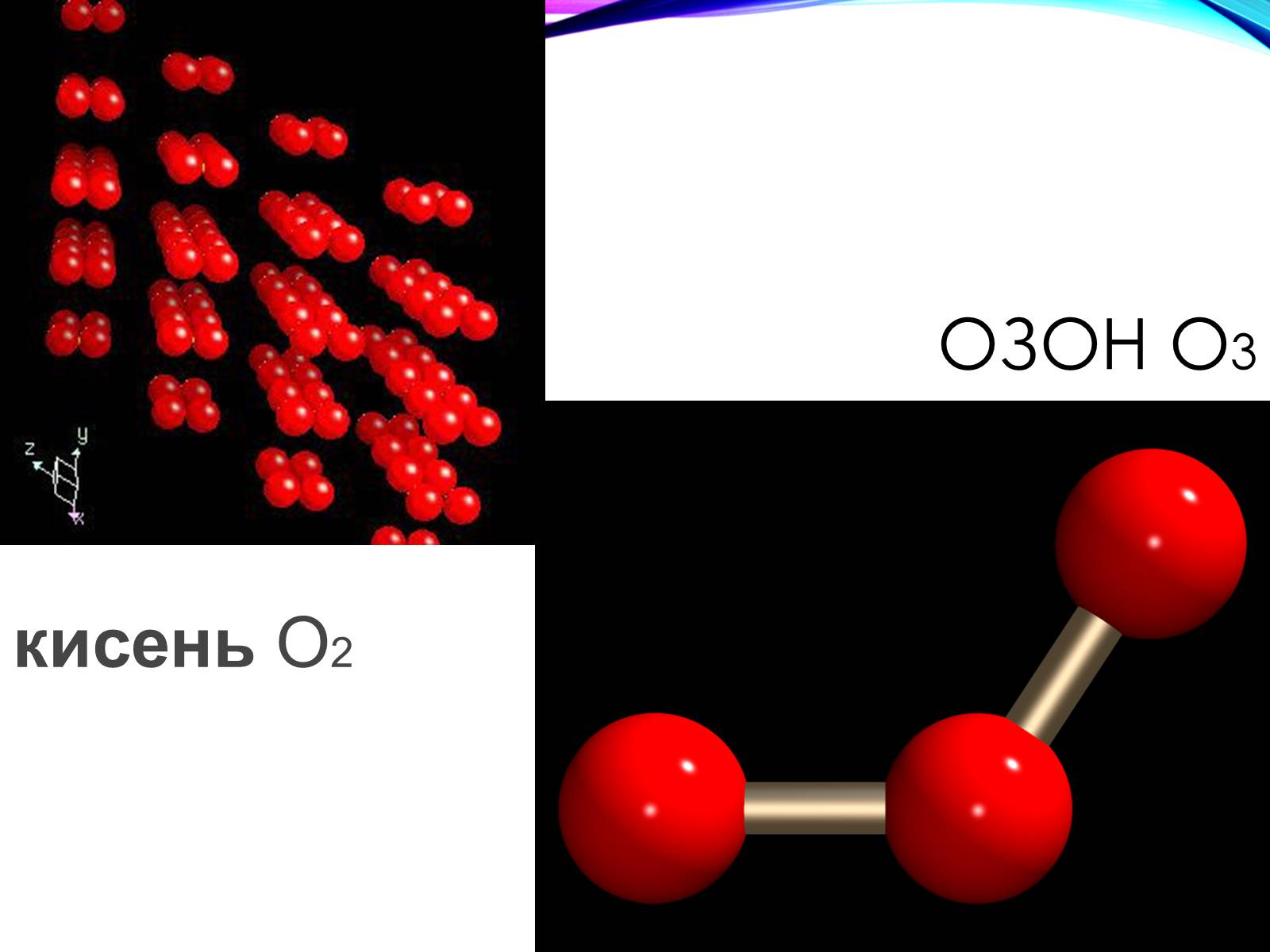
озон O3
кисень O2
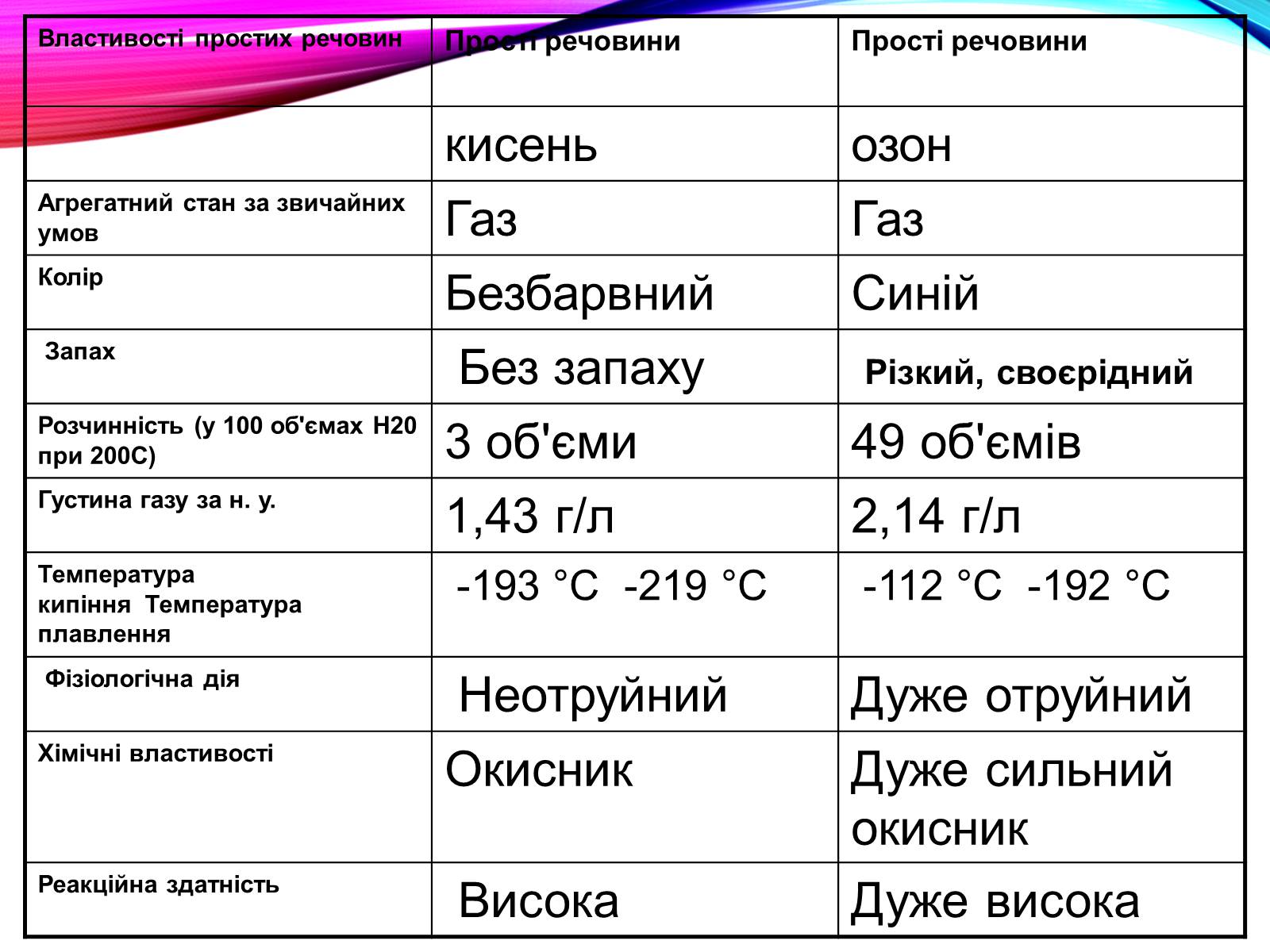
Властивості простих речовин
Прості речовини
Прості речовини
кисень
озон
Агрегатний стан за звичайних умов
Газ
Газ
Колір
Безбарвний
Синій
Запах
Без запаху
Різкий, своєрідний
Розчинність (у 100 об'ємах Н20 при 200С)
3 об'єми
49 об'ємів
Густина газу за н. у.
1,43 г/л
2,14 г/л
Температура кипіння Температура плавлення
-193 °С -219 °С
-112 °С -192 °С
Фізіологічна дія
Неотруйний
Дуже отруйний
Хімічні властивості
Окисник
Дуже сильний окисник
Реакційна здатність
Висока
Дуже висока

Фізичні властивості.
Озон – газ синього кольору із своєрідним різким запахом, розчинність у воді майже в 7 разів вища, ніж у кисню. Отруйний навіть у малих концентраціях.
Озон – дуже сильний окисник. Він дуже активний. Це пояснюється тим, що озон – нестійка сполука, він легко розкладається з утворенням атомів Оксигену:

Озон можна добути в лабораторії

Поширення в природі
Озон присутній в атмосфері Землі.
Біля поверхні Землі озону мало.
Його концентрація у повітрі коливається – вночі менша, вдень – більша.
Влітку й навесні озону в повітрі у 3,5 рази більше, ніж узимку і восени.
Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст – вищий, ніж у сільській місцевості.
З віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 - 25 км.
Там утворюється так званий озоновий шар.
Він забезпечує збереження життя на Землі, оскільки затримує найбільш згубну для живих організмів частину ультрафіолетової радіації Сонця, що спричинює онкологічні (ракові) захворювання. Крім того озон так само, як і вуглекислий газ, поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню.

Над Україною (окрім південної частини) загальний вміст озону за останні 20 років зменшився на 6 %, і утворилася аномальна зона.
Вам про це слід пам'ятати! Особливо небезпечна «озонова дірка» влітку.
У цей період дуже потерпають очі, тому треба користуватися сонцезахисними окулярами.
Варто утримуватися і від загару, щоб не зашкодити шкірі.

Все це - чистий карбон
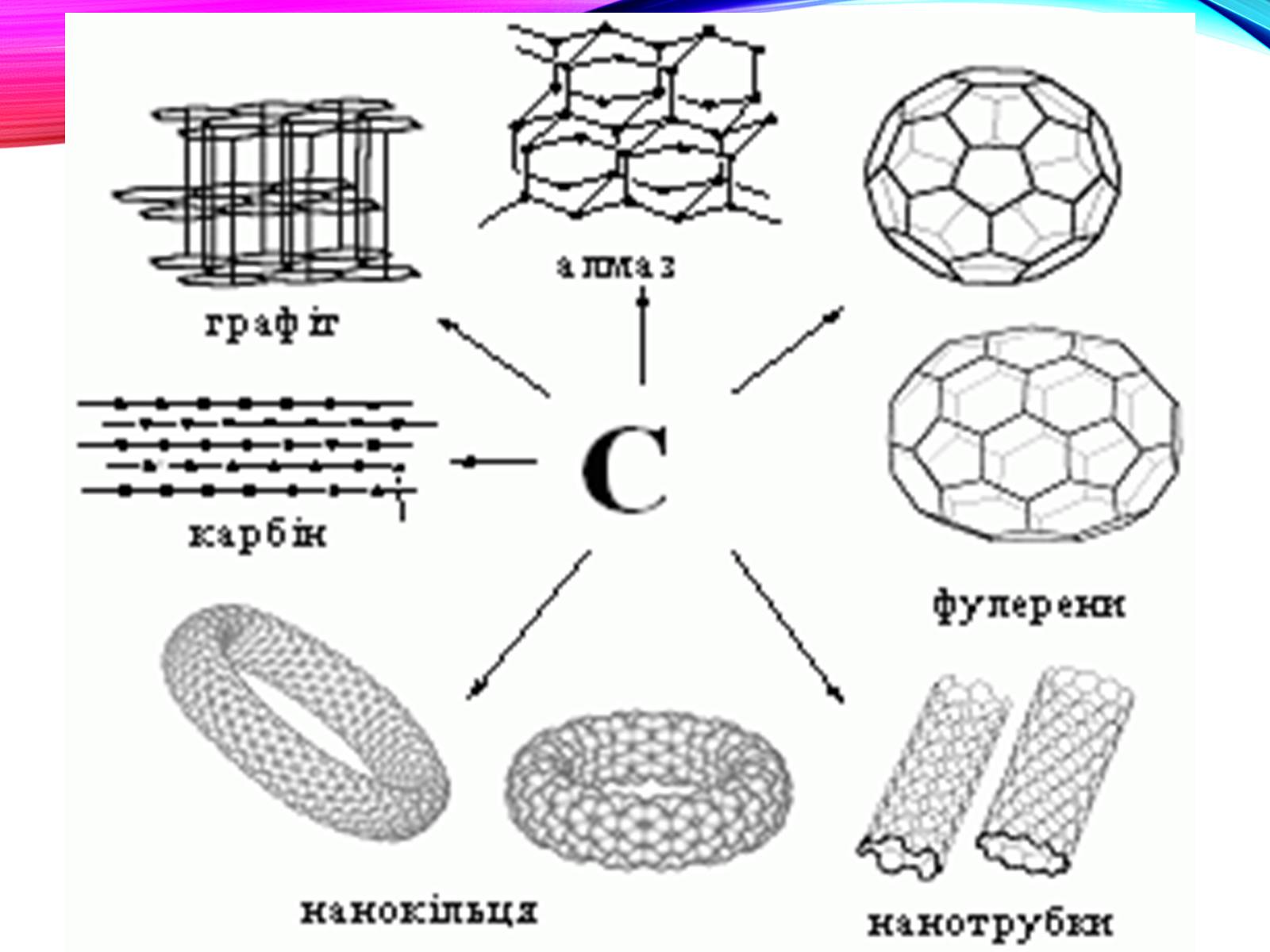
Все це - чистий карбон
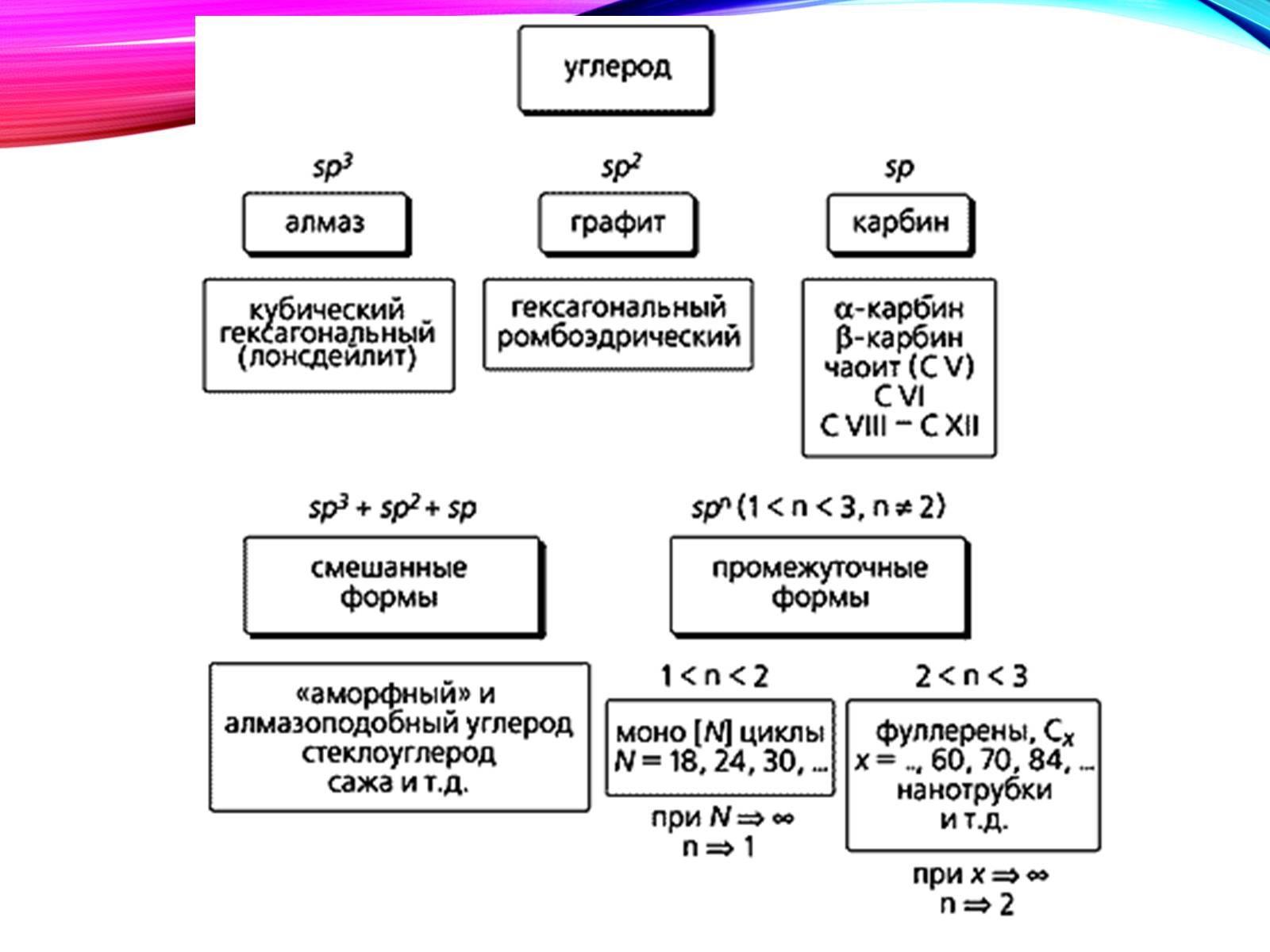
Все це - чистий карбон

Дві основні різновиди вуглецю - графіт і алмаз - істотно відрізняються за властивостями.
М'який графіт має шаруваті будову

Структура алмазу типово тетраедріческая; атоми вуглецю міцно з'єднані за рахунок перекриття sp3-орбіталей.

Фізичні властивості алмазу і графіту.
Алмаз
Прозорий, безбарвний.
Не проводить електричний струм, оскільки немає вільних електронів.
Самий твердий з природних речовин.
Графіт
Непрозорий, сірого кольору з металевим блиском.
Досить добре проводить електричний струм, завдяки наявності рухомих електронів.
Слизький на дотик.
Один з найбільш м'яких серед твердих речовин.

Висновок:
Неметали здатні до дій протилежних: як правило, вони можуть набувати електрони, але можуть їх і віддавати.
Тільки фтор і кисень не знають компромісів — вони беруть електрони і ніколи не віддають їх.
А метали значно менш «дипломатичні», постійніші в своїх прагненнях. Девіз, якого вони неухильно додержуються: віддавати і тільки віддавати свої електрони і ставати при цьому позитивно зарядженими іонами.
Різкої межі між металами й неметалами немає.
Деякі неметали виявляють металічні властивості, а метали — неметалічні.