Презентація на тему «Оксиди» (варіант 3)

План:
Основні відомості
Формули оксидів
Назви оксидів
Класифікація
Фізичні властивості
Хімічні властивості основних оксидів
Хімічні властивості кислотних оксидів
Добування
Використання
Оксиди

Основні відомості:
Оксиди – це складні речовини, утворені двома елементами, одним з яких обов'язково є Оксиген.

Еn Оm
Де Е-елемент,n,m-валентність
Формули оксидів:

Назви оксидів:
Назва елементу
+
Валентність,якщо змінна
+
Слово “оксид”
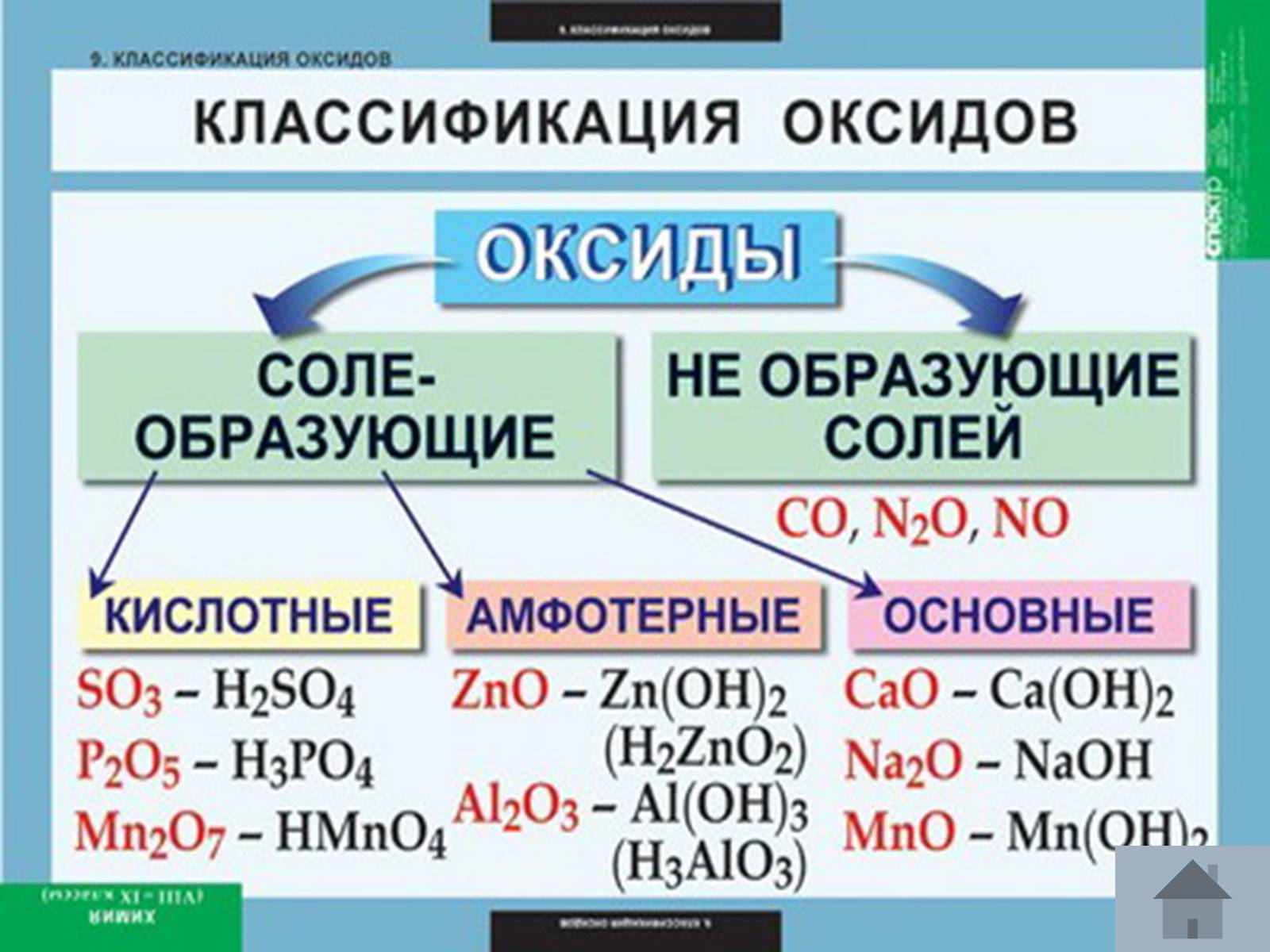
Класифікація:
Са3(РО4)2,ZnSO4,Na2СО3
Класифікація:

Виділяють декілька основних фізичних властивостей оксидів:
1) Всі основні й амфотерні оксиди не мають запаху;
2) Оксиди можуть бути різного кольору. Наприклад:a. ZnO, MgO – білий;
b. CuO – чорний;
3) Окремі кислотні оксиди є твердими (P2O5, SiO2 і ін.);
4) Виділяють декілька газоподібних кислотних оксидів (CO2, SO2 і ін.)
Фізичні властивості:

оксид алюмінію
оксид хрому
оксид купруму
оксид цинку

Хімічні властивості основних оксидів:
1.Взаємодія з водою
Основний оксид+вода=основа
2.Взаємодія з кислотою
Основний оксид+кислота=сіль+вода
3.Взаємодія з кислотним оксидом
Основний оксид+кислотний оксид=сіль

Хімічні властивості кислотних оксидів:
1.Взаємодія з водою
Кислотний оксид+вода=кислота
2.Взаємодія з основами
Кислотний оксид+основа=сіль+вода
3.Взаємодія з основним оксидом
Основний оксид+кислотний оксид=сіль

Добування:
Оксиди можна одержувати різними способами.
Безпосереднім сполученням елементів з киснем:
2 Zn + O2 = 2ZnO
4Р + 5О2 = 2Р2О5
Окисленням різних сполук киснем:
СН4 + 2О2 = СО2 + 2Н2О
2Н2S + 3О2 = 2SO2 + 2Н2О
Розкладом гідроксидів при нагріванні:
Ca(ОН)2 = СаО + Н2О
2Fe(ОН)3 = Fe2О3 + 3Н2О
Розкладом солей кисневих кислот при нагріванні:
CaCO3 = CaO + СО2
Cu2(ОН)2СО3 = CuO + СО2 + Н2О

Використання:
Оксиди багатьох елементів дуже поширені в природі. Як ти гадаєш, чому?
Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем).
Майже чистим кремнеземом є гірський кришталь.
Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів.
З руд, які містять алюміній оксид Al2O3, виплавляють алюміній.
Звичайний наждак – це також алюміній оксид з домішками.
Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір).
Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд (Криворізьке та Керченське родовища).
До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об'ємна частка якого в повітрі становить 0,3 %.
Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).

Для отримання скла складають шихту-суміш соди Na2CO3 (іноді сульфату натрію з вугіллям), вапняку CaCO3, кварцового піску, що містить 97-99,8% SiO2, і різних добавок. шихту поміщають в спеціальні печі і сплавляють, поступово підвищуючи температуру до 1460-1500 градусів.

Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті.
Багато води перебуває у газуватому стані в атмосфері. У вигляді великих мас снігу і криги лежить вода цілорічно на вершинах високих гір і в полярних країнах. У надрах Землі також є вода, що просочує грунт і гірські породи. Воді належить найважливіша роль у геологічній історії нашої планети.
Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3.
У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.