Презентація на тему «Кислоти» (варіант 2)

План:
Кислоти
Основі відомості
Формула
Назви кислот
Класифікація
Фізичні властивості
Хімічні властивості
Способи добування
Використання в природі
Кислоти в організмі людини
Кислоти в їжі
Кислоти в рослинному світі
Кислоти в тваринному світі
Кислотні дощі

Основні відомості:
Кислоти, у класичному визначенні — електроліти, які при розчиненні в йонізуючому розчиннику (воді), дисоціюють з утворенням йонів водню (або протону, Н+), таким чином знижуючи кислотність розчину до величини менше ніж pH 7,0.
HCL = H++CL-

Формула:
Нn(зал)m
Н-водень,n- к-сть молекул,(зал)-кислотний залишок

Назви кислот:
HNO3 — нітратна кислота (азотна)
Н2SO4 — сульфатна кислота (сірчана)
Н3РО4 — ортофосфатна кислота(фосфорна)
НРО3 — метафосфатна кислота
Н2СО3 — карбонатна кислота (вугільна)
Н3ВО3 — боратна кислота (борна)
HNO2 — нітритна кислота (азотиста)
Н2SO3 — сульфітна кислота (сірчиста)
HCl — хлоридна кислота (хлороводнева, або соляна)
HI — йодидна кислота (йодоводнева)
HBr — бромідна кислота (бромоводнева)
H2S — сульфідна кислота(сірководнева)
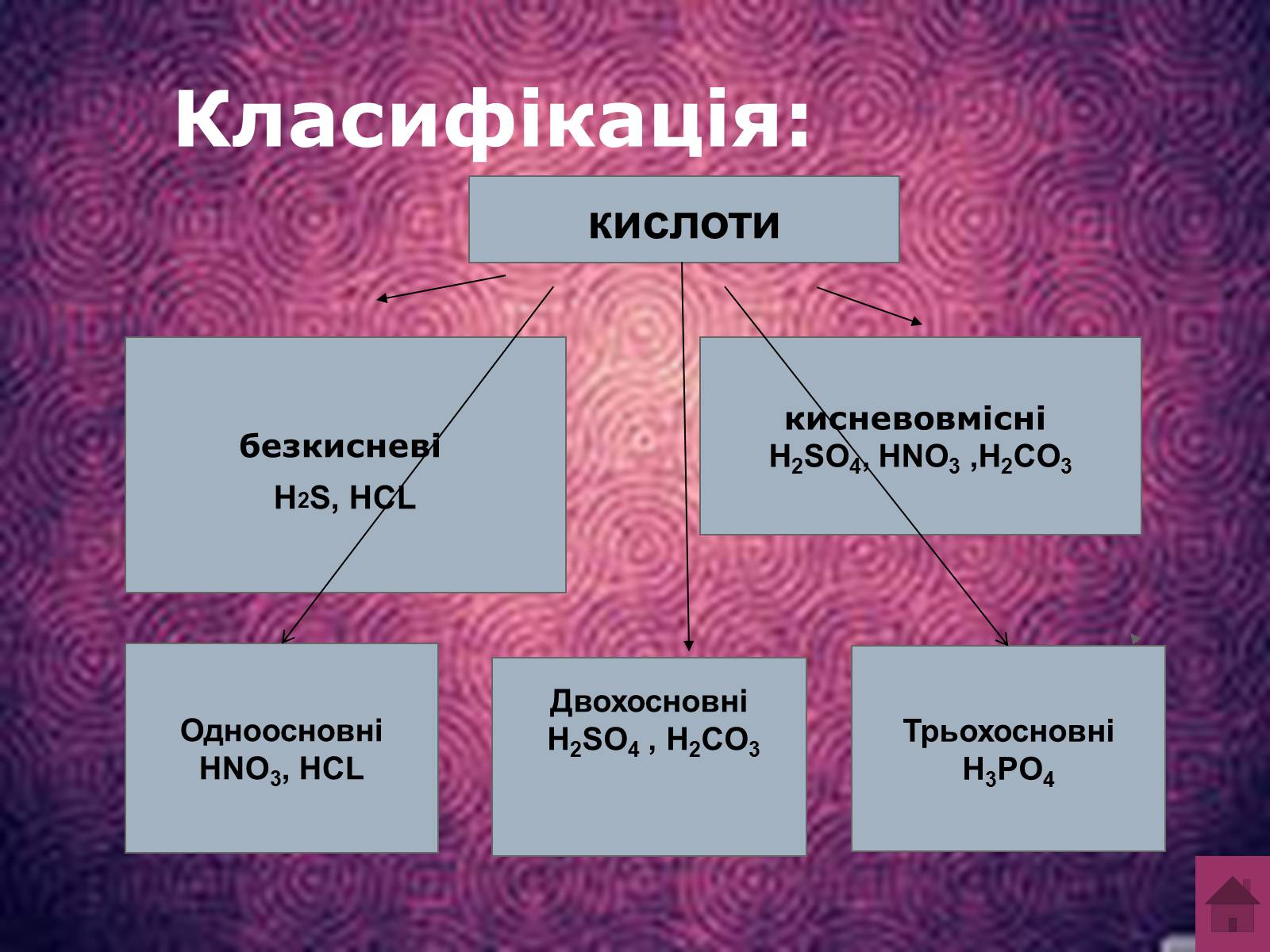
Класифікація:
кислоти
безкисневі
H2S, HCL
кисневовмісні
H2SO4, HNO3 ,H2CO3
Одноосновні
HNO3, HCL
Двохосновні
H2SO4 , H2CO3
Трьохосновні
H3PO4

За стандартних умов багато кислот — рідини (H2S04, HN03), але є й тверді кислоти — ортофосфатна Н3Р04, метафосфатна НРОз, силікатна (драглиста маса) H2Si03. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN03), вони мають задушливий запах. Майже всі кислоти безбарвні.Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту.
Фізичні властивості:

Хімічні властивості:
1.Взаємодія кислоти з металами
Кислота+метал№1=метал№2+сіль
2.Взаємодія кислоти з оксидом
Кислота+оксид=сіль+водень
3.взаємодія кислоти з сіллю
Кислота№1+сіль№1=кислота№2+сіль№2

Багато оксигеновмісних кислот можна добути взаємодією кислотних оксидів з водою, наприклад:SO3 + Н2O = H2SO4N2O5 + Н2O = 2HNO3Але ти пам'ятаєш, що не всі кислоти можна добути, розчинюючи відповідний оксид у воді. Так, силіцій(IV) оксид SiO2 — складова річкового піску — у воді не розчиняється. Проте і йому відповідає певна кислота — силікатна H2SiO3, тільки добувають її не з оксиду, а іншим способом:Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓Безкисневі кислоти НСl, HBr, HI, H2S добувають синтезом з водню та неметалу й наступним розчиненням водневої сполуки у воді:Н2 + Сl2 = 2НСl
Способи добування:

Використання в природі:
Кислоти постійно присутні навколо нас. Наприклад, дощова вода на перший погляд здається чистою. Насправді в ній є чимало інших речовин. За рахунок розчинення вуглекислого газу з атмосфери вона є розчином вугільної кислоти. Після літньої грози в дощовій воді виявляється ще й азотна кислота. Виверження вулканів і згоряння палива сприяють появі в дощовій і сніговий воді сірчаної кислоти.

Кислоти в організмі людини:
Аскорбінова, фолієва, оротовая, пангамовая, нікотинова і інші кислоти є вітамінами.Амінокислоти, з'єднуючись один з одним в найхимерніших поєднаннях, утворюють безліч білків. А з них, у свою чергу, будуються майже всі тканини нашого організму.Фосфорна кислота у вигляді своїх кальцієвих, магнієвих та стронцієвих солей - основний «конструкційний матеріал» кісток, зубів, нігтів.

Чимало кислот в нашій їжі. Фрукти, овочі, молочні продукти, ліки постачають цілий букет кислот: яблучну, щавлеву, лимонну, мигдалеву, молочну, масляну, кавову, оцтову, аскорбінову та інші. Навіть синильна кислота (сильна отрута) знайома кожному, хто ласував ядерця кісточок слив, вишень чи мигдалю. Кількість її мізерно, але відчути смак і запах можна. Так що ядерця захоплюватися не слід, особливо якщо вони взяті з недозрілих плодів або торішніх компотів.
Кислоти в їжі:

Багато рослин містять кислоти і використовують їх як «Хімічна зброя»Мухомори в якості отруйних токсинів «використовують» іботеновой кислоту. Ця речовина так отруйно, що Мухоморові нема чого ховатися.Однак лосі жують мухомори і не гинуть від цього. Швидше - навпаки: мухоморами вони лікують якісь свої «хвороби».Ботанікам відомо більше 800 видів рослин, що виробляють синильну кислоту.Багато рослин виділяють кислоти, пригнічуючи ними інші види рослин.У волосках кропиви міститься пекуча мурашина кислота
Кислоти в рослинному світі:

Якщо ви присяде поблизу мурашника, то надовго запам'ятаєте пекучі укуси його мешканців. Мураха впорскує в ранку від укусу отрута, що містить мурашину кислоту. Мурашиної кислотою обумовлено печіння кропиви, її виділяють деякі гусениці.Тропічний павук стріляє у ворогів цівкою рідини, що містить 84% оцтової кислоти.Плоскі тисяченожкі використовують пари синильної кислоти.Деякі жуки вистрілюють цівкою розведеної сірчаної кислоти.
Кислоти в тваринному світі:

Кисло́тний дощ — усі види метеорологічних опадів: дощ, сніг, град, туман, дощ зі снігом, — кислотність яких вища від нормальної. Мірою кислотності є значення рН (водневий показник). Нормальне pH у чистих дощах — 5,6.
Кислотні дощі: