Презентація на тему «Неметаллы»

Неметаллы
Подготовила Кулешова Ксения
Ученица 10-А класса

Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.

Нахождение в природе
N
o
2
2
s

Са5[PO4]3(F, Cl, ОН)АПАТИТ
Аметист
SiO
2
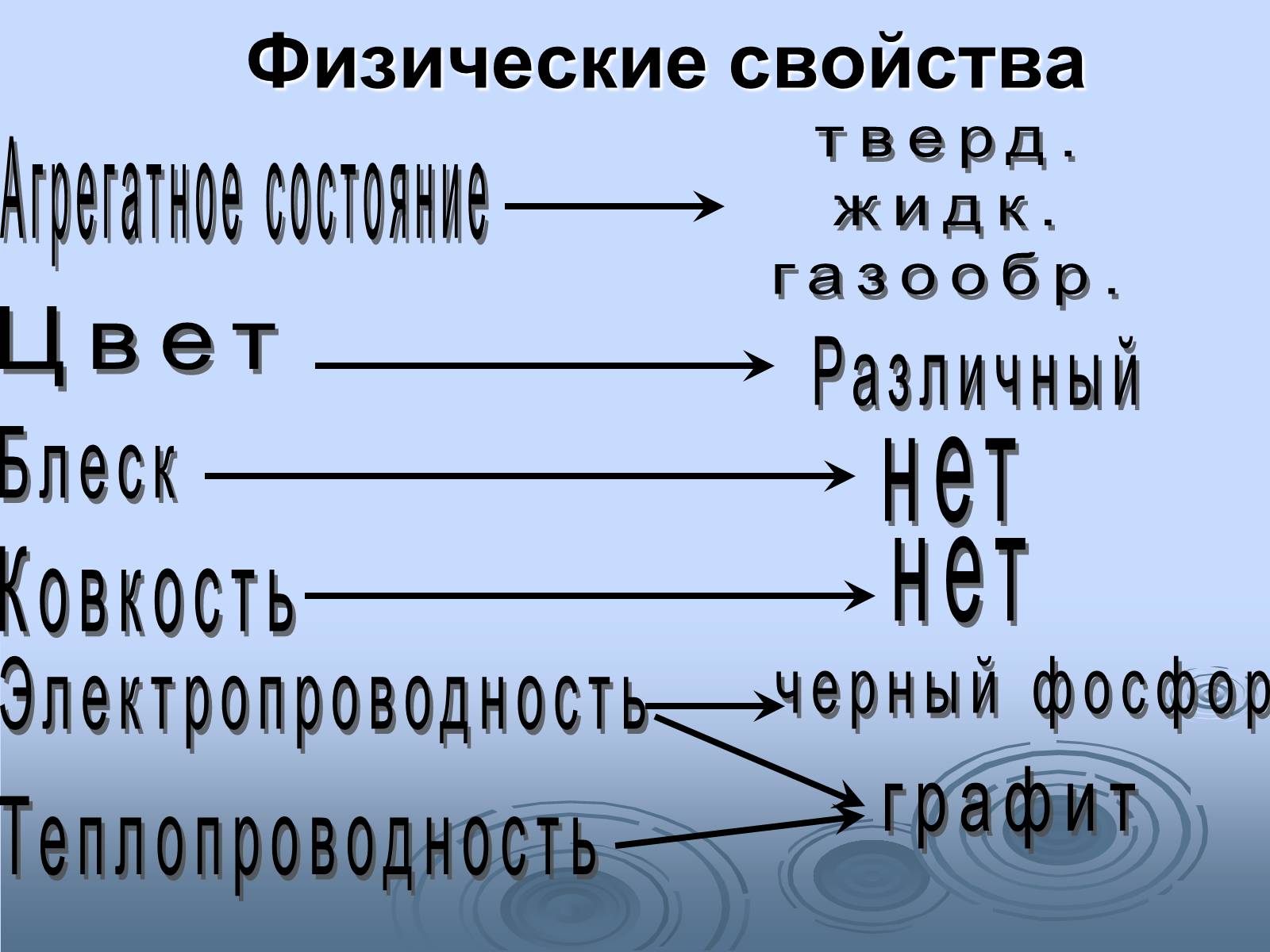
Физические свойства
Агрегатное состояние
тверд.
жидк.
газообр.
Цвет
Различный
Блеск
нет
нет
Ковкость
Электропроводность
черный фосфор
графит
Теплопроводность

Взаимодействие с металлами:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.

Взаимодействие с другими неметаллами:
взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O2 = SO2,
4P + 5O2 = 2P2O5;

при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
2F2 + O2 = 2OF2;
неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.

Получение неметаллов
Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия.
Другие галогены можно также получить электролизом или вытеснением из их солей в растворе с помощью более активного галогена:
Cl2 + 2NaI = 2NaCl + I2.

Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс):
CH4 + H2O = CO + 3H2.
Получение кремния. Кремний получают восстановлением коксом из кремнезема:
SiO2 + 2C = Si + 2CO.
Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P+5CO.

Кислород и азот получают фракционной перегонкой жидкого воздуха.
Сера и углерод встречаются в природе в самородном виде.
Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
Бор получают восстановлением оксида бора магнием.

Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров.
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров.
Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов

Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.