Презентація на тему «Неметаллы, особенности строения»

Неметаллы, особенности строения
Подготовила
Ученица 11-Б класса
Кинебас Наталья

Ответьте на вопросы:
Какой химический элемент входит в состав любого органического вещества?
УГЛЕРОД

Элемент, в переводе с греческого «несущий свет»?
ФОСФОР

Какие 2 элемента наиболее распространены в космосе?
ВОДОРОД И ГЕЛИЙ

Вещество, поддерживающее горение и дыхание?
КИСЛОРОД

Самый легкий газ?
ВОДОРОД

Артур Конан Дойль
«СОБАКА БАСКЕРВИЛЕЙ»
Найдите химическую ошибку:

Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»
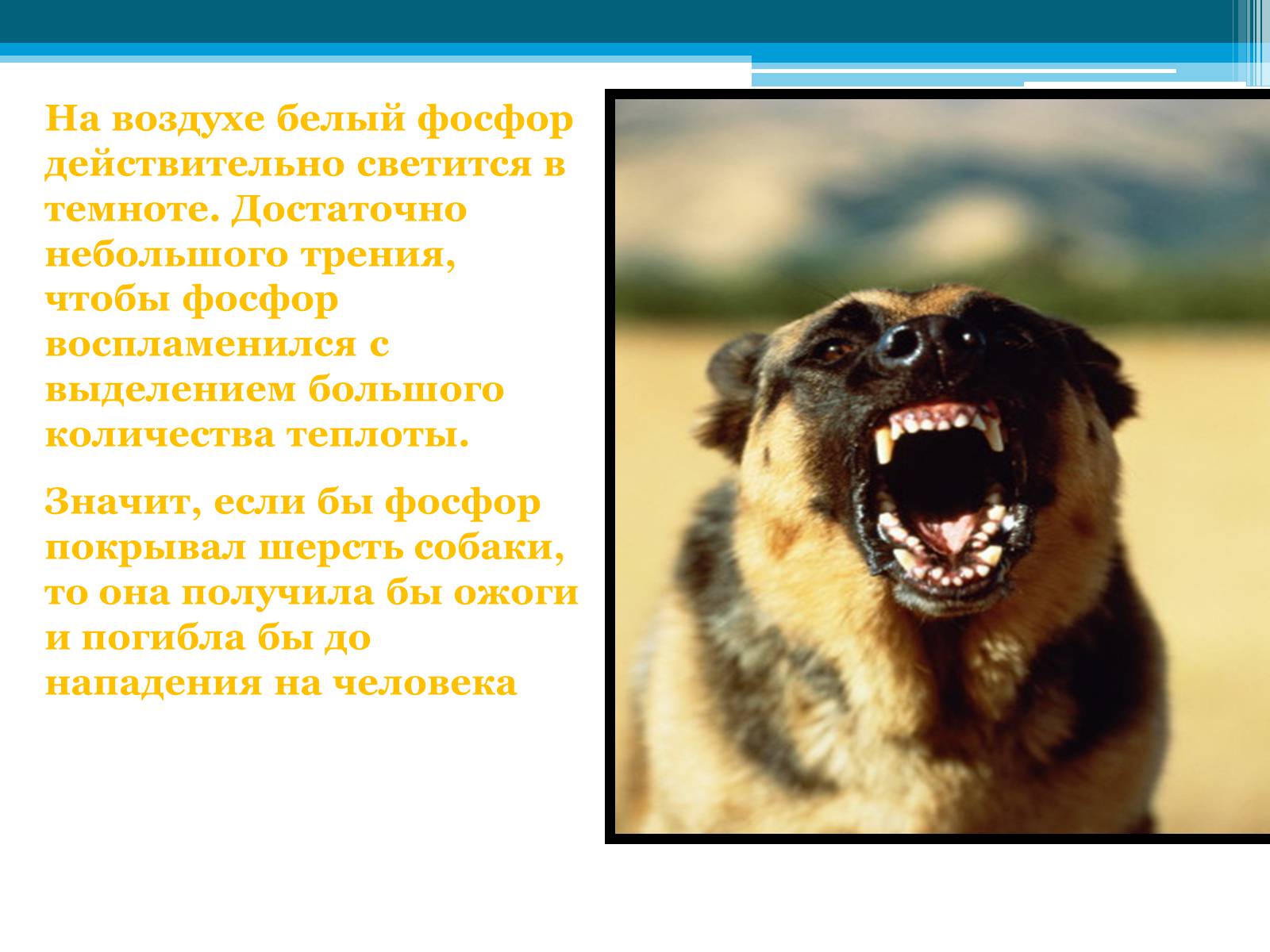
На воздухе белый фосфор действительно светится в темноте. Достаточно небольшого трения, чтобы фосфор воспламенился с выделением большого количества теплоты.
Значит, если бы фосфор покрывал шерсть собаки, то она получила бы ожоги и погибла бы до нападения на человека

Что объединяет все элементы из данного ряда?
Н, В, С, О, Р, F, S, N, He, Si

Что объединяет все показанные слайды?

Что такое неметаллы?

Используя опыт повседневной жизни, школьные знания приведите примеры, связанные с понятием неметаллов.

Что вы знаете о неметаллах?
Запишите в тетрадях вопросы, которые вы хотите узнать о неметаллах, используя:
А) «тонкие» вопросы (где, кто, что, когда, как);
Б) «толстые» вопросы (зачем , почему)

У атомов неметаллов внешняя электронная оболочка содержит много ( от 4 до 7) электронов( исключение атом гелия, у которого 2 электрона)

И стремится к завершению либо путем принятия недостающих электронов (тогда неметалл - окислитель) , либо путем отдачи электронов ( тогда неметалл - восстановитель).

Если на внешней электронной оболочке 8 электронов это инертный газ.

У атомов элементов-неметаллов в периоде с увеличением порядкового номера
заряд ядра увеличивается;
радиусы атомов уменьшаются;
число электронов на внешнем слое увеличивается;
число валентных электронов увеличивается;
электроотрицательность увеличивается;
окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).

У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице - в группе) с увеличением порядкового номера
заряд ядра увеличивается;
радиус атома увеличивается;
электроотрицательность уменьшается;
число валентных электронов не изменяется;
число внешних электронов не изменяется (за исключением водорода и гелия);
окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).

Простые вещества.
Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.

Неметаллы в природе
В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода и растворённые в ней соли, затем минералы и горные породы (например различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты).
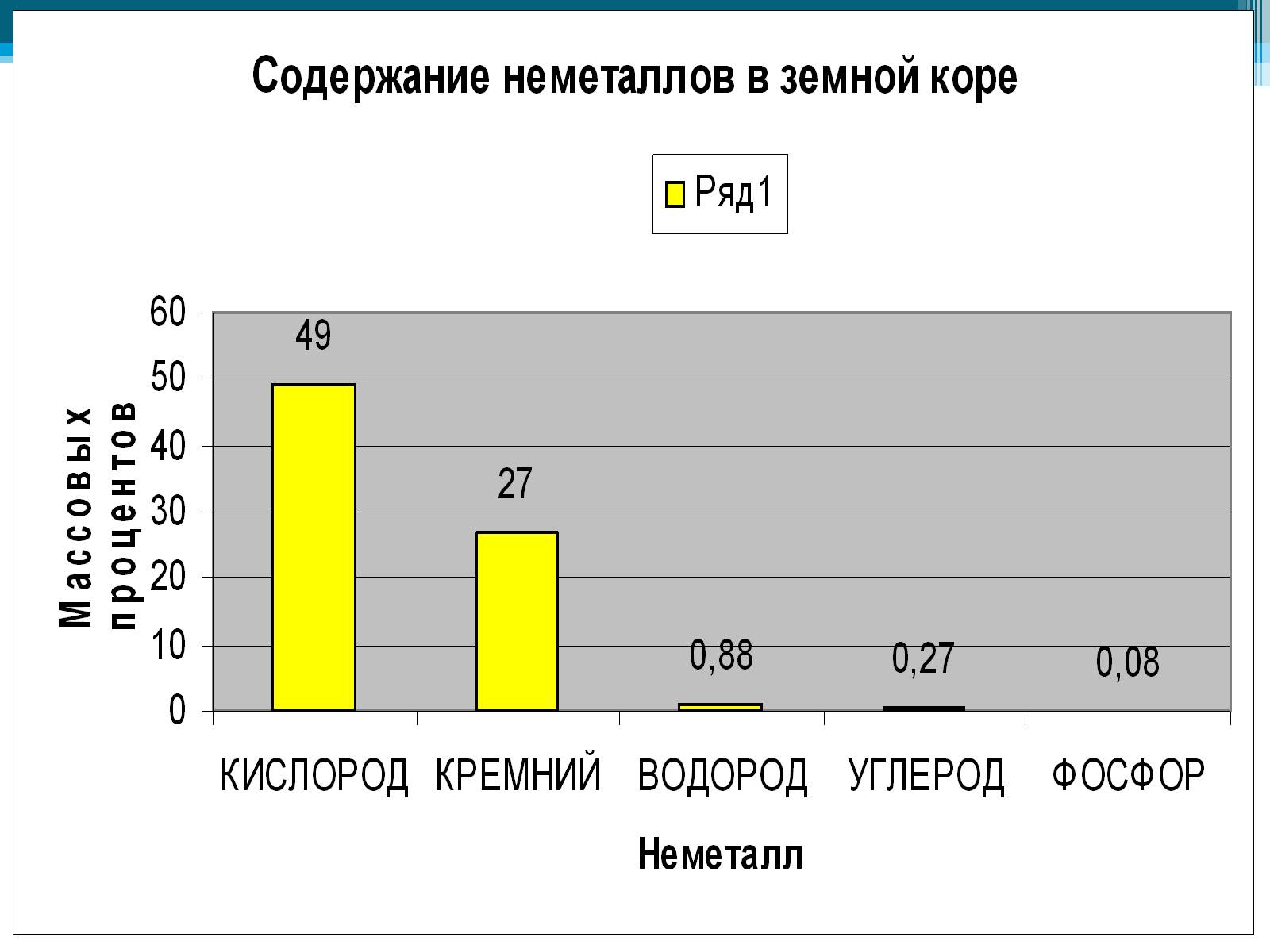
По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).

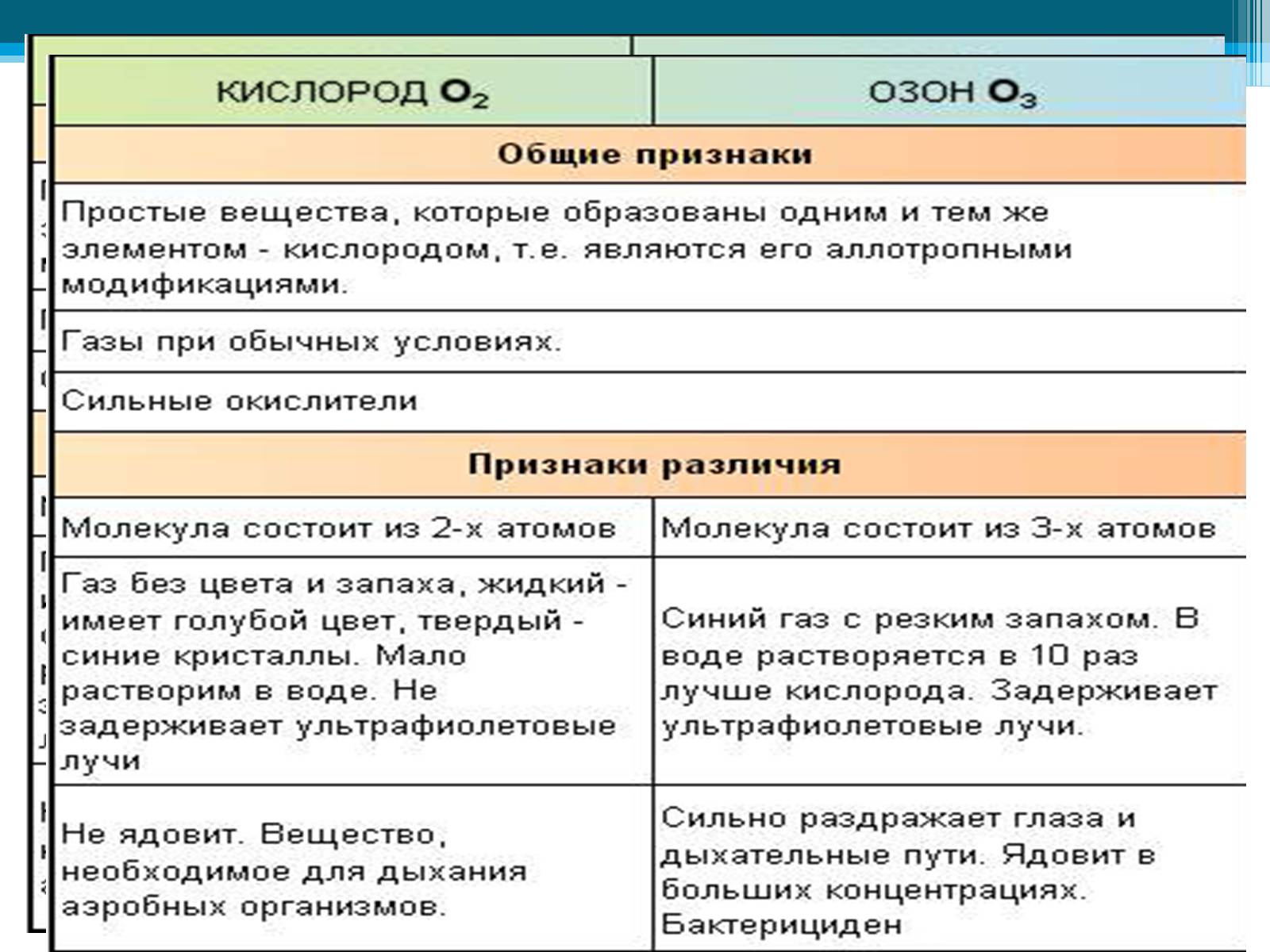
Кислород — газ без цвета, а озон имеет бледно-фиолетовый цвет. Озон более бактерициден (лат. ицдао — «убивать»), чем кислород. Поэтому озон применяется для обеззараживания питье вой воды. Озон способен удерживать ультрафиолетовые лучи солнечного спектра, которые губительны для всего живого на Земле, и потому озоновый экран, который располагается в атмосфер на высот» 20—35 км, защищает жизнь на нашей планете
Кислород
Кислород — газ без цвета, а озон имеет бледно-фиолетовый цвет. Озон более бактерициден (лат. ицдао — «убивать»), чем кислород. Поэтому озон применяется для обеззараживания питье вой воды. Озон способен удерживать ультрафиолетовые лучи солнечного спектра, которые губительны для всего живого на Земле, и потому озоновый экран, который располагается в атмосфер на высот» 20—35 км, защищает жизнь на нашей планете
Кислород

Красный фосфор
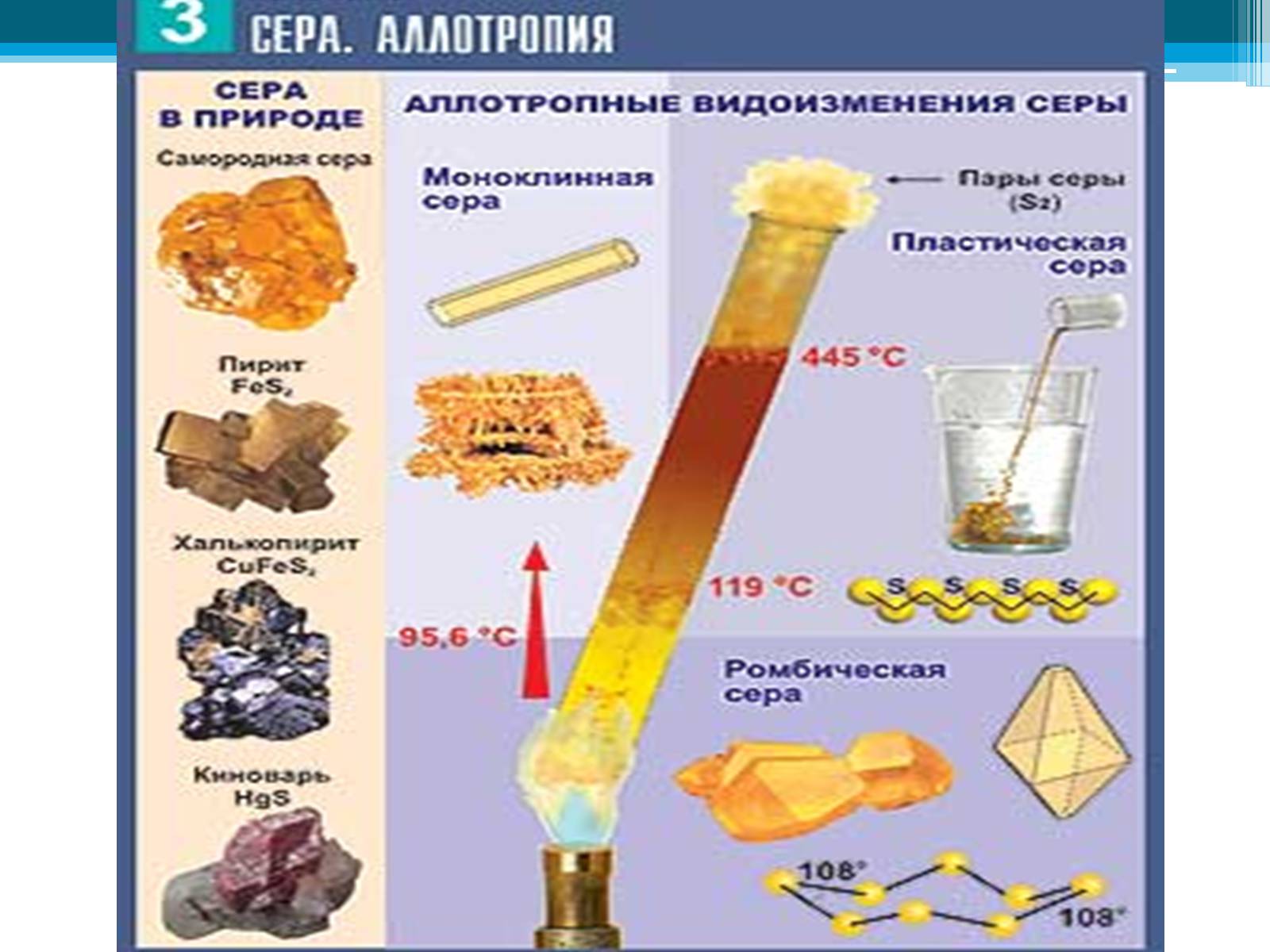
Сера
Алмаз
Кислород

Фосфор в природе
Апатит (содержит фосфат кальция)

Карбонаты
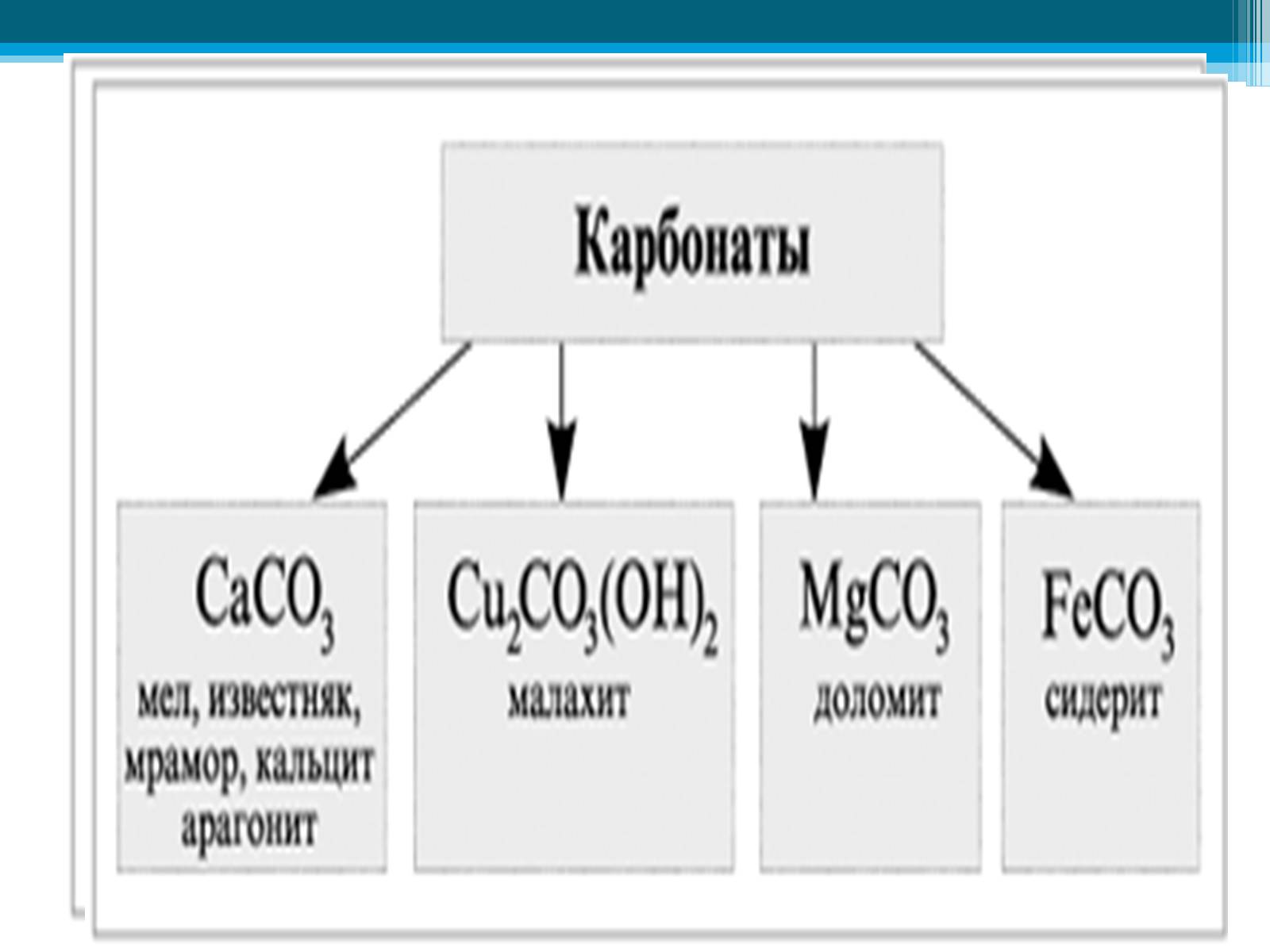
Карбонаты
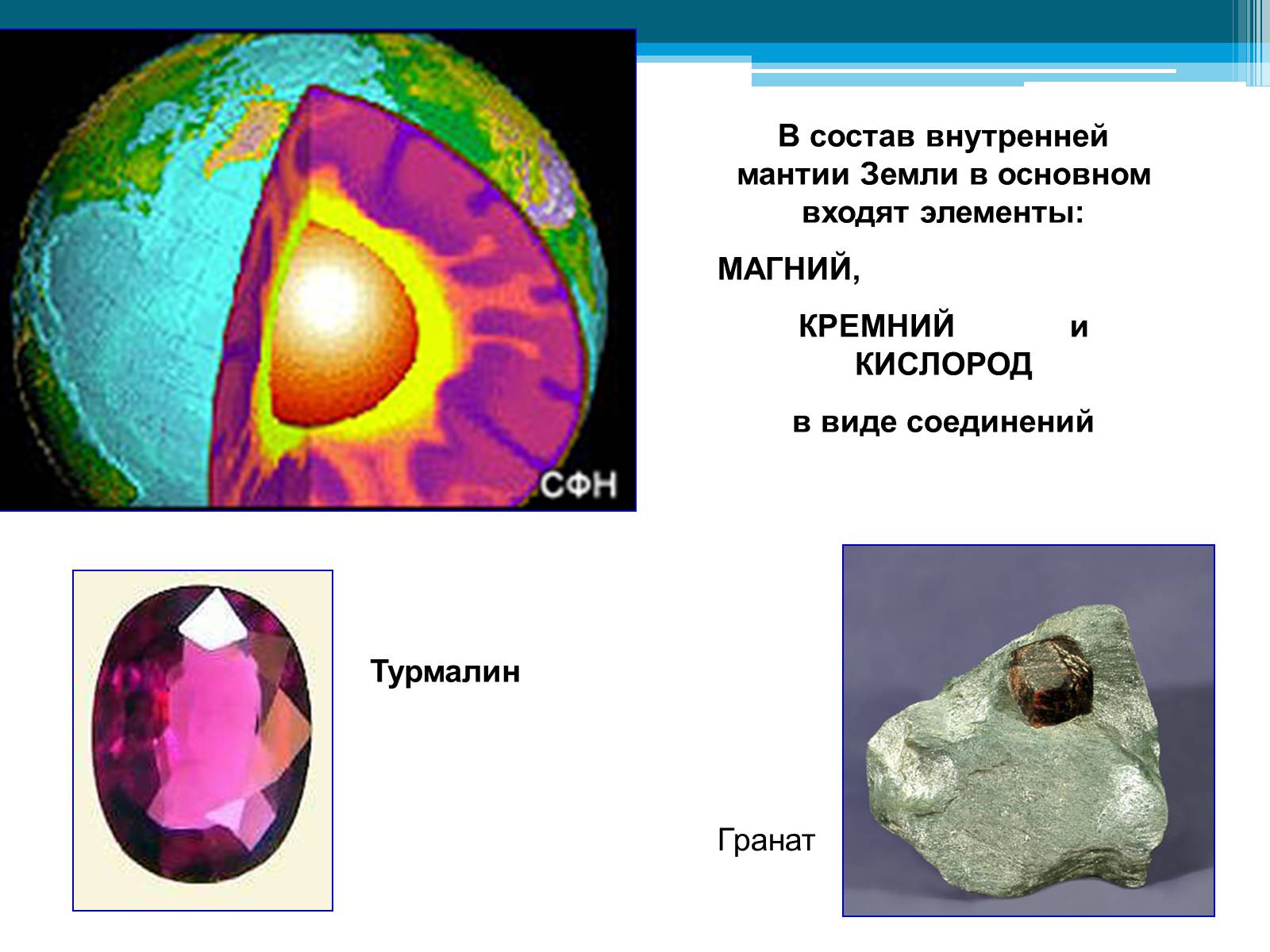
В состав внутренней мантии Земли в основном входят элементы:
МАГНИЙ,
КРЕМНИЙ и КИСЛОРОД
в виде соединений
Турмалин
Гранат

Галогены в природе
Фтор-F2 Флюорит -CaF2
Бром-Br2
в аналогичных соединениях, вместе с хлором
Хлор-Cl2 каменная соль- NaCl
сильвинит –NaCl*KCl
Иод-J2
морская вода , водоросли, буровые воды
Кристаллы хлорида натрия – минерал галит
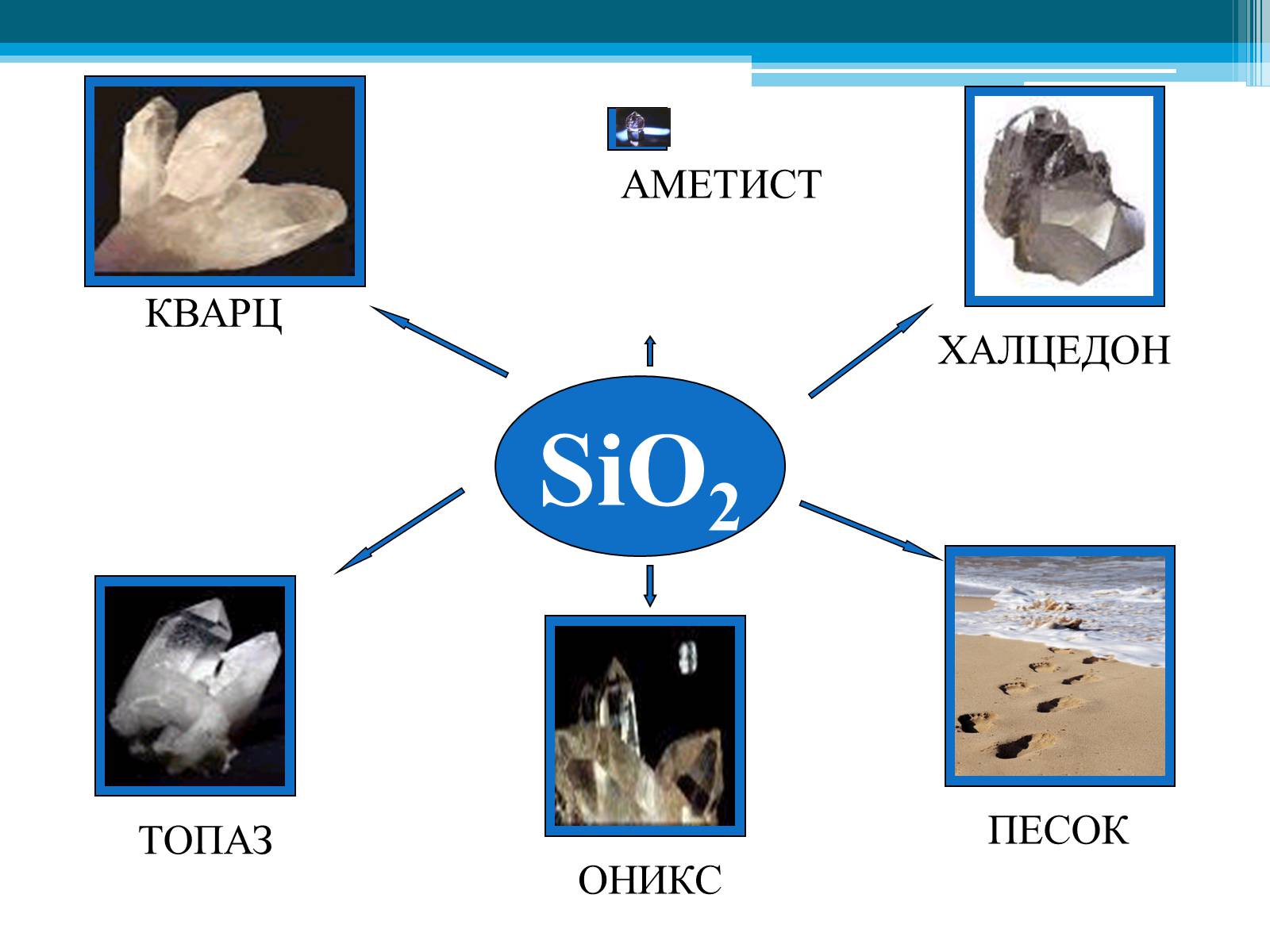
SiO2
ПЕСОК
ХАЛЦЕДОН
КВАРЦ
ОНИКС
ТОПАЗ
АМЕТИСТ

Аллотропия
Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
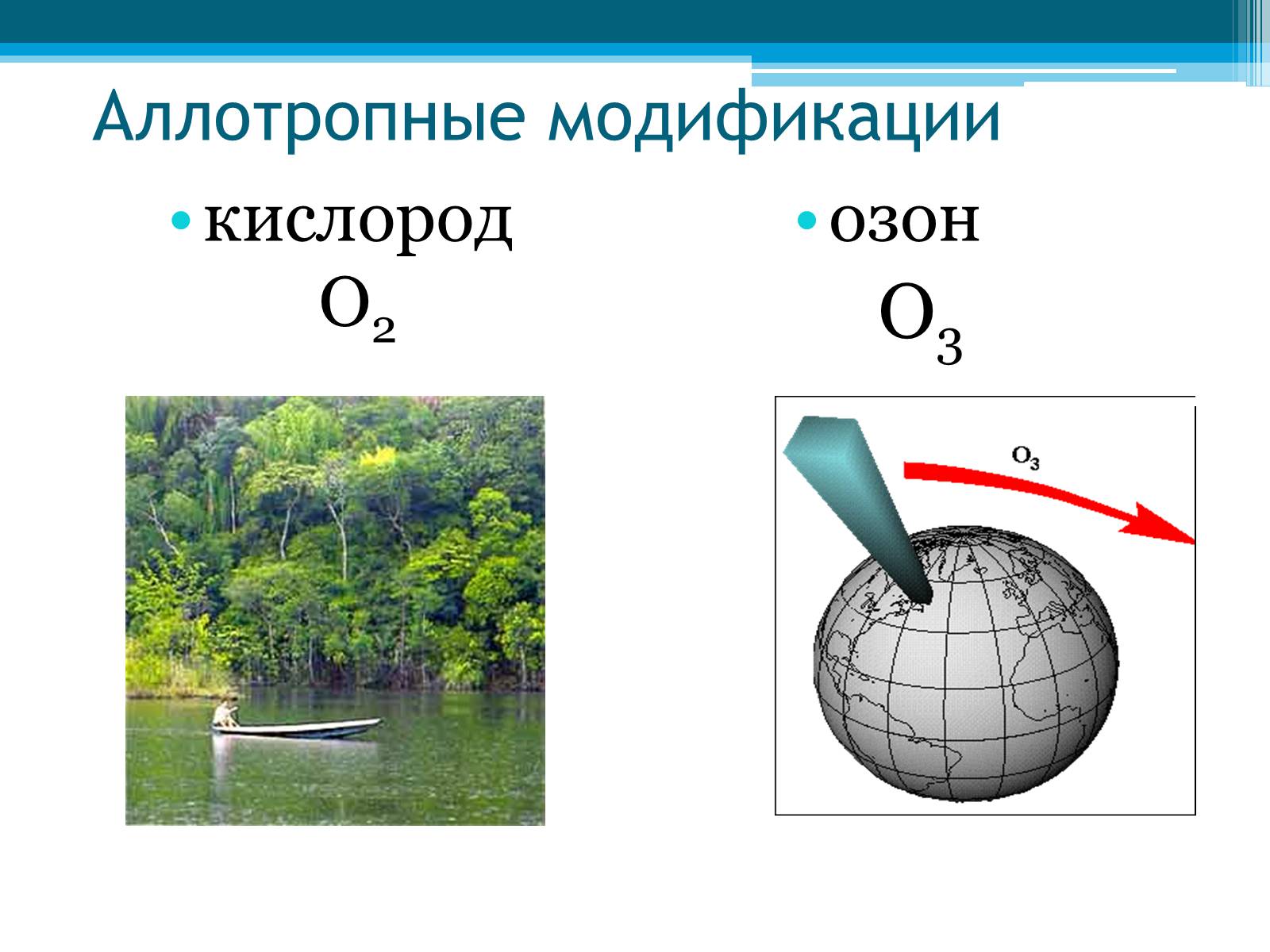
Аллотропные модификации
кислород О2
озон
О3
Аллотропные модификации
кислород О2
озон
О3
Аллотропные модификации
кислород О2
озон
О3

Аллотропные видоизмененияфосфора
Белый фосфор
Красный фосфор

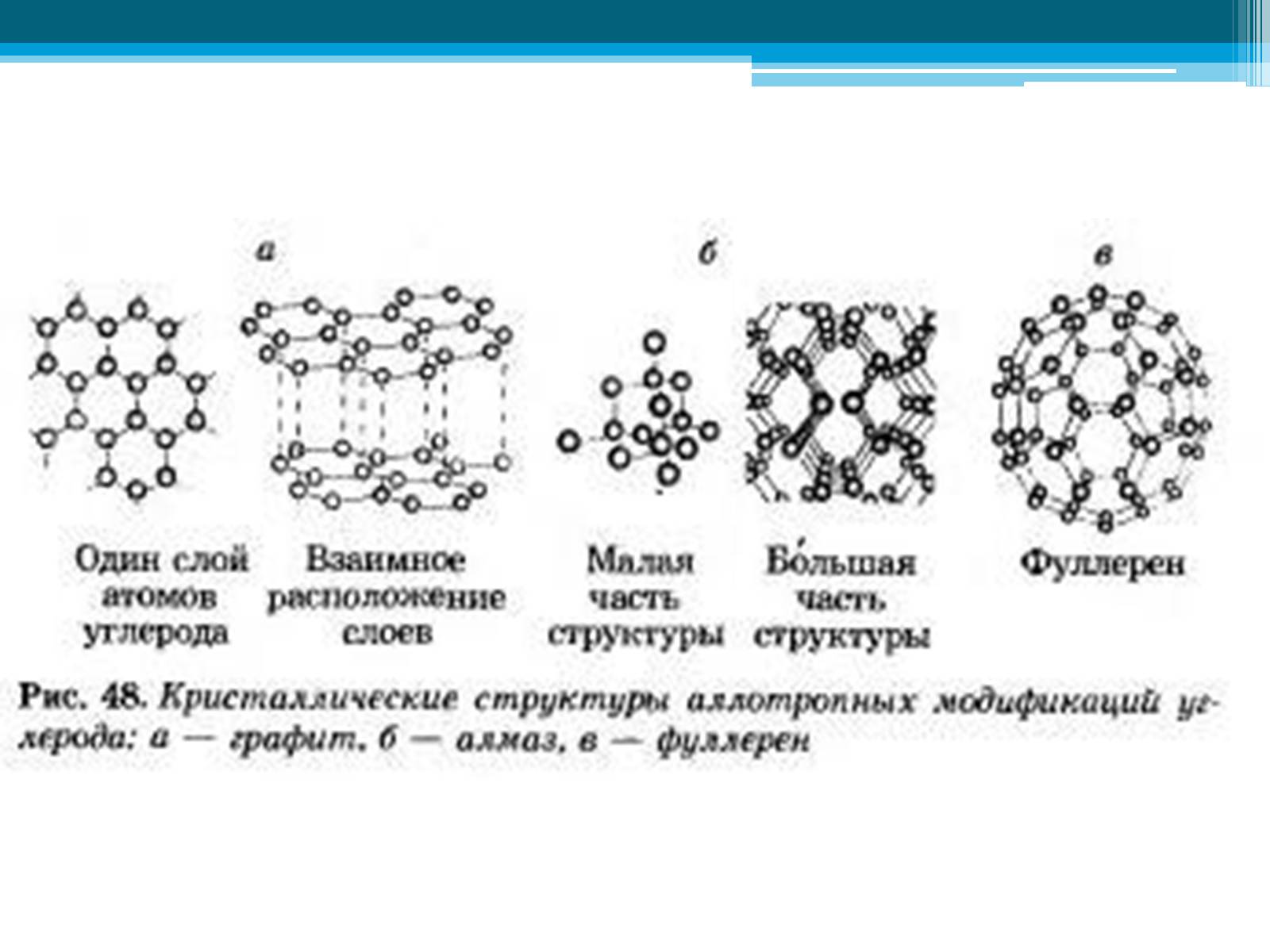
Аллотропия углерода
алмаз
графит

АЛЛОТРОПИЯ(ответьте на вопросы)
Что такое аллотропия?
Чем вызвано явление аллотропии?

Перед вами фотографии различных веществ, найдите среди них неметаллы, попробуйте догадаться о каком неметалле идет речь, объясните ваш выбор.
1
2
3
4
5
6
7
8
9

Конфигурация внешнего электронного слоя

Конфигурация внешнего электронного слоя