Презентація на тему «Оксиди Неметалічних Елементів» (варіант 2)

Оксиди Неметалічних Елементів
Підготував :
Учень 10 Класу
Кійко Едуард

Оксиди Неметалічних Елементів
Кислотні Оксиди – бінарні сполуки, до складу яких входить Оксиген і Неметалічний елемент
Кислотні Оксиди взаємодіють з металами,
Основними та амфотерними оксидами,
Основами, утворюючи сіль
P2О5 + 3СаО → Са3(РО4)2
SO3 + ZnO → ZnSO4
CO2 + 2NaOH → Na2СО3 + Н2О

Розглянемо Вплив і Використання Таких Оксидів

Діоксид Сульфуру
Природним джерелом S02 є окиснення сірководню H2S атмосферним киснем й озоном:
2H2S + 302 = 2SO2 + H2O H2S + O3 = SO2 + Н20
Основними антропогенними джерелами діоксиду сульфуру S02 є спалювання палива, виплавляння металів (димові гази), робота автомобільного транспорту (вихлопні гази)
Діоксид сульфуру S02, потрапляючи у повітря, викликає утворення «кислотних дощів», шкідливих для усього живого
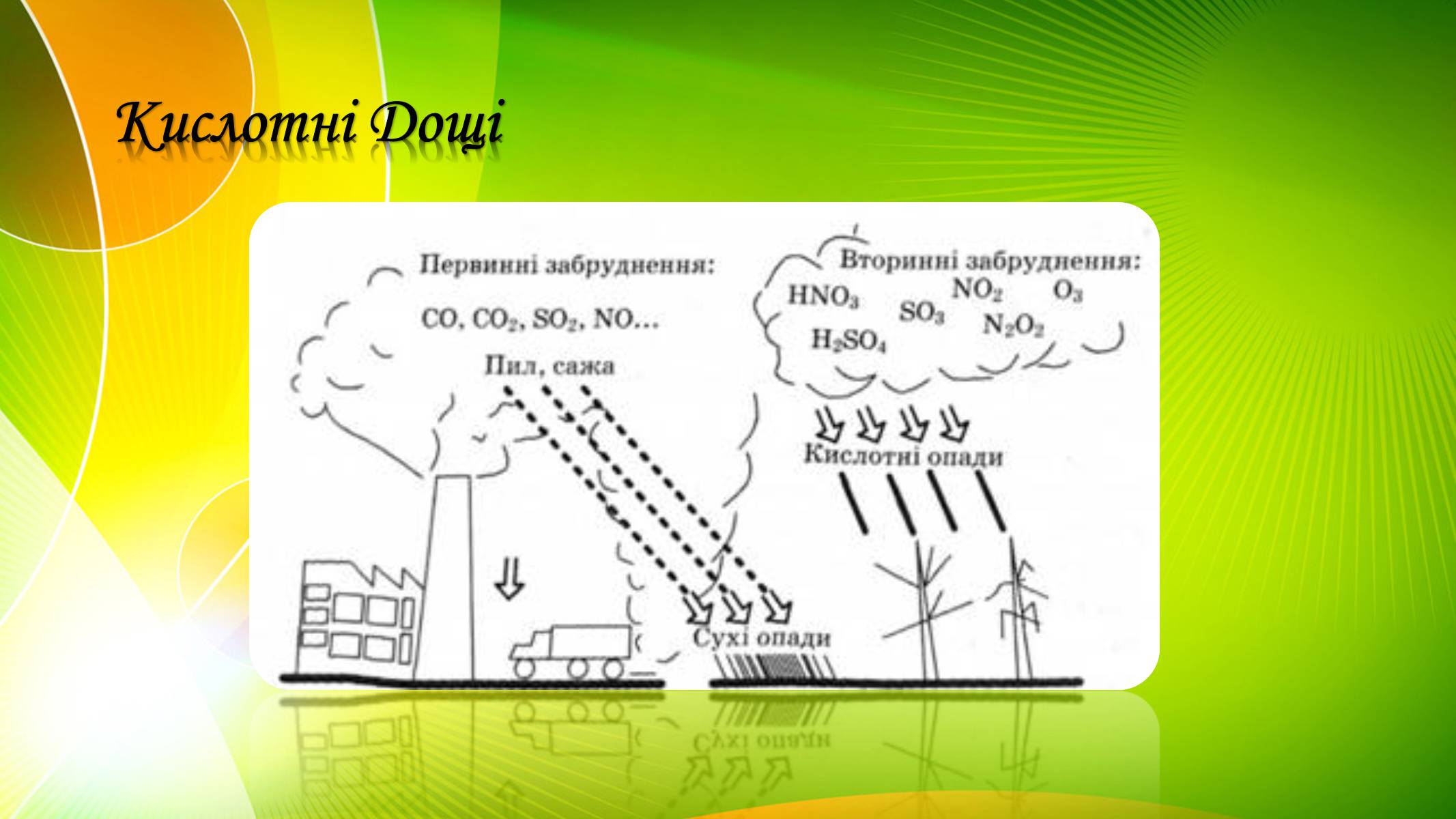
Кислотні Дощі

Діоксид Сульфуру
Найважливіша галузь застосування оксиду сульфуру (IV) S02 — це виробництво сульфатної кислоти H2S04. Його використовують також у виробництві сульфітів і гідросульфітів

Діоксид Азоту
У лабораторії NO 2 зазвичай отримують дією концентрованої азотної кислоти на мідь, крім того його можна отримати термічним розкладанням нітрату свинцю, однак при проведенні реакції слід дотримуватися обережності
У хімічному відношенні діоксид азоту проявляє себе як дуже сильний окисник

Діоксид Азоту
Діоксид азоту дуже отруйний при
вдиханні.
Однак, інгаляцій зазвичай
можна уникнути, адже його легко
виявити по запаху, навіть при
низьких концентраціях

Діоксид Вуглецю
Вуглекислий газ дуже поширений у природі
Неотруйний газ, без кольору і запаху, що є природною складовою атмосфери.
Вуглекислий газ є продуктом спалювання викопного палива. Він має парникові властивості, тобто сприяє утриманню тепла на поверхні Землі і вносить основний вклад у глобальне потепління
У харчовій промисловості діоксид вуглецю використовується як консервант
Балони з рідкою вуглекислотою широко застосовуються як вогнегасників і для виробництва газованої води і лимонаду
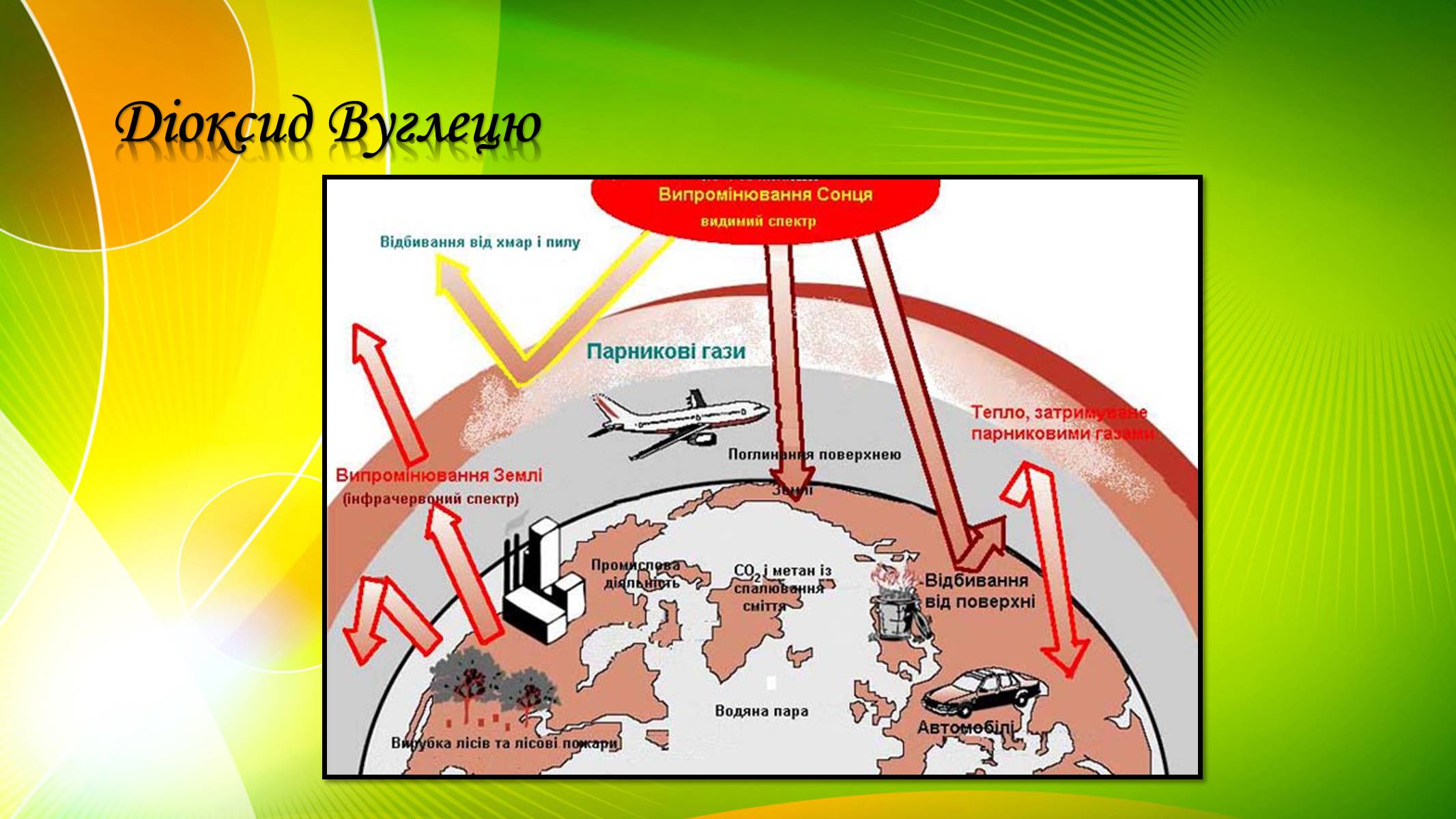
Діоксид Вуглецю