Презентація на тему «Оксиген»

оксиген

Характеристика Оксигену
Хімічний символ елемента Оксигену — O. Відносна атомна маса Оксигену — Аr(O) = 16. Валентність Оксигену в сполуках — 2. Хімічна формула простої речовини кисню — O2. Відносна молекулярна маса кисню — Мr(O2) = 32.

Молекула
кисню
Молекула озону
Оксиген утворює такі прості речовини як кисень і озон

Оксиген — найпоширеніший хімічний елемент на Землі.
Масова частка його в оболонці Землі (в атмосфері, гідросфері, літосфері) становить близько 52 %. У зв'язаному стані, тобто як хімічний елемент, Оксиген входить до складу води, піску, глини, гірських порід і мінералів. Він є у складі всіх речовин, з яких побудовані живі організми. Зокрема в організмі людини на вміст Оксигену припадає майже 65 %.У вільному стані, тобто як проста речовина, кисень О2 є у повітрі. Масова частка його — 23 %, об'ємна — 21 %. Кисень міститься також у природних водах.
Біохімічне очищення річкової та
морської води відбувається за
допомогою розчиненого
у воді кисню.

Історія відкриття
Світовий пріоритет відкриття оксигену належить Китаю. Китайський учений VIII ст. Мао-Хоа встановив наявність у складі повітря двох газів, один із яких мав властивість підтримувати дихання й горіння.В Європі кисень відкрили майже через 1000 років одночасно два видатні хіміки другої половини XVIII ст. — швед Карл Шеєле (1771) та англієць Джозеф Прістлі (1774). Однак К. Шеєле опублікував своє відкриття пізніше, ніж Дж. Прістлі. На одному з майданів міста Лідса вдячні англійці встановили бронзову скульптуру свого видатного співвітчизника.

Застосування оксигену
Кисень повітря має надзвичайно важливе значення для процесів горіння. Спалюючи різні види палива, одержують тепло, яке використовують для задоволення найрізноманітніших потреб, в тому числі для перетворення його в механічну і електричну енергію. За участі кисню повітря згоряє паливо на теплоелектростанціях, пальне у двигунах автомобілів, випалюють металічні руди на заводах кольорової металургії.

Основні відомості
Оксиге́н (О) «той, що породжує кислоту» — хімічний елемент головної підгрупи 6 групи періодичної системи групи з атомним номером 8, простими речовинами якого є гази кисень та озон.

Фізичні властивості
Кисень — безбарвний газ без запаху і смаку. При температурі —183° С він скрапляється у рідину голубуватого кольору, яка при —218,7° С замерзає в синю кристалічну масу. Розчинність кисню у воді невелика і при звичайній температурі становить всього 3,1 см³ в 100 г води. У продаж кисень поступає в сталевих балонах під тиском приблизно 150 атм.
Рідкий кисень
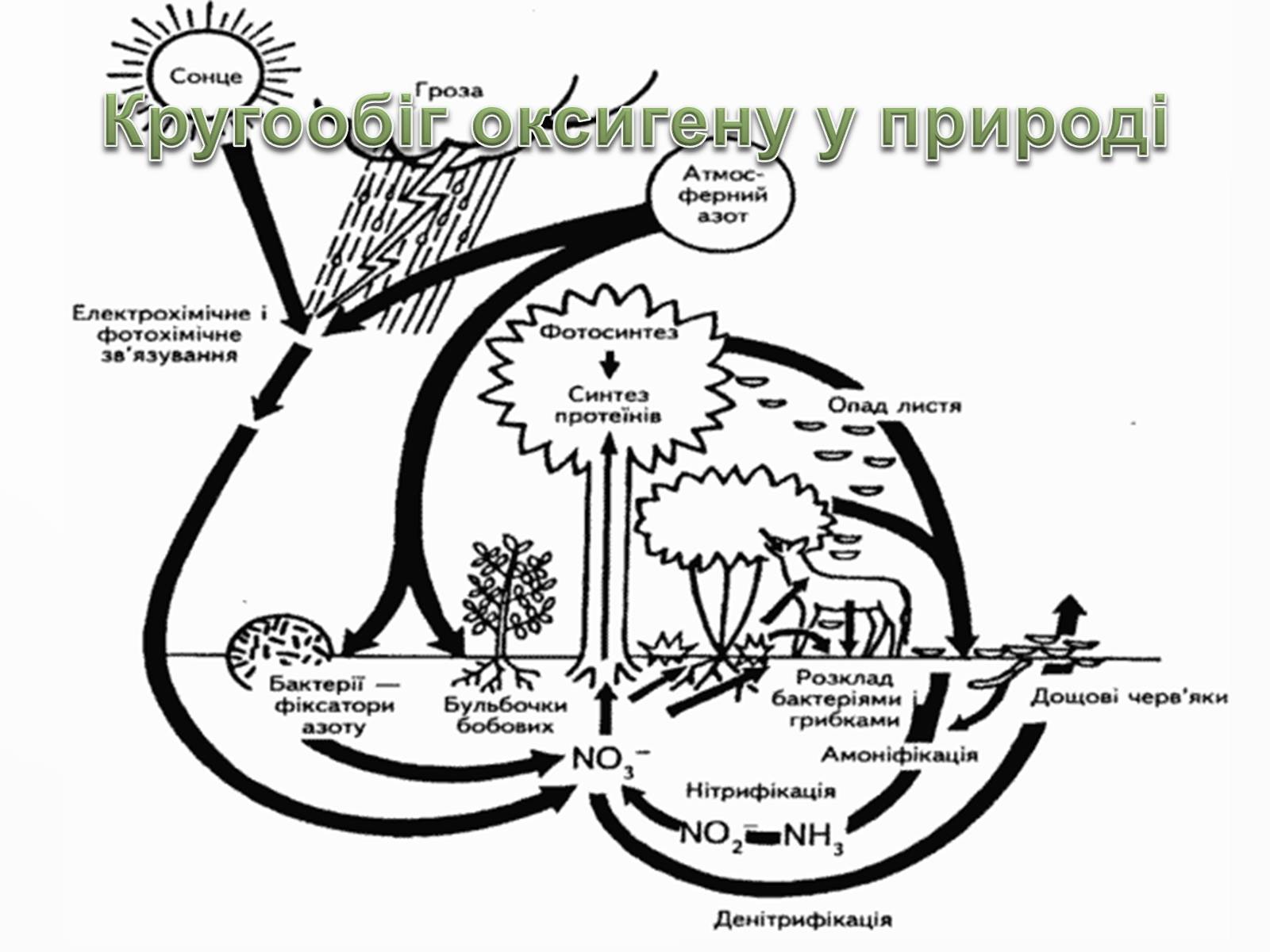
Кругообіг оксигену у природі