Презентація на тему «Карбонові кислоти» (варіант 2)

Презентація натемуКарбонові кислоти
Підготував
студент групи
ФК-44-I
Галюк Юрій

Що ми дізнаємося на сьогоднішньому уроці?
Визначення карбонових кислот
Класифікація
Походження в природі
Електронна будова
Ізомерія і номенклатура
Отримання
Застосування
Фізичні властивості
Хімічні властивості

Карбонові кислоти - органічні сполуки, що містять одну або кілька карбоксильних груп-СООН.
Карбоксильна група містить дві функціональні групи - карбоніл >С=О и гідроксил -OH, безпосередньо зв'язані один з одним:
R
C
O
O
H

1.Залежно від числа карбоксильних груп● одноосновні (монокарбонові) Наприклад: НСООН, С3Н7СООН ● двохосновні – щавлева● багатоосновні (дикарбонові НСООН–СООН щавлева, трикарбонові – лимонна і т.д.)
Класифікація карбонових кислот:
2. За характером вуглеводневого радикалу розрізняють кислоти:
● насичені (наприклад, CH3CH2CH2COOH);
● ненасичені (CH2=CHCH2COOH);
● і ароматичні (RC6H4COOH).

Багато кислот мають історично сформовані або тривіальні назви, пов'язані головним чином з джерелом їх отримання.
Формула
Назва
Систематичне
Тривіальне
HCOOH
Метанова
Мурашина
CH3COOH
Етанова
Оцтова
C2H5COOH
Пропанова
Пропионова
C3H7COOH
Бутанова
Масляна
C4H9COOH
Пентанова
Валеріанова
C5H11COOH
Гексанова
Капронова
C15H31COOH
Пентидеканова
Пальмітинова
C17H35COOH
Гептадеканова
Стеаринова
Мурашина – залози комах,
бджолина отрута,
кропива, соснова хвоя.
Oцтова - піт, сеча, деякі рослини, кисле молоко, хвоя.
Масляна – згіркле вершкове масло.
Валеріанова - корінь валеріани
Олеїнова-маслинова олія
Янтарна - янтар, буре вугілля.
Молочна кисле молоко, сир, квашена капуста, силос, накопичується у м'язах при фізичній роботі.
Лимонна - лимони, апельсини та інші цитрусові.
Яблучна – яблука, горобина, виноград.
Щавлева - щавель, ревінь.
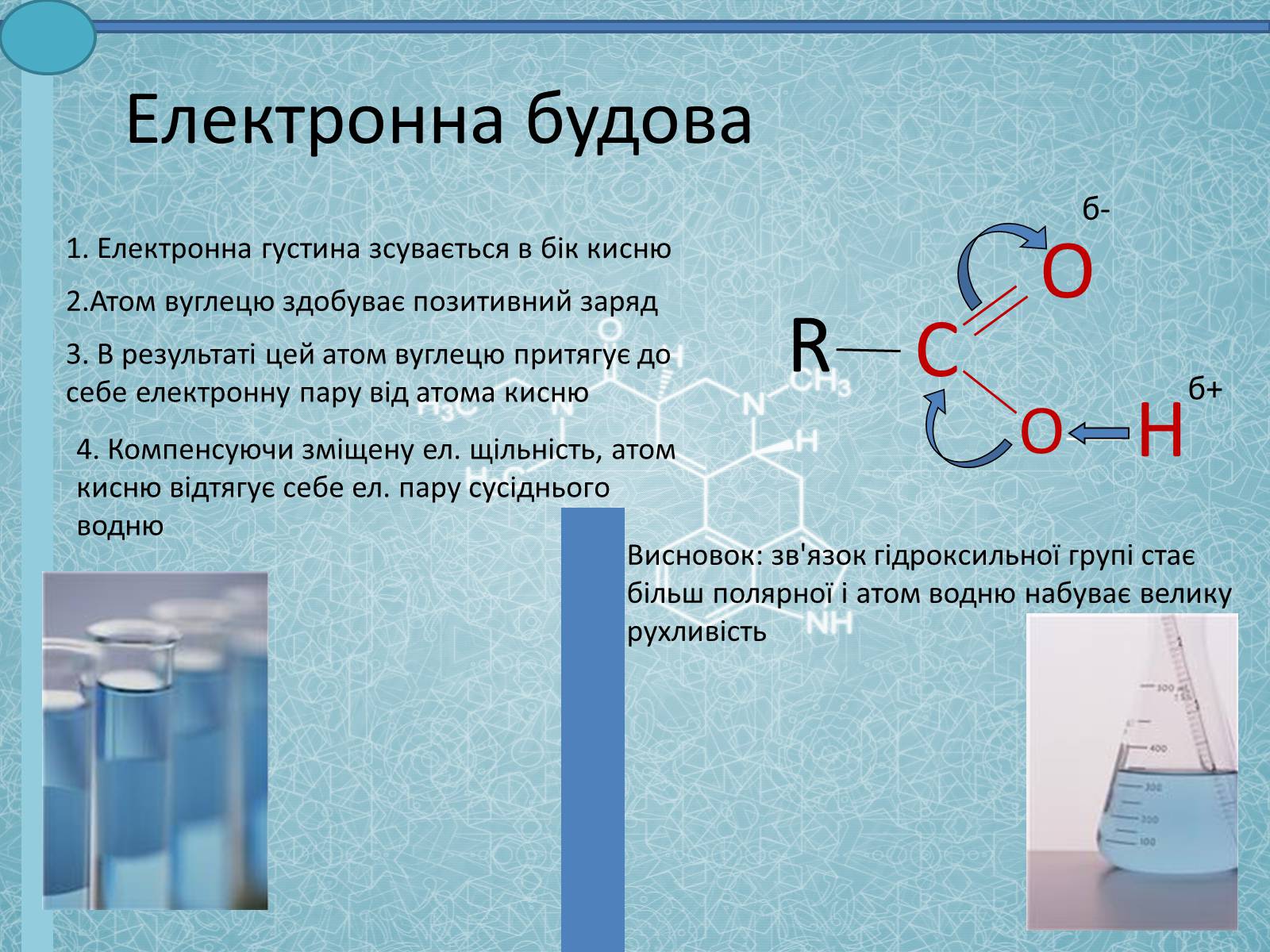
Електронна будова
1. Електронна густина зсувається в бік кисню
2.Атом вуглецю здобуває позитивний заряд
3. В результаті цей атом вуглецю притягує до себе електронну пару від атома кисню
R
C
O
O
H
б-
б+
4. Компенсуючи зміщену ел. щільність, атом кисню відтягує себе ел. пару сусіднього водню
Висновок: зв'язок гідроксильної групі стає більш полярної і атом водню набуває велику рухливість
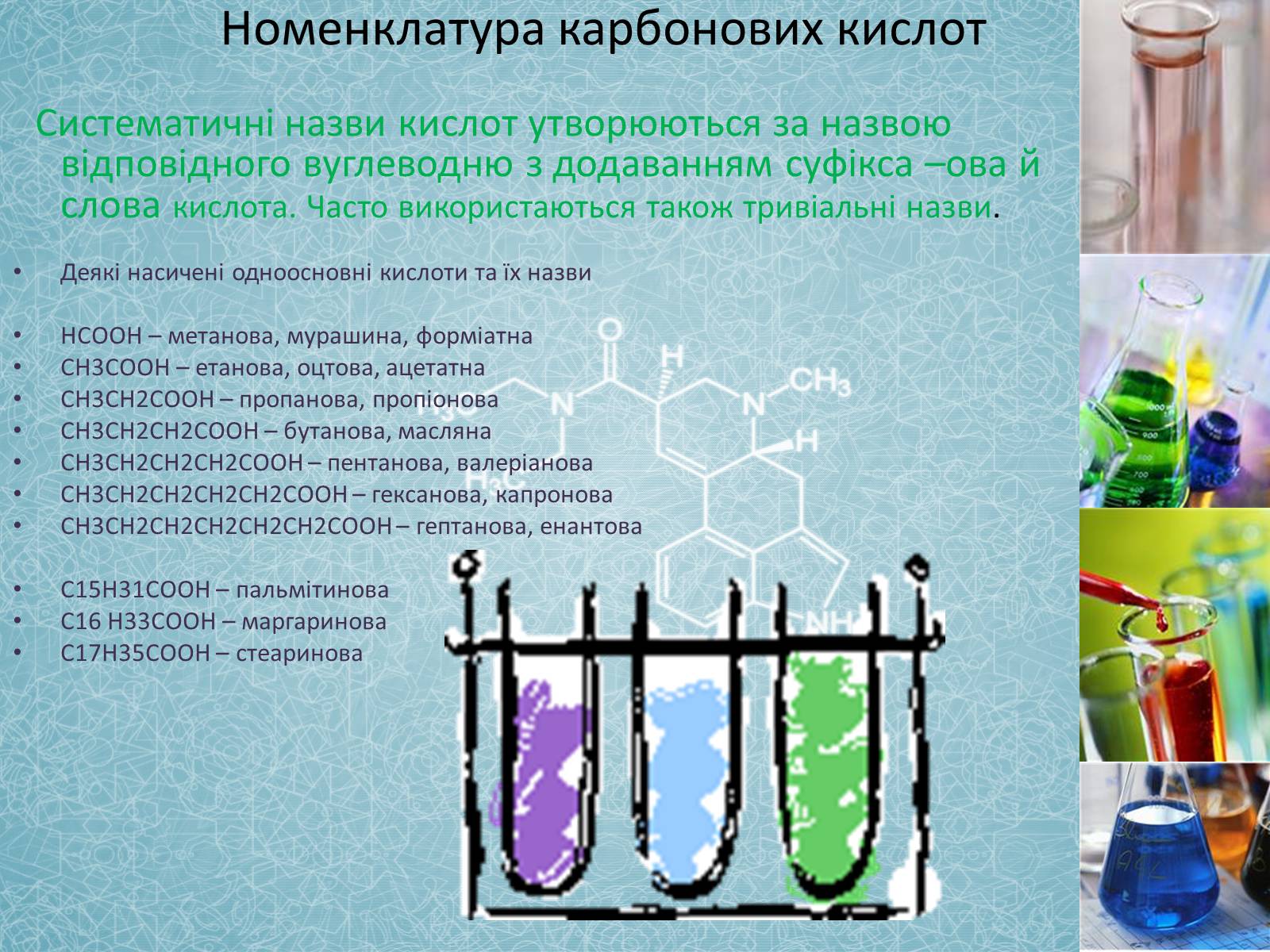
Номенклатура карбонових кислот
Систематичні назви кислот утворюються за назвою відповідного вуглеводню з додаванням суфікса –ова й слова кислота. Часто використаються також тривіальні назви.
Деякі насичені одноосновні кислоти та їх назви
НСООН – метанова, мурашина, форміатна
СН3СООН – етанова, оцтова, ацетатна
СН3СН2СООН – пропанова, пропіонова
СН3СН2СН2СООН – бутанова, масляна
СН3СН2СН2СН2СООН – пентанова, валеріанова
СН3СН2СН2СН2СН2СООН – гексанова, капронова
СН3СН2СН2СН2СН2СН2СООН – гептанова, енантова
С15Н31СООН – пальмітинова
С16 Н33СООН – маргаринова
С17Н35СООН – стеаринова

Ізомерія
– структурна ізомерія - ізомерія кістяка у вуглеводневму радикалі (починаючи з C4).
– міжкласова ізомерія, починаючи з C2. Наприклад, формулі C2H4O2 відповідають 3 ізомери, що належать до різних класів органічних сполук – карбонових кислот і естерів.
– просторова ізомерія. Можлива цис-транс ізомерія у випадку ненасичених карбонових кислот. Наприклад: олеїнова (цис-ізомер) та елаїдинова (транс-ізомер) кислоти.

Способи добування
Мурашина кислота зустрічається в вільному стані. Вона міститься в соках кропиви, хвої, фруктах, а також в поті і сечі. Це безбарвна рідина з різким запахом, з температурою кипіння близькою до температури кипіння води 1010С.
В промисловості мурашину кислоту одержують із її натрієвої солі, яка утворюється при пропусканні оксиду вуглецю через розплавлений гідроксид натрію:
1.СО + NaOH НСООNa
2НСООNa + H2SO4 2НСООH+ Na2SO4
або

Способи добування
Оцтова кислота часто зустрічається в природі. Вона міститься в сечі, поті, жовчі і шкірі тварин, рослинах. Утворюється при оцтовокислому бродінні рідин, що містять спирт (вино, пиво) - скисання виноградного вина. Це протікає під впливом "оцтового грибка", завжди присутнього в повітрі:
С2Н5ОН + О2 СН3СООН + Н2О
Основний промисловий синтетичний спосіб складається з 3-х стадій:
1. Крекінг метану на ацетилен і гідроген: 2СН4 СН СН + 3Н2
2. Добування оцтового альдегіду за реакцією Кучерова:
О
солі ртуті //
СН СН + Н2О СН3 - С
Н
3.Окислення оцтового альдегіду киснем повітря за наявності каталізатора:
О О
// О //
СН3 - С СН3 С
Н ОН.
Найбільш економічно вигідний спосіб добування оцтової кислоти:
t, p
2СН3 – СН2 – СН2 – СН3 + 3О2 4СН3СООН + 2Н2О

Як сильний відновник в хімічній промисловості
Як дезінфікуючий засіб в харчовій промисловості
Для дублення шкіри в шкіряній промисловості
Мурашиний спирт –
в медицині
Як протрава при фарбування тканин в текстильній пром. мисловості
Застосування мурашиної кислоти
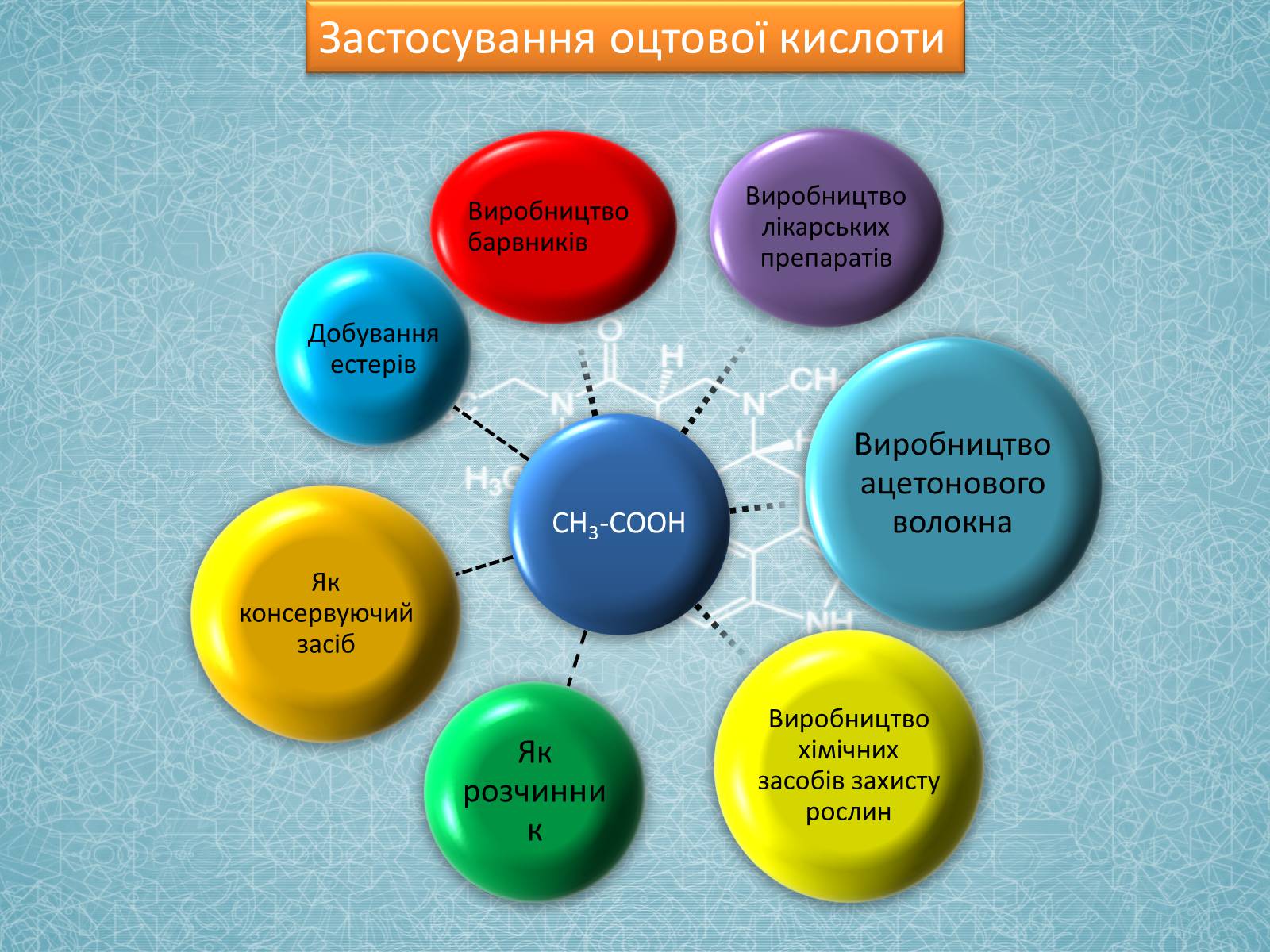
Застосування оцтової кислоти

Фізичні властивості карбонових кислот
Серед карбонових кислот немає газоподібних речовин. Нижчі члени ряду – безбарвні рідини,
з різким запахом, добре розчинні у воді.
Збільшення молекулярної маси обумовлює зниження розчинності у воді карбонових кислот.
Вищі карбонові кислоти, починаючи з пальмітинової – тверді речовини, мають слабкий запах стеарину
або взагалі без запаху, нерозчинні у воді. Температури кипіння карбонових кислот із збільшенням кількості
атомів Карбону зростає і вища, ніж у відповідних спиртів.
С1 С2 С3 С4С5 С6 С16 С18
Tкип, С
50
100
150
200
250
Їх добра розчинність і високі температури кипіння пояснюються утворенням більшого числа водневих звязків між молекулами кислот.

Хімічні властивості
Розчини карбонових кислот у воді мають кислий смак, забарвлюють лакмус і метил оранжевий у червоний колір, проводять електричний струм, взаємодіють з металами з виділенням водню. Це свідчить, що органічні кислоти вступають у реакції, характерні для кислот. Розглянемо хімічні властивості карбонових кислот на прикладі оцтової кислоти.
Хімічні властивості карбонових кислот в порівнянні з неорганічними кислотами
У карбонових кислот під впливом
карбоксильної групи збільшується
рухливість атомів водню, які стоять
біля атома вуглецю, сусіднього з
карбоксильною групою. Тому вони
легко заміщуються атомами хлору:
СН3СООН + СІ2 СН2СООН + HСІ
СІ
хлороцтова кислота