Презентація на тему «Бензен» (варіант 1)

Бензен

Бензе́н (також бензол) — перший представник гомологічного ряду ароматичних вуглеводнів, молекулярна формула C6H6. Безбарвна летка рідина з характерним запахом. Вперше отриманий Майклом Фарадеєм з конденсату піролізу китового жиру в 1825 році.

Промислово бензен добували із фракцій кам'яновугільної смоли. Бензен має цінні властивості як розчинник, але через його високу токсичність і канцерогенність таке використання наразі дуже обмежено. Ця сполука є сировиною для промислового органічного синтезу.
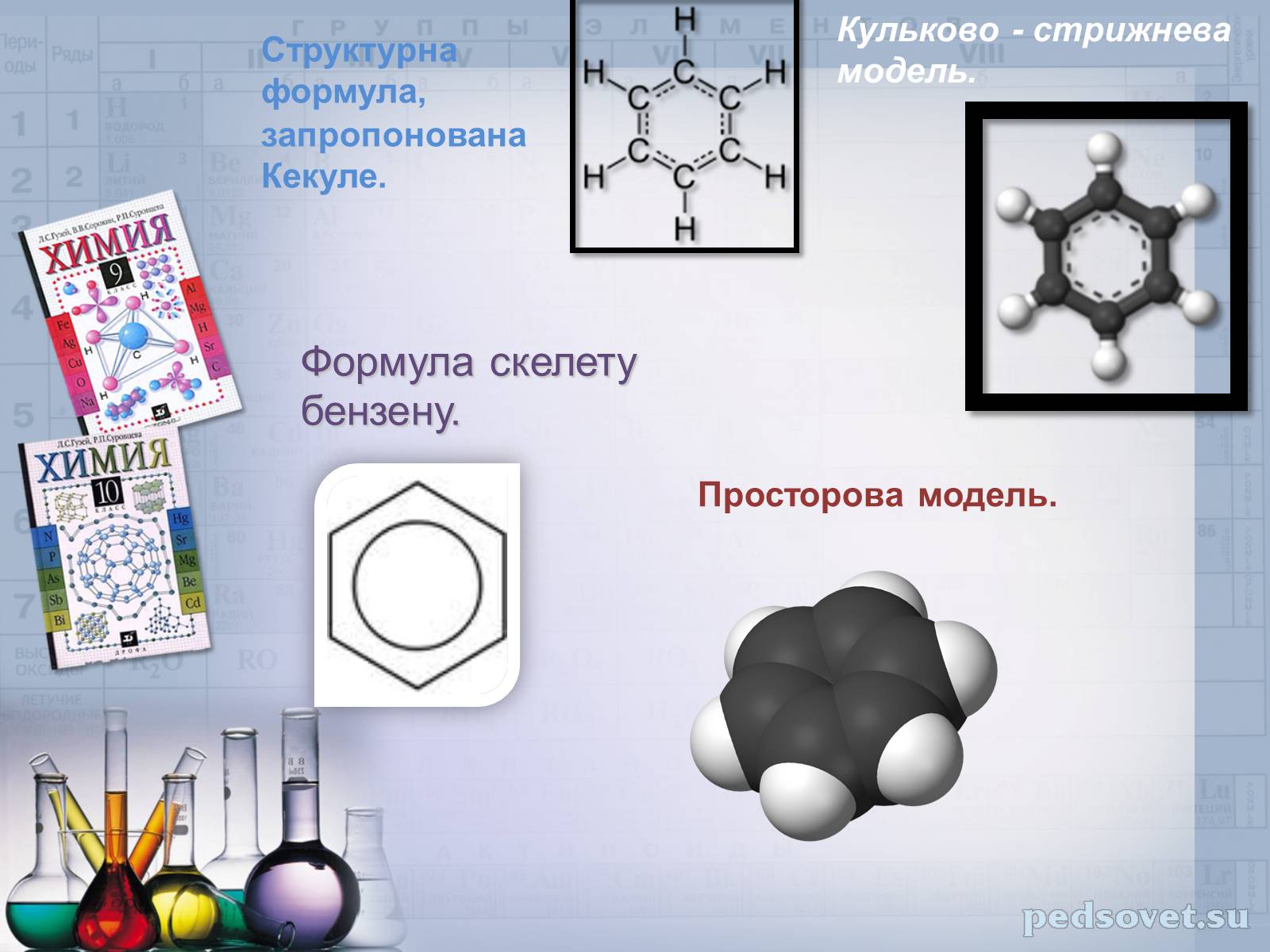
Структурна формула,
запропонована Кекуле.
Кульково - стрижнева модель.
Формула скелету бензену.
Просторова модель.

Історія дослідження
Бензен — перший із відкритих людиною аренів. У чистому вигляді він був виділений Майклом Фарадеєм шляхом дистиляції та кристалізації зі світного газу, що є продуктом високотемпературного розкладу китового жиру, і використовувався у вуличних ліхтарях . Тоді ж була встановлена відносна густина його пари та кількісне співвідношення між атомами елементів, що входять до його складу. 1834 року Мітчерліх виділив бенезен шляхом сухої дистиляції бензойної кислоти із вапном і назвав цю сполуку «бензином» від бензойної кислоти. Бензен на відміну від алкенів та алкінів краще вступає в реакції заміщення ніж приєднання.

Фізичні властивості
Бензен — безбарвна рідина з своєрідним запахом. Густина — 0,88 г/см³. При 80,1 °C кипить, а за 5,5 °C замерзає в білу кристалічну масу. Бензен завдяки своїй симетричності є неполярною речовиною, тому не розчиняється у воді. Є добрим розчинником для багатьох органічних речовин.

Хімічні властивості
На відміну від неароматичних ненасичених вуглеводнів, найхарактерніші реакції заміщення, а не приєднання, хоча останні також можуть відбуватись за достатньо жорстких умов. Заміщення відбувається за електрофільним механізмом. Також бензен вступає в реакції окиснення. Бензол реагує з алкенами, хлор алканами, галогенами, азотної і сірчаною кислотами. Реакції розриву бензольного кільця проходять в жорстких умовах (температура, тиск).