Презентація на тему «Кислотні дощі» (варіант 4)

Виконали учениці 10-А класу Александрова Ірина і Бадя Юлія
Кислотні дощі

Кисло́тний дощ — усі види метеорологічних опадів: дощ, сніг, град, туман, дощ зі снігом, — кислотність яких вища від нормальної.

Схема утворення кислотного дощу
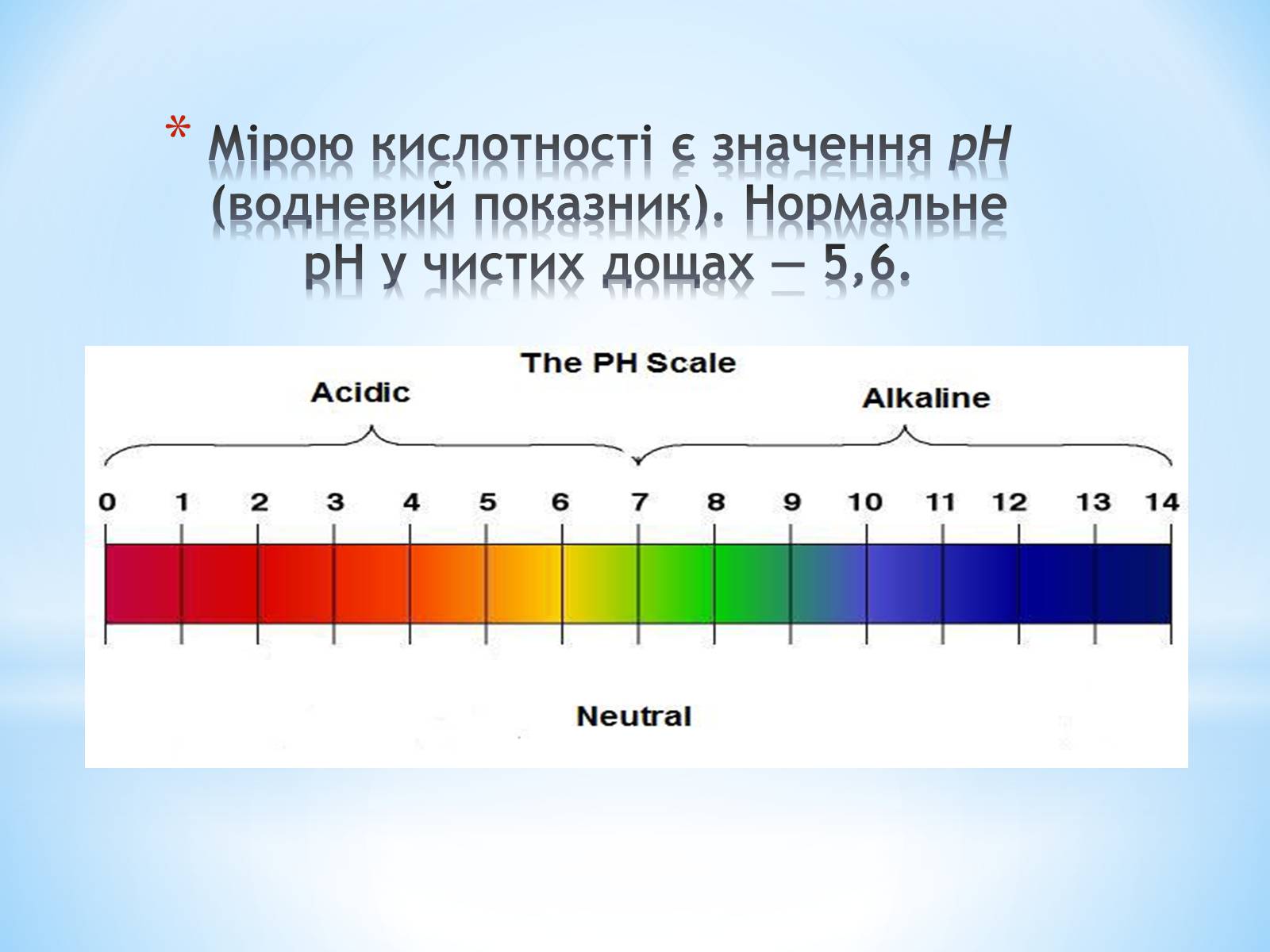
Мірою кислотності є значення рН (водневий показник). Нормальне pH у чистих дощах — 5,6.
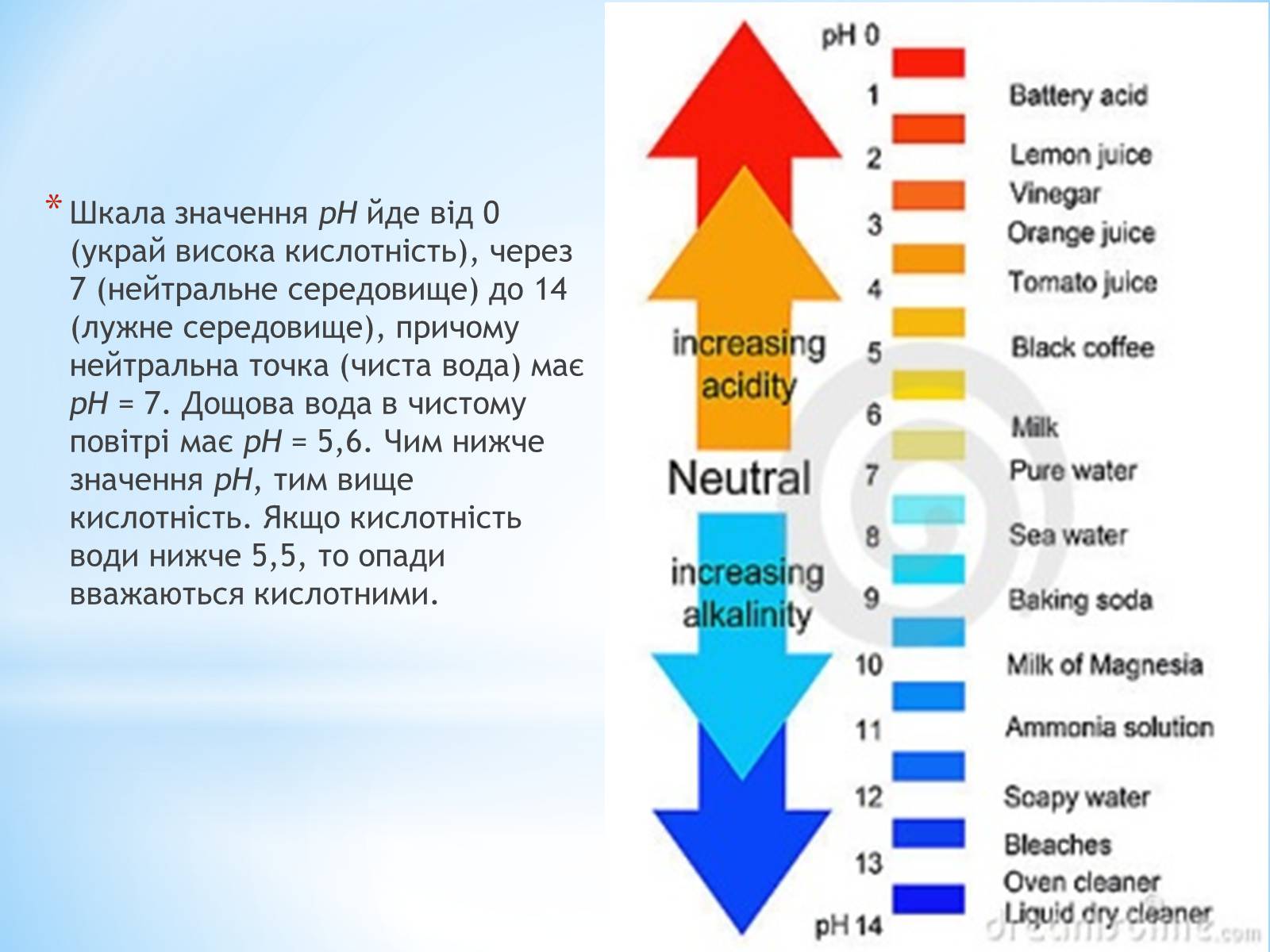
Шкала значення рН йде від 0 (украй висока кислотність), через 7 (нейтральне середовище) до 14 (лужне середовище), причому нейтральна точка (чиста вода) має рН = 7. Дощова вода в чистому повітрі має рН = 5,6. Чим нижче значення рН, тим вище кислотність. Якщо кислотність води нижче 5,5, то опади вважаються кислотними.

Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як діоксид сірки (SO2) і різних оксидів азоту (NOx). Ці речовини викидаються в атмосферу автомобільним транспортом, у результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини. Вступаючи в реакцію з водою атмосфери, вони перетворюються в розчини кислот: сірчаної, сірчистої, азотистої й азотної. Потім, разом із снігом чи дощем, вони випадають на землю.

Діоксид сірки, що потрапив в атмосферу, перетерплює ряд хімічних перетворень, що ведуть до утворення кислот. Частково діоксид сірки в результаті фотохімічного окислювання перетворюється в триоксид сірки (сірчаний ангідрид) SO3:
2SO2 + О2 → 2SO3,
який реагує з водяною парою атмосфери, утворюючи аерозолі сірчаної кислоти:
SO3 + Н2О → H2SO4.
Основна частина діоксиду сірки, що викидається у вологому повітрі утворить аерозоль сірчистої кислоти і зображують умовною формулою Н2SO3:
SO2 + H2O → H2SO3.
Сірчиста кислота у вологому повітрі поступово окисляється до сірчаної:
2H2SO3 + O2 → 2H2SO4.

У водяних екосистемах кислотні опади викликають загибель риб та інших водяних мешканців. Підкислення води рік і озер серйозно впливає і на сухопутних тварин, тому що багато звірів і птахів входять до складу харчових ланцюгів, що починаються у водяних екосистемах. Разом із загибеллю озер стає очевидною і деградація лісів. Кислоти порушують захисний восковий покрив листів, роблячи рослини уразливішими для комах, грибів і інших патогенних мікроорганізмівКислотні дощі роз'їдають метали, фарби, синтетичні з'єднання, руйнують архітектурні пам'ятники