Презентація на тему «Модель атома Томсона» (варіант 2)

Модель атома Томсона

Джозеф-Джон Томсон - английский физик, удостоенный в 1906 г. Нобелевской премии по физике за работы, которые привели к открытию электрона.
Родился 18 декабря 1856 г. в пригороде Манчестера - Читем-Хилле.
В 1884-1919 гг. Томсон - профессор Кембриджского университета и одновременно руководитель Кавендишской лаборатории; в 1905-1918 гг. - профессор Королевской ассоциации в Лондоне.
Ранние работы Томсона посвящены вычислению электромагнитного поля движущегося заряженного шара, теории вихрей, прецизионному измерению отношения абсолютных электрических единиц к электромагнитным. Занимаясь изучением газового разряда, совместно с сотрудниками выполнил серию классических работ, приведших его к открытию электрона - впервые измерил отношение заряда электрона к массе в 1897 г.
Томсон дал объяснение непрерывного спектра рентгеновского излучения, установил природу положительных ионов, предложил первую модель строения атома. В 1911 г. он разработал так называемый метод парабол для измерения отношения заряда частицы к её массе, который сыграл большую роль в исследовании изотопов.
Кавендишская лаборатория за время, когда ее возглавлял Томсон, превратилась в ведущий научно-исследовательский центр. Здесь под руководством Томсона работали Ф. Астон, Ч. Вильсон, Э. Резерфорд, У. Ричардсон и др.
За научные заслуги Томсон был награжден медалями Б. Франклина (1923 г.), М. Фарадея (1938 г.), Копли (1914 г.) и др.
Умер Томсон в Кембридже 30 августа 1940 г.

Джозеф-Джон Томсон - английский физик, удостоенный в 1906 г. Нобелевской премии по физике за работы, которые привели к открытию электрона.
Родился 18 декабря 1856 г. в пригороде Манчестера - Читем-Хилле.
В 1884-1919 гг. Томсон - профессор Кембриджского университета и одновременно руководитель Кавендишской лаборатории; в 1905-1918 гг. - профессор Королевской ассоциации в Лондоне.
Ранние работы Томсона посвящены вычислению электромагнитного поля движущегося заряженного шара, теории вихрей, прецизионному измерению отношения абсолютных электрических единиц к электромагнитным. Занимаясь изучением газового разряда, совместно с сотрудниками выполнил серию классических работ, приведших его к открытию электрона - впервые измерил отношение заряда электрона к массе в 1897 г.
Томсон дал объяснение непрерывного спектра рентгеновского излучения, установил природу положительных ионов, предложил первую модель строения атома. В 1911 г. он разработал так называемый метод парабол для измерения отношения заряда частицы к её массе, который сыграл большую роль в исследовании изотопов.
Кавендишская лаборатория за время, когда ее возглавлял Томсон, превратилась в ведущий научно-исследовательский центр. Здесь под руководством Томсона работали Ф. Астон, Ч. Вильсон, Э. Резерфорд, У. Ричардсон и др.
За научные заслуги Томсон был награжден медалями Б. Франклина (1923 г.), М. Фарадея (1938 г.), Копли (1914 г.) и др.
Умер Томсон в Кембридже 30 августа 1940 г.

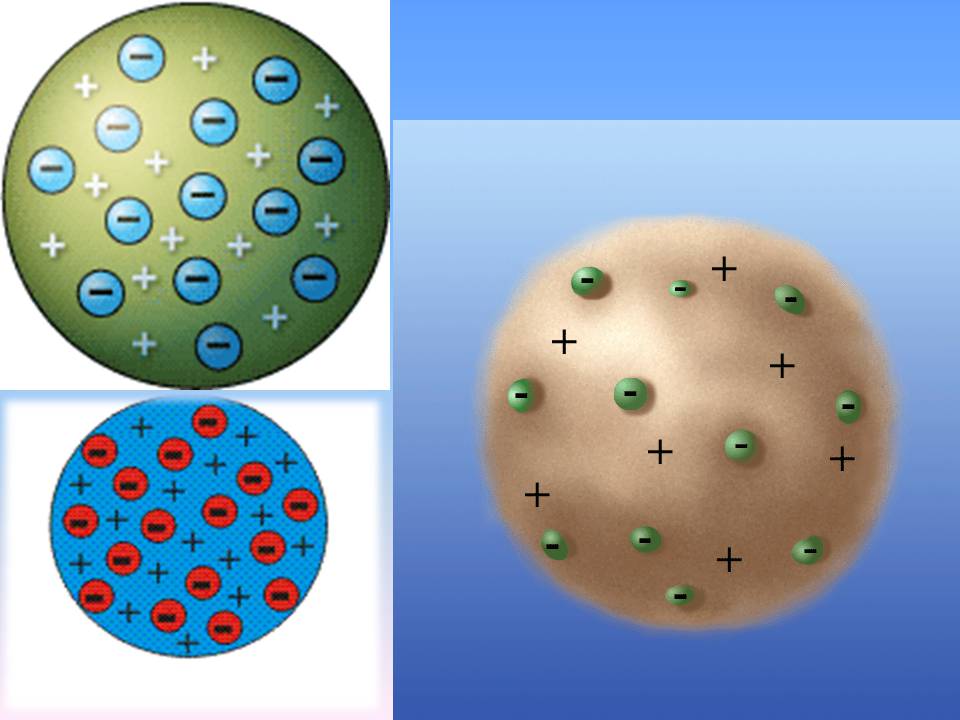
Описание модели
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд…
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Статья Томсона была опубликована в марте 1904 года в Философском журнале (Philosophical Magazine), ведущем британском научном журнале того времени
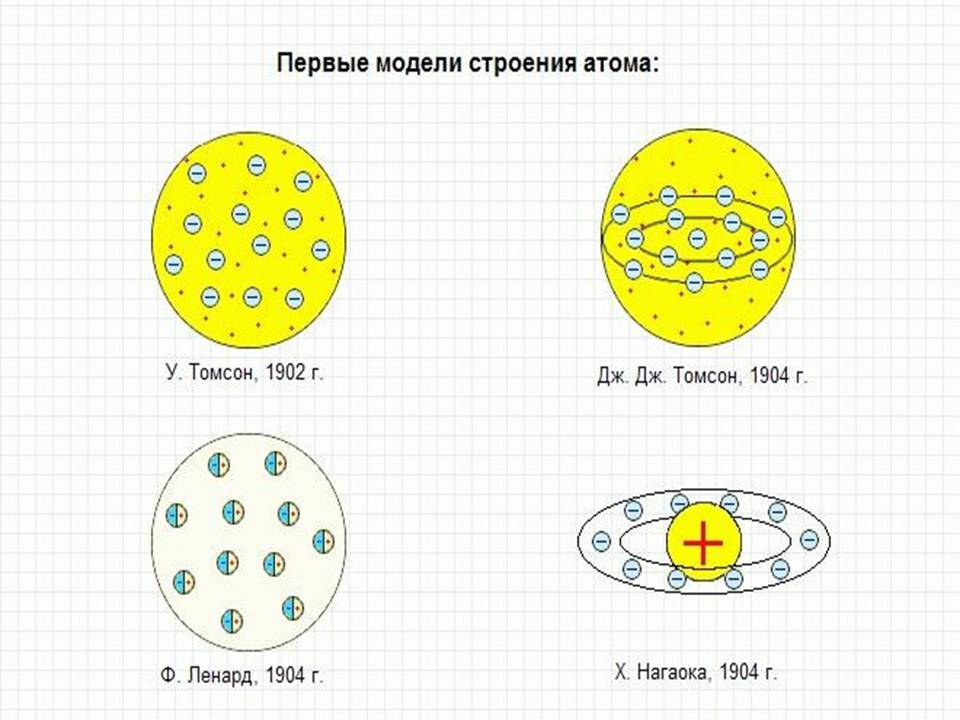
Тем не менее, модель Томсона (также как подобная модель сатурнианских колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла) стала ранним предвестником более поздней и более успешной модели Бора, представляющей атом как подобие Солнечной системы.
Описание модели
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд…
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Статья Томсона была опубликована в марте 1904 года в Философском журнале (Philosophical Magazine), ведущем британском научном журнале того времени
Тем не менее, модель Томсона (также как подобная модель сатурнианских колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла) стала ранним предвестником более поздней и более успешной модели Бора, представляющей атом как подобие Солнечной системы.

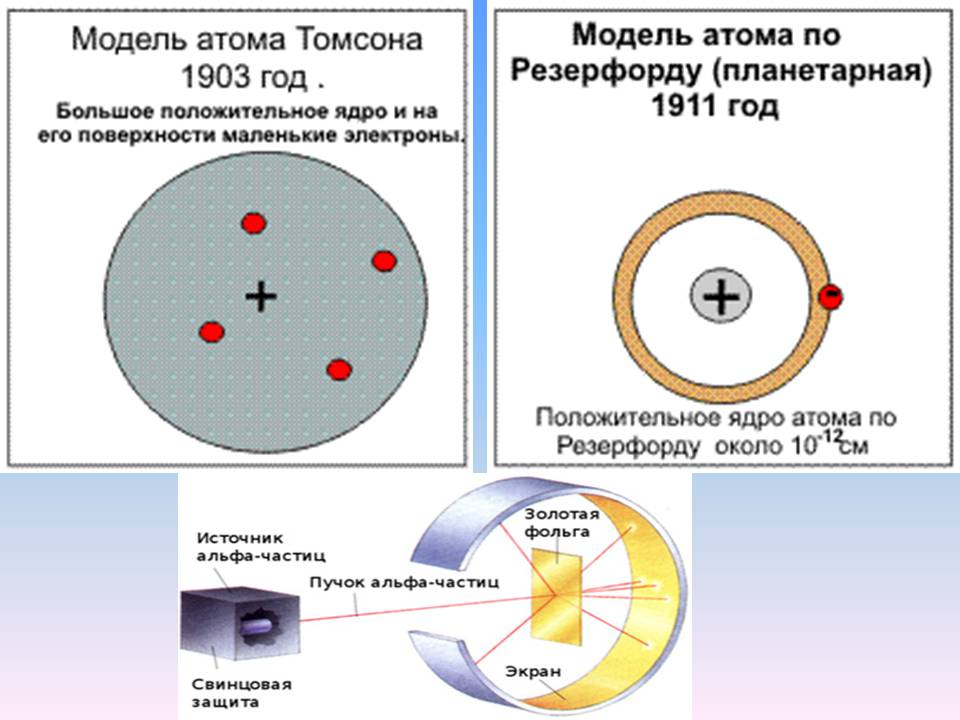
Опровержение модели Томсона
Модель атома Томсона 1904 года была опровергнута в эксперименте по рассеянию альфа-частиц на золотой фольге в 1909 году, который был проанализирован Эрнестом Резерфордом в 1911 году, предположившим, что в атоме есть очень малое ядро, содержащее очень большой положительный заряд (в случае золота, достаточный, чтобы компенсировать заряд около 100 электронов), что привело к созданию планетарной модели атома Резерфорда. Хотя атомный номер золота равен 79, сразу же после появления статьи Резерфорда в 1911 году Антониус Ван ден Брук сделал интуитивное предположение, что атомный номер и является зарядом ядра. Для решения вопроса требовался эксперимент. В 1913 году Генри Мозли экспериментально показал, что эффективный заряд ядра очень близок к атомному номеру (разность, обнаруженная Мозли, была не больше единицы), причём Мозли ссылался только на работы Ван ден Брука и Резерфорда. Эта работа в итоге привела к созданию в том же году модели атома Бора, похожей на Солнечную систему (но с квантовыми ограничениями), в которой ядро, имеющее положительный заряд, равный атомному номеру, окружено равным числом электронов на орбитальных слоях.
Опровержение модели Томсона
Модель атома Томсона 1904 года была опровергнута в эксперименте по рассеянию альфа-частиц на золотой фольге в 1909 году, который был проанализирован Эрнестом Резерфордом в 1911 году, предположившим, что в атоме есть очень малое ядро, содержащее очень большой положительный заряд (в случае золота, достаточный, чтобы компенсировать заряд около 100 электронов), что привело к созданию планетарной модели атома Резерфорда. Хотя атомный номер золота равен 79, сразу же после появления статьи Резерфорда в 1911 году Антониус Ван ден Брук сделал интуитивное предположение, что атомный номер и является зарядом ядра. Для решения вопроса требовался эксперимент. В 1913 году Генри Мозли экспериментально показал, что эффективный заряд ядра очень близок к атомному номеру (разность, обнаруженная Мозли, была не больше единицы), причём Мозли ссылался только на работы Ван ден Брука и Резерфорда. Эта работа в итоге привела к созданию в том же году модели атома Бора, похожей на Солнечную систему (но с квантовыми ограничениями), в которой ядро, имеющее положительный заряд, равный атомному номеру, окружено равным числом электронов на орбитальных слоях.
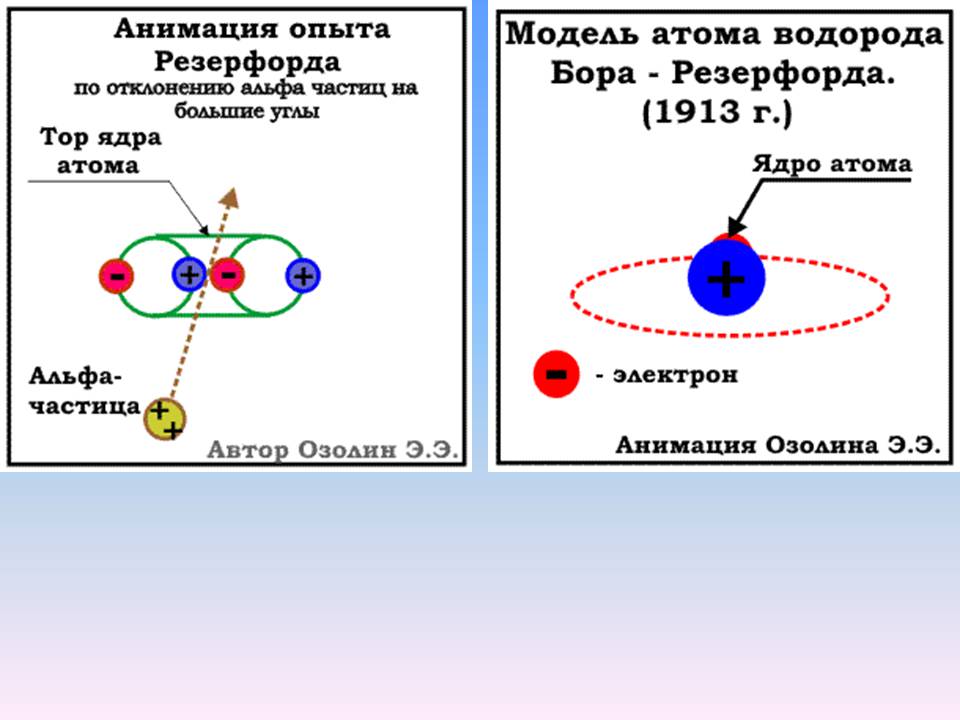
Опровержение модели Томсона
Модель атома Томсона 1904 года была опровергнута в эксперименте по рассеянию альфа-частиц на золотой фольге в 1909 году, который был проанализирован Эрнестом Резерфордом в 1911 году, предположившим, что в атоме есть очень малое ядро, содержащее очень большой положительный заряд (в случае золота, достаточный, чтобы компенсировать заряд около 100 электронов), что привело к созданию планетарной модели атома Резерфорда. Хотя атомный номер золота равен 79, сразу же после появления статьи Резерфорда в 1911 году Антониус Ван ден Брук сделал интуитивное предположение, что атомный номер и является зарядом ядра. Для решения вопроса требовался эксперимент. В 1913 году Генри Мозли экспериментально показал, что эффективный заряд ядра очень близок к атомному номеру (разность, обнаруженная Мозли, была не больше единицы), причём Мозли ссылался только на работы Ван ден Брука и Резерфорда. Эта работа в итоге привела к созданию в том же году модели атома Бора, похожей на Солнечную систему (но с квантовыми ограничениями), в которой ядро, имеющее положительный заряд, равный атомному номеру, окружено равным числом электронов на орбитальных слоях.
Интересные факты
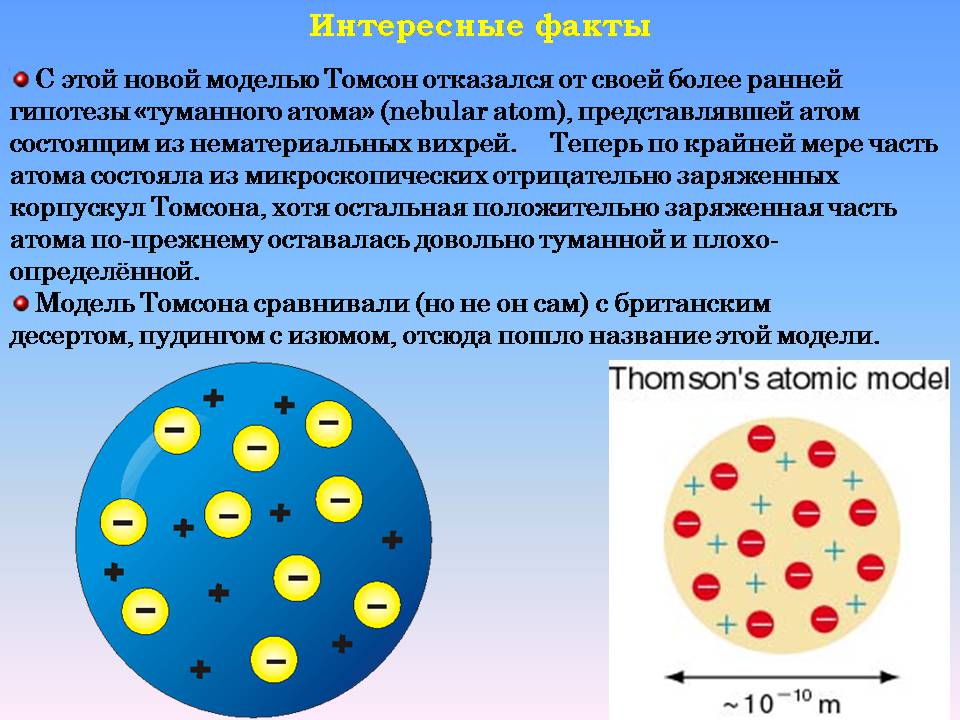
С этой новой моделью Томсон отказался от своей более ранней гипотезы «туманного атома» (nebular atom), представлявшей атом состоящим из нематериальных вихрей. Теперь по крайней мере часть атома состояла из микроскопических отрицательно заряженных корпускул Томсона, хотя остальная положительно заряженная часть атома по-прежнему оставалась довольно туманной и плохо-определённой.
Модель Томсона сравнивали (но не он сам) с британским десертом, пудингом с изюмом, отсюда пошло название этой модели.